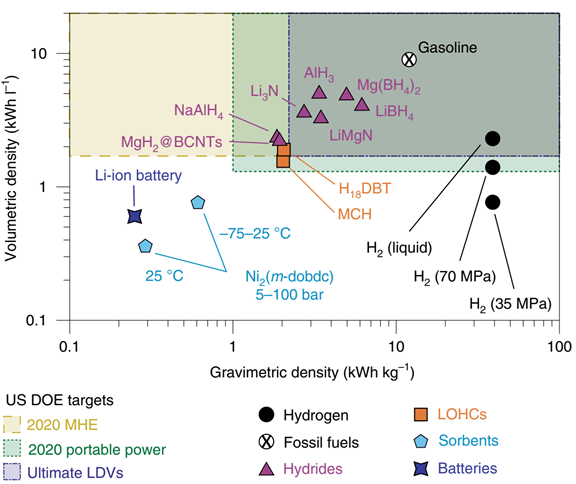
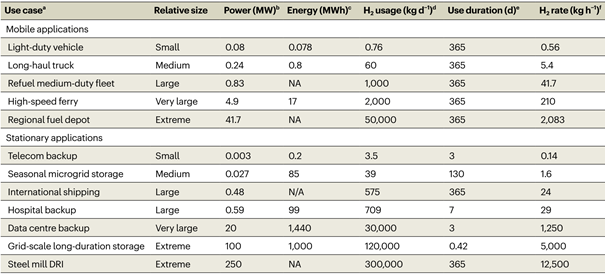
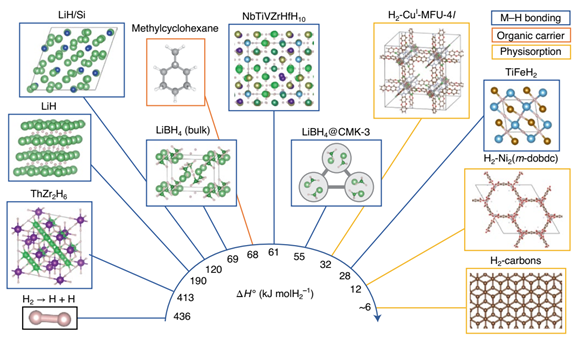
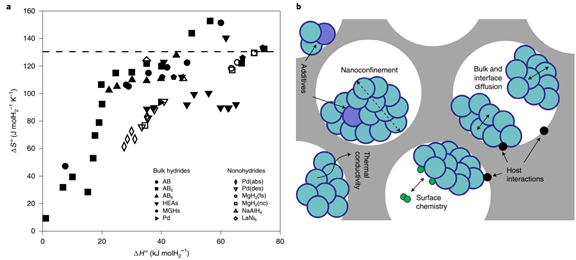
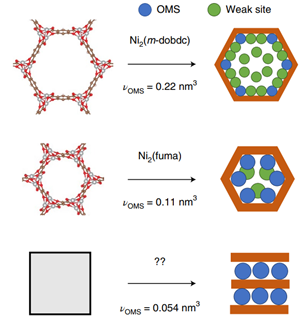
来自美国桑迪亚国家实验室的Mark D.Allendorf 和太平洋西北国家实验室的Mark E. Bowden等在《自然化学》上发表一篇视角文章,阐述氢储运材料的挑战。文章重点总结了有机液态储氢材料(LOHCs,Liquid Organic Hydrogen Carriers)、金属氢化物、吸附剂储氢材料的研究进展和挑战。氢在所有能量载体中具有最高的质量能量密度,在 298 K 时的低位热值(LHV,LowerHeating Value)为 120 MJ kg−1,而汽油仅为 44 MJ kg−1。并且氢燃烧仅产生水。然而,氢储运基础设施发展缓慢,削弱了氢能的经济性和消费吸引力。氢的低体积能量密度更是严重制约了其商业化应用。在已经实现应用的氢能源汽车中,氢密度仅为27 gH2 L−1(700 bar压强),远低于美国能源部(US DOE,US Department of Energy)为轻型车辆(LDVs,Light-Duty Vehicles)设定的50 gH2 L−1的目标。虽然采用冷冻压缩等物理方式可以使氢的密度可达到44 gH2 L−1,但是这种储运方式成本过高。如果既要实现移动应用(比如汽车等),又要满足固定能源应用(比如数据中心等),基于材料的氢储运必不可少。氢是具有多种用途的能源载体。比如,氢储能可用于补偿间歇性可再生能源发电。但是,目前的大部分研究聚焦在交通运输方面的应用(图 1),并侧重于交叉需求,而较少关注诸如使LOHCs 可逆吸脱氢的催化剂这样的特定用途。根据不同应用场景对氢使用和氢存储各个参数的要求(表 1),没有一种储氢材料是万能的。储氢材料的选择通常是在热力学、动力学和容量这三者之间谋求平衡。热力学通常会限制吸附剂和主族氢化物(例如 MgH2 和 LiH)的储氢容量(图 2),动力学则决定了 LOHCs 和复杂金属氢化物吸脱氢的速率。图1 储氢材料的体积和重量能量密度与 US DOE 目标的比较。许多储氢材料的体积和重量能量密度超过了锂电池,但高的氢结合能仍然是实际应用的挑战。应用场景对氢燃料电池的功率和续航时间等方面的要求存在很大差异。氢的高密度存储方式包括压缩气体或低温液化(黑色圆圈)、氢化物(紫色三角形)、LOHCs(橙色方块)、多孔吸附剂中的吸附氢(浅蓝色五边形)。美国能源部为轻型车辆(LDVs,Light-Duty Vehicles,灰色阴影)、物料搬运设备(MHE,Materials-Handling Equipment,黄色阴影)和便携式电源应用(绿色阴影)设定的密度目标。BCNT (Bamboo-shaped Carbon NanoTubes)是竹子形状的碳纳米管。表1 氢能应用场景,主要列举了对氢使用和氢存储等参数的要求备注:a关于表格数据的具体细节,参见支撑文件;b最大即时需求功率,或燃料电池最大输出功率,c所需能量容量;d基于年平均能量消耗计算的日平均氢需求量;e预期连续工作时长;f运行时平均氢消耗量;NA(NotApplicable),不可应用。图2 不同氢储运材料释氢的 ΔH° 范围很大。最稳定金属氢化物的(例如,ThZr2H6;Th,紫色;Zr,绿色;H,淡粉色)ΔH° 和 H-H 键能接近。掺杂(例如,LiH/Si;Li,绿色;Si,蓝色;省略 H)和纳米限域(例如,LiBH4@CMK-3;Li,浅绿色;B,深绿色;H,浅粉色;C,灰色)可以分别相对于非合金或散装材料降低 ΔH° 。LOHCs(例如,甲基环己烷;C,灰色;H,白色)通常具有相似的ΔH° 。高熵合金(例如,NbTiVZrHfH10;Nb,紫色;Ti,蓝色;V,黄色;Zr,浅绿色;Hf,深绿色;H,浅粉色)是一类新兴的储氢材料;它们巨大的组分空间表明他们具有巨大的热力学可调性。一些间隙金属氢化物(例如,TiFeH2;Ti,蓝色;Fe,橙色;H,浅粉色)具有较低的ΔH° ,以至于在接近环境温度时会发生脱氢。氢在典型多孔材料(如 MOF 或有序中孔碳)上的物理吸附对于低温以上的实际容量来说太弱了。两种 MOF,Ni2(m-dobdc) 和CuI-MFU-4l 是例外,由于开放金属位点(C,棕色;O,红色;Ni,灰色;Cl ,绿色;N,蓝色;H,白色)。LOHCs是指在环境条件下呈液态并可逆氢化和脱氢的有机小分子,比如甲醇、甲酸或环烷烃等。它们与现有的以石油为主的基础设施高度匹配,是很有吸引力的氢储运材料。LOHCs 脱氢的产物也要求是液相,这样才有利于现有基础设施的使用。并且,要避免运输和捕获气相物质,如 CO2 和 CO。然而,这一热力学要求往往使得其他物理性质达不到理想状态。脱氢转换频率(TOF,Turnover Frequency)一直是脱氢催化剂努力提高的参数。但是,为了满足功率要求,TOF 必须是完全脱氢所需的平均值,而不仅仅是(初始的)最大速率。例如,据报道的全氢-N-乙基咔唑(H12-NEC; 54 kg H2 m−3)脱氢的 TOF 高达 17.5 s−1,但仅释放了 20% 的可用氢。1因此,需要比理论要求大五倍的储罐才能满足功率的要求。由于 80% 的 LOHCs 未反应,运输的成本也将大大增加。无论应用在哪个领域,LOHCs 发展的主要障碍仍然是确实经济性好、选择性高且效率高的催化剂。作者们提出了异相、均相相结合的催化剂,即在 Mg-MOF-74 中修饰不饱和配位的 Ni2+。2 该催化剂与雷尼镍醇脱氢的速率相当。对于移动应用(比如氢能源汽车)中,储氢体积和质量的最小化至关重要,同时也需要平衡H2 释放热力学和可逆容量。对于固定能源应用,质量容量不是问题,但体积容量仍然很重要(表 1)。金属氢化物的体积容量很高,是 700 bar 压缩氢气的两倍以上。但是,那些具有很高体积容量的金属氢化物,由于金属和氢(M-H)之间的强相互作用,它们的脱氢速率很低。根据范特霍夫方程,解决这一问题的关键是最大化熵变,同时最小化焓变。降低 ΔH° 的方法比较直接,比如共晶熔化、微结构诱导应变、高熵金属合金化和组分调控等方法。然而,独立调整ΔS°的策略还尚未发现或证实。令人鼓舞的是,作者使用机器学习发现高熵合金的脱氢 ΔS° 与相应的体积变化有关。3将此结果与几种缺乏明确的熵-焓相关性的氢化物(图 3a)相结合,显示了独立调控 ΔS°的可能性。金属氢化物纳米化实现这一调控的有效策略(图 3b)。图3 金属氢化物的纳米限域会产生多种效应,这些效应会导致 ΔH° 和 ΔS° 相互关联。(a)如果 ΔH° ≥ 20 kJ molH2−1,则块体金属氢化物(实心符号)的 ΔS° 与 ΔH° 的趋势很难辨别。相比之下,纳米级氢化物(空心符号)表现出很强的熵-焓相关性。一般认为金属氢化物脱氢的ΔS° 等于气体 H2 的熵(130.5 J molH2−1 K−1;水平虚线),但测量值表明这种情况很少发生。HEAs(High-Entropy Aalloys),高熵合金;MGHs(Main-Group Hydrides),主族氢化物;MgH2(fs)(Free-Standing Magnesium HydrideNanoparticles),无支撑氢化镁纳米纳米颗粒;MgH2(nc) (Nanoconfined Magnesium Hydride),纳米限域氢化镁;AB(Interstitial Hydride with A and B sites),具有A和B位点的间隙氢化物;Pd(abs)(Thermodynamicsfor Hydrogen Absorption by Palladium),Pd热力学吸氢;Pd(des)(Thermodynamics for Hydrogen Desorptionby Pd),Pd热力学脱氢。(b)多孔材料(灰色)内金属氢化物(绿色)的纳米限域。纳米颗粒直径越小(虚线双箭头),比表面积就越大,吸脱氢的热力学和动力学性质也会发生改变。在纳米尺度上可以观察到金属卤化物(添加剂,紫色圆圈)等化合物对氢化物反应动力学的加速。具有给电子或接受电子的基团(黑色圆圈)的多孔主体材料可以降低纳米团簇的流动性,并通过电荷转移相互作用改变金属氢化物的反应性。表面熵和无序性,以及缺陷、杂质或氧化(表面化学),都对 H2反应性和动力学有影响。多孔主体还可以通过更有效的热量传输来加速反应。吸附剂的等温吸附热(qst)太低以至于难以应用于非低温条件下运行的氢能源汽车,但不会成为固定能源应用的障碍(表 1)。虽然通过强结合位点的插入可以改善热力学性质,但现有吸附剂材料的体积密度仍难以满足 US DOE 设定的轻型车辆储氢的目标。目前,唯一具有足够设计通用性的吸附剂是金属有机框架(MOFs,Metal Organic Frameworks),特别是那些具有开放金属位点(OMSs,Open Metal Sites)的吸附剂。这些 OMSs 具有暴露的电荷密度,可以与 H2 产生较强的相互作用。最佳吸附热(15 < qst <20kJ mol−1)是 MOFs 具有高容量的必要条件,另外,还需要较低的单位OMS 结晶体积 (vOMS)。图 4 显示了 νOMS 逐渐降低的Ni2(m-dobdc)(m-dobdc = 4,6-dioxido-1,3-benzenedicarboxylate,)、Ni2(fuma)(fuma = 2,3-dihydroxyfumarate) 和假设的高密度 OMSs 材料。Ni2(m-dobdc) 和 Ni2(fuma)的 qst 均低于最佳范围。即使可以将 qst 增加到最佳范围,不够低的 νOMS 使它们仍然无法满足 US DOE目标(50 gH2 L−1)。极低 νOMS 的MOF(如假设材料)有可能实现这一目标,但 qst 仍需在最佳范围。过大 qst 会降低刚性 MOFs 的可用容量。柔性MOFs 却可以避免这种情况。柔性 MOFs 会经历无孔到多孔的转变,并通过强氢-OMSs 相互作用来稳定结构。因此,作者认为吸附剂开发工作应针对那些具有在无孔状态下被埋藏的 OMSs,并且OMS-H2 相互作用较强 (≥15 kJ mol−1)的柔性材料。这些有利于更接近环境温度的无孔-多孔转变。图4 高OMSs密度的MOFs。Ni2(m-dobdc)、计算预测的 Ni2(fuma) 和一种未知的假设材料(显示为灰色方块)的示意图,具有不同 OMSs 和弱吸附位点的比例以及不同的νOMS值。文章链接:https://doi.org/10.1038/s41557-022-01056-21. Peters, W.; Seidel, A.; Herzog, S.; Bösmann,A.; Schwieger, W.; Wasserscheid, P., Macrokinetic effects inperhydro-N-ethylcarbazole dehydrogenation and H2productivity optimization byusing egg-shell catalysts. Energy &Environmental Science 2015, 8 (10), 3013-3021.2. Snider, J. L.; Su, J.; Verma, P.; El Gabaly,F.; Sugar, J. D.; Chen, L.; Chames, J. M.; Talin, A. A.; Dun, C.; Urban, J. J.;Stavila, V.; Prendergast, D.; Somorjai, G. A.; Allendorf, M. D., Stabilizedopen metal sites in bimetallic metal–organic framework catalysts for hydrogenproduction from alcohols. Journal ofMaterials Chemistry A 2021, 9 (17), 10869-10881.3. Witman, M.; Ek, G.; Ling, S.; Chames, J.;Agarwal, S.; Wong, J.; Allendorf, M. D.; Sahlberg, M.; Stavila, V., Data-DrivenDiscovery and Synthesis of High Entropy Alloy Hydrides with TargetedThermodynamic Stability. Chemistry ofMaterials 2021, 33 (11), 4067-4076