
11月10日,来自美国康奈尔大学、耶鲁大学和班牙阿利坎特大学的研究者们首次发现了单晶 Pt 表面氧还原反应的逆动力学同位素效应,相关成果发表在《自然化学》上。多重质子耦合电子转移(PCET,Proton-Coupled Electron Transfer)对于许多涉及电化学反应的可再生能源技术至关重要,比如太阳能电池、燃料电池、电解水制氢以及 CO2 和 N2 电还原等。作为自然界中最普遍的氧化剂,氧气是能源系统的核心,无论是在生物的呼吸作用,还是燃料电池,甚至是简单的燃烧。可再生能源技术的效率一直无法与生物酶相提并论,部分原因是对原子尺度上的关键过程还不了解,例如氢燃料电池中的氧还原反应(ORR,Oxygen Reduction Reaction)。探索这种电化学机制(以及其他机制)的一个关键工具是动力学同位素效应(KIE,Kinetic Isotope Effects)的测量。在过去的几十年里,设计和开发有效的电催化剂以加速缓慢的 ORR 一直是大规模实现燃料电池技术的主要推动力。经过数十年的机理研究,人们普遍认为ORR 的决速步骤(RDSs,Rate-Determining Steps)涉及 PCET 过程,从而形成关键反应中间体(HO2、H2O2、OH等);因此,KIE 研究可以为复杂 ORR 机制中的PCET 提供有价值的见解。反应的 H/D KIE 值定义为 H2O 中的动力学电流与 D2O 中的动力学电流之比。通常质子转移和 PCET 反应的 KIE 大于 1,即为正常 KIE。当 D2O 中的活性高于 H2O 中的活性时(< 1),即逆 KIE。尽管 KIE 研究已尝试在氢氧化/析出反应(HOR/HER,Hydrogen Oxidation/Evolution Reactions)和氧还原/析出反应(ORR/OER,Oxygen Reduction/Evolution Reactions)等关键电化学反应中进行,但对 KIE 仍然欠缺了解。这主要是由于缺乏化学超高纯度的 D2O 和清洁的单晶电极表面,以开展有说服力的研究。在这项研究中,作者开发出了一种制备超高纯 D2O的新方法,从而得以适用于高质量单晶 Pt 表面 KIE 的研究。研究结果证实了单晶 Pt 表面的逆 KIE,无论是在酸性还是在碱性环境下。这一逆 KIE 与相同电位下 *OD 的覆盖率远低于 *OH 的覆盖率有关(*代表铂表面上的吸附物质)。一氧化碳溶出伏安测试为较低的 *OD 覆盖率和较弱的 *OD 结合强度提供了直接证据,密度泛函理论(DFT,Density Functional Theory)计算做了进一步的解释。此处报告的逆 KIE 与 Markovic 及其同事在 25 年前提出的假设相呼应,1 即关于 *OH 对低晶面指数 Pt 表面ORR 活性的抑制作用。同时,D2O 中增加的 ORR 活性也证明了 *OH/*OD 与 *O2 之间存在竞争吸附的关系。D2O 和 H2O 中 Pt (111) 的循环伏安(CV,Cyclic Voltammetric)曲线显示几乎相同的氢吸附/解吸区域,并且 OD 吸附(*OD)区域与 H2O中的形状相同,表明 D2O 和 H2O中为类似清洁的 Pt (111) 表面(图 1a)。但是,*OD 的特征峰(0.824 V)相对于 *OH(0.792V)正向偏移了 32 mV(图 1a)。另外,*OD 在 0.8 V 附近的峰的半峰宽为 ~ 30 mV,而 *OH 的半峰宽为 ~ 20 mV,表明 *OD 与 Pt (111) 表面之间的相互作用更弱。2 在 0.9 V 时,*OD 显示与 *OH几乎相同的积分电荷(分别为 115 µC cm−2 和 118 µC cm−2),这表明 *OD 和 *OH 达到几乎相同的最大覆盖率(图 1b);然而,在 0.8 V 时,*OD 的积分电荷为 65 µC cm−2,远低于 *OH (105 µC cm−2)。这表明在小于 0.9 V 的电位下,Pt (111) 表面 *OD 覆盖率(θOD) 比 *OH 覆盖率 (θOD) 低得多。因此,相对于 H2O,D2O 中有更多自由Pt位点用于 O2 吸附。
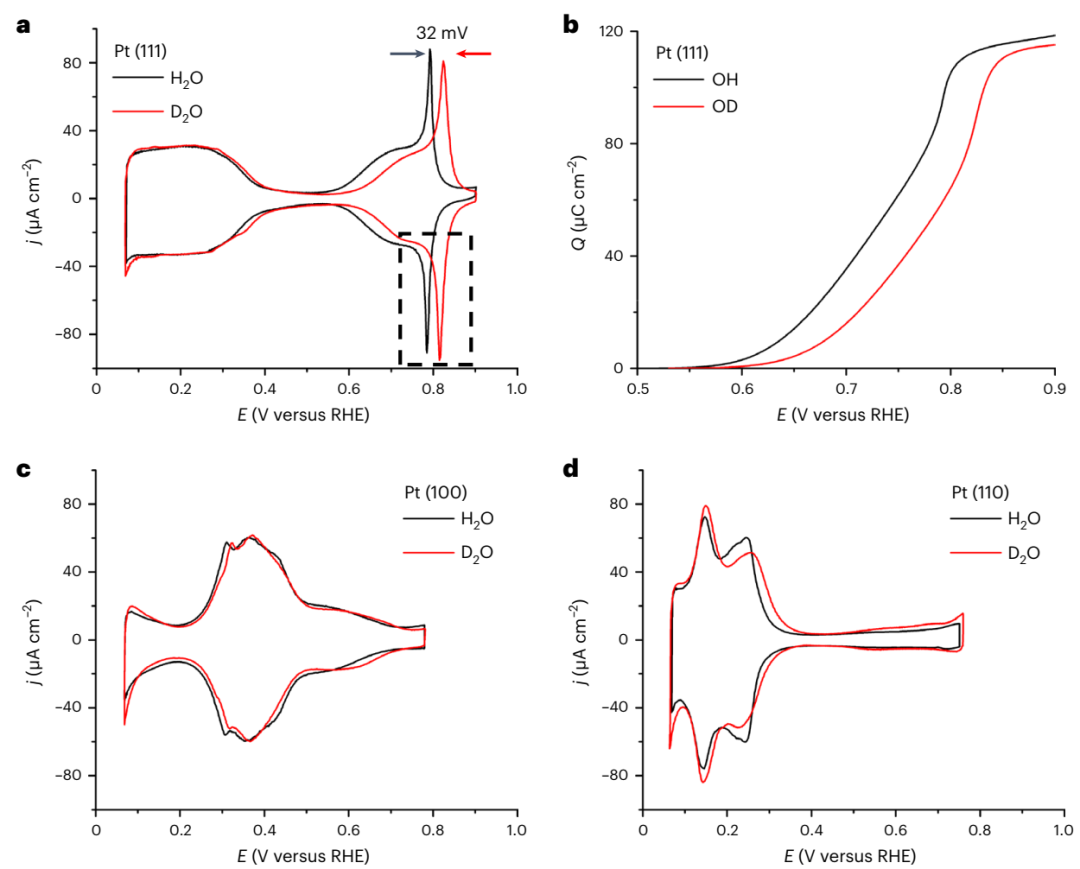
图1 酸性、超高纯 H2O 和 D2O 中单晶Pt的循环伏安曲线。(a)Pt (111) 在饱和 0.1 M HClO4 的 H2O 和 D2O 中的循环伏安曲线显示 OD 吸附/解吸峰的电位比 OH 峰高 32 mV。在 *OH/*OD 区域中观察到的尖峰(虚线框)对应于覆盖率的快速衰减。(b)从 a 中的吸附曲线中提取的 Pt (111) 的 OH 和 OD 覆盖率。(c)Pt (100) 和(d)Pt (110) 的伏安特性曲线。CV测试之后,作者采用旋转圆盘电极(RDE,Rotating Disk Electrode)伏安法进行 ORR 动力学研究。在酸性 D2O 中,Pt (111) 表现出明显增强的 ORR 动力学,相对于可逆氢电极的半波电位(E1/2)为 0.890 V,比酸性 H2O 的(0.854 V)高 46 mV(图 2a)。如图 2d 所示,酸性 D2O中的 Pt (111) 表现出低于 1 的 KIE,即逆 KIE。H/D KIE 值从 0.9 V 到 0.8 V 的衰减(图 2d)正是 θOD和 θOH差异显著增加的电位范围(图 1b)。另外,在 Pt (100) 和 Pt (110) 表面也观察到了逆 H/D KIE(图 2b-d)。三种单晶 Pt 表面在酸性 H2O 和 D2O 溶液中 ORR 的活性趋势为:Pt (111) ≈ Pt (110)⟩>> Pt (100)。
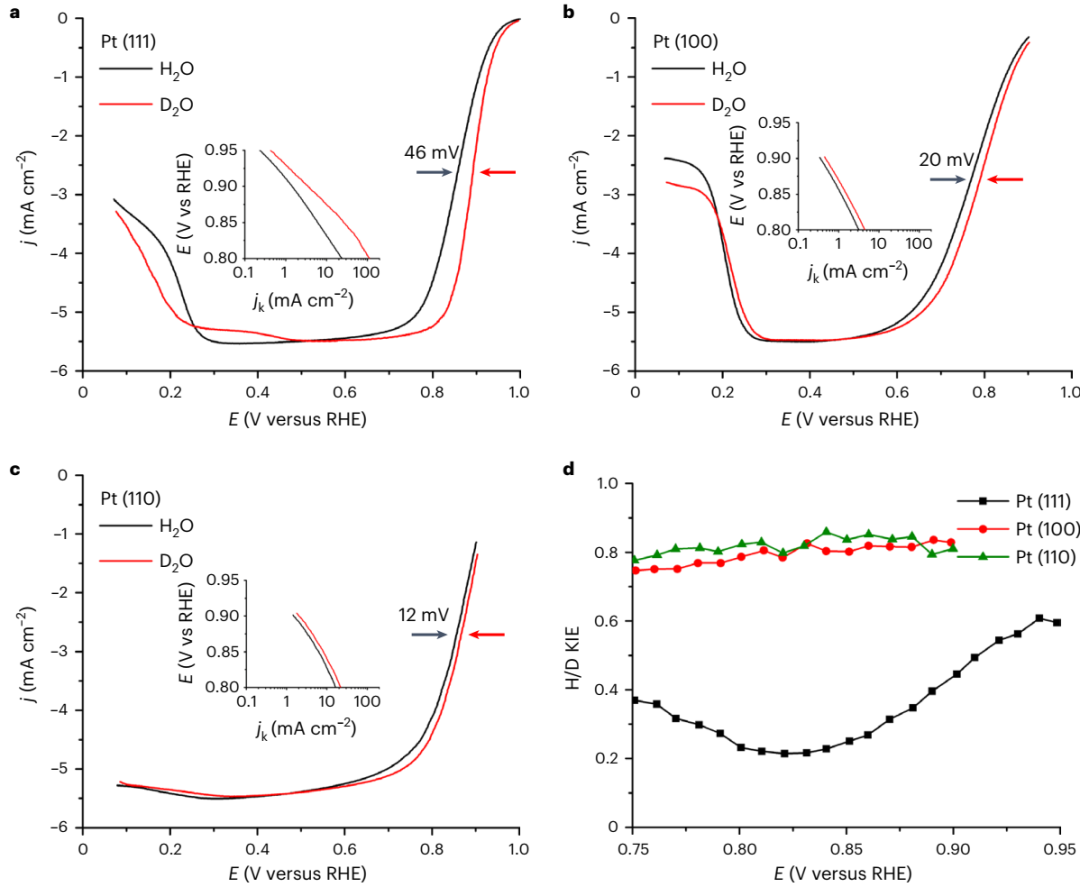
图2 酸性、超高纯 H2O 和 D2O 中单晶Pt的 ORR 动力学测试。(a)Pt (111),(b)Pt (100)和(c)Pt (110) 表面ORR 极化曲线 (测试条件为 0.1 M HClO4 H2O/D2O的O2 饱和溶液,1600 r.p.m。插图为Tafel曲线)。(d)相应的 H/D KIE 数值。 为了进一步了解单晶 Pt 表面的 *OD 和 *OH 相互作用,作者进行了 CO 溶出伏安测试(图 3)。D2O 中更高的 CO 溶出峰进一步表明,在相同电位下 OD 在表面的结合强度更弱, OD 覆盖率也更低。在碱性溶液中,单晶 Pt 的 ORR 同样表现逆 KIE。如图 4a 所示, *OD 的吸附峰(0.817 V)比 *OH 的高 40 mV。碱性 D2O 中的 ORR 半波电位为 0.928 V,高出碱性 H2O 中的 0.881 V。碱性溶液中的 KIE 值约为 0.4,与酸性溶液中的值接近。理论计算为 *OD 峰相对于 *OH 峰的正向移动提供了更深入的解释(图 4c)。计算结果表明, OD 和 OH 吸附能的差异主要源于 O-H 和O-D 拉伸震动零点能的差异。并且,理论计算的结果与实验结果很吻合(图 4d)。
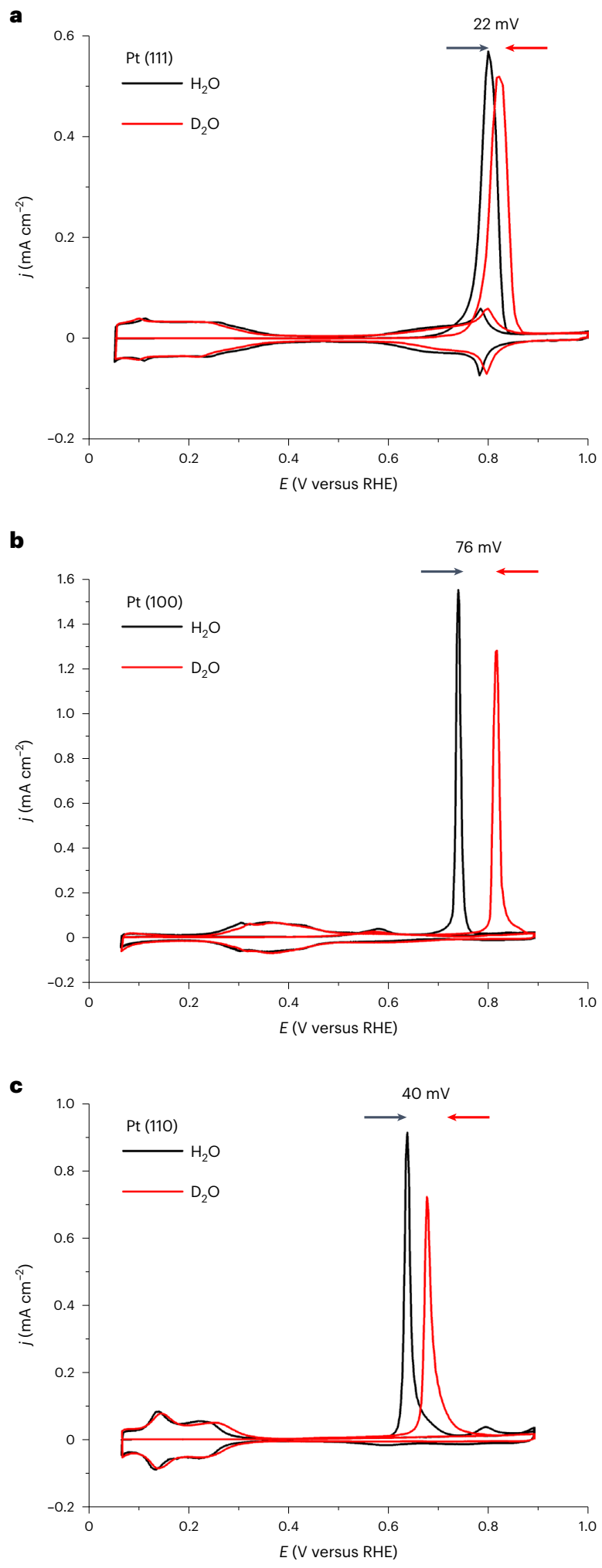
图3 酸性、超高纯 H2O 和 D2O 中单晶 Pt 的 CO 氧化动力学测试。(a)Pt (111),(b)Pt (100)和(c)Pt (110) 的 CO 溶出伏安测试曲线。
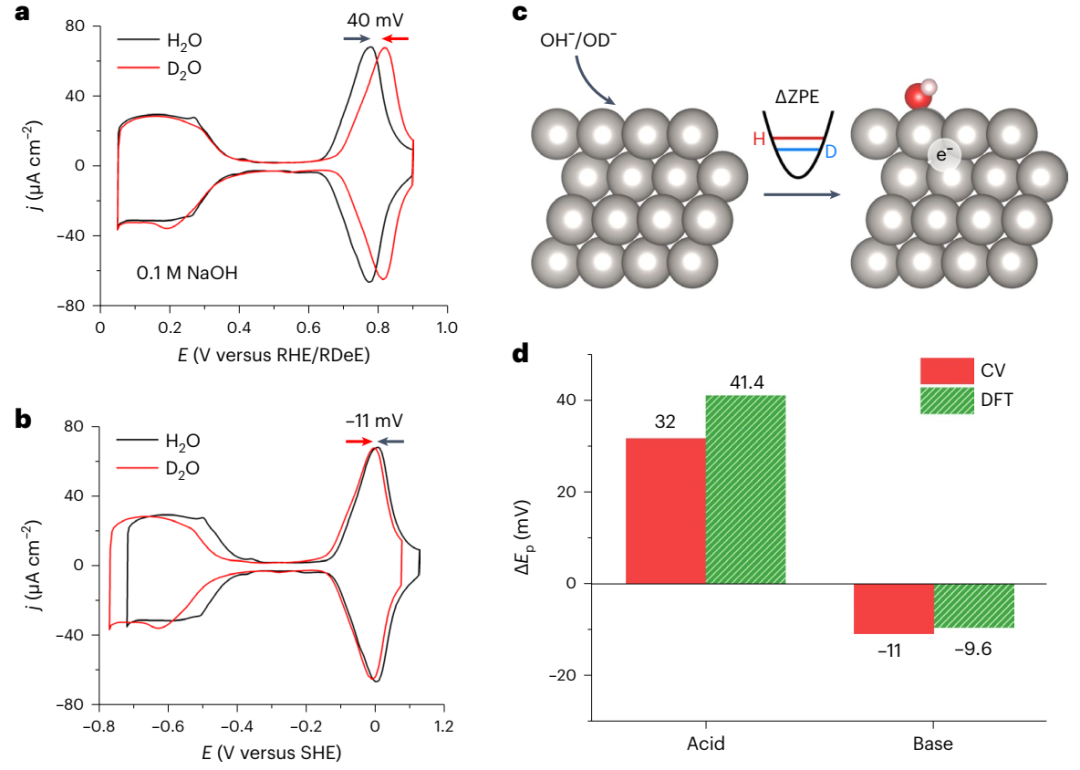
图4 碱性、超高纯 H2O 和 D2O 中单晶 Pt (111) 表面的循环伏安曲线以及 OH 和 OD 吸附的理论计算。(a,b)Pt (111) 在 Ar 饱和的 0.1 M NaOH H2O/D2O溶液中的循环伏安曲线:(a)以可逆H/D电极为参照,(b)以标准氢电极为参照。(c)Pt (111)表面上 OH 和 OD 吸附过程的 DFT 计算示意图,吸附能差异主要源于 O-H 和 O-D 拉伸震动零点能的差异。(d)Pt (111) 表面上 OH 和 OD 吸附峰位移的实验(红色)和理论(绿色)结果。商用 Milli-Q 水系统通常使用离子交换树脂和活性炭柱纯化 H2O,然后再进行紫外线处理和 0.22µm 过滤器去除细菌。这种方法纯化的 H2O 具有 >18 MΩ cm 的电阻率和 < 5ppb 的总有机碳。作者纯化 D2O 的灵感部分来自于这种方法。还有部分灵感来源于一种先蒸馏,再添加氢氧化钠和高锰酸钾,再次蒸馏的方法。3该方法背后的逻辑是通过蒸馏去除离子并将痕量有机物氧化成非挥发性物质,以便它们也可以通过蒸馏去除。具体过程如下:首先,将商用 D2O 通过自制的离子交换树脂玻璃柱。玻璃柱含有阳离子和阴离子混合的交换树脂(UCW3700,Polysciences),可将离子杂质交换为 H+ 或 OH−。然后,向经离子交换树脂柱过滤的 D2O 中加入 0.35 wt% KOH 和 0.05 wt% KMnO4。使用具有 14/20 接头的短程蒸馏头蒸馏所得混合物。使用 2 × 100 g 的 D2O 原料瓶和 300 ml 圆底蒸馏瓶和 250 ml 接收瓶在 N2 气流下进行蒸馏,以防止 CO2 污染。最终产品为~ 180 g 纯化的 D2O,被储存在火焰密封的 50 ml 玻璃安瓿中。文章链接:https://doi.org/10.1038/s41557-022-01084-y1. Markovic, N.; Gasteiger, H.; Ross, P. N., Kinetics of Oxygen Reduction on Pt(hkl) Electrodes: Implications for the Crystallite Size Effect with Supported Pt Electrocatalysts. Journal of The Electrochemical Society 1997, 144 (5), 1591.2. Berná, A.; Climent, V.; Feliu, J. M., New understanding of the nature of OH adsorption on Pt(111) electrodes. Electrochemistry Communications 2007, 9 (12), 2789-2794.3. Armarego, W. L., Purification of laboratory chemicals. Butterworth-Heinemann: 2017.










