全世界约有6.55亿人受到骨关节炎(OA)的影响,骨关节炎是导致老年人慢性疼痛和残疾的主要原因之一。OA具有高度异质性,但根据病理生物学机制定义患者亚群是一项具有挑战性的任务:临床表型可能具有几种分子内型,其中骨驱动型、炎症(滑膜炎)驱动型和软骨驱动型是大家公认的几种。目前很少疾病改善性OA药物(DMOAD)进入临床,因此目前的治疗主要集中在使用非甾体抗炎药和阿片类药物改善症状性疼痛,或最终进行全膝关节置换以恢复关节功能。DMOAD现在已经成为药物开发的重点,其目标是减轻潜在的病理学,或者理想情况下,再生受损的关节组织,同时缓解疼痛症状。
大多数现有DMOAD和正在开发的DMOAD都针对软骨驱动的内型,因为软骨基质损伤(包括软骨细胞衰老和凋亡)是OA发病机制的中心事件。目前还没有一种疗法能够成功地改变疾病的长期进展,这表明临床上对新型DMOAD或再生疗法的巨大需求。
近日,瑞士诺华生物医学研究所Nicole Gerwin等人报道了血管生成素样3衍生物LNA043作为OA的一种有前途的新型DMOAD治疗方案。

LNA043因其促进原代人间充质干细胞软骨生成(软骨发育过程)的能力及其对炎性刺激后关节软骨细胞软骨生成活性的保护作用而被确定为OA的潜在治疗方法。在目前的研究中,研究结果表明,LNA043在临床前大鼠和猪模型中诱导软骨生成、软骨基质合成,甚至关节软骨再生。
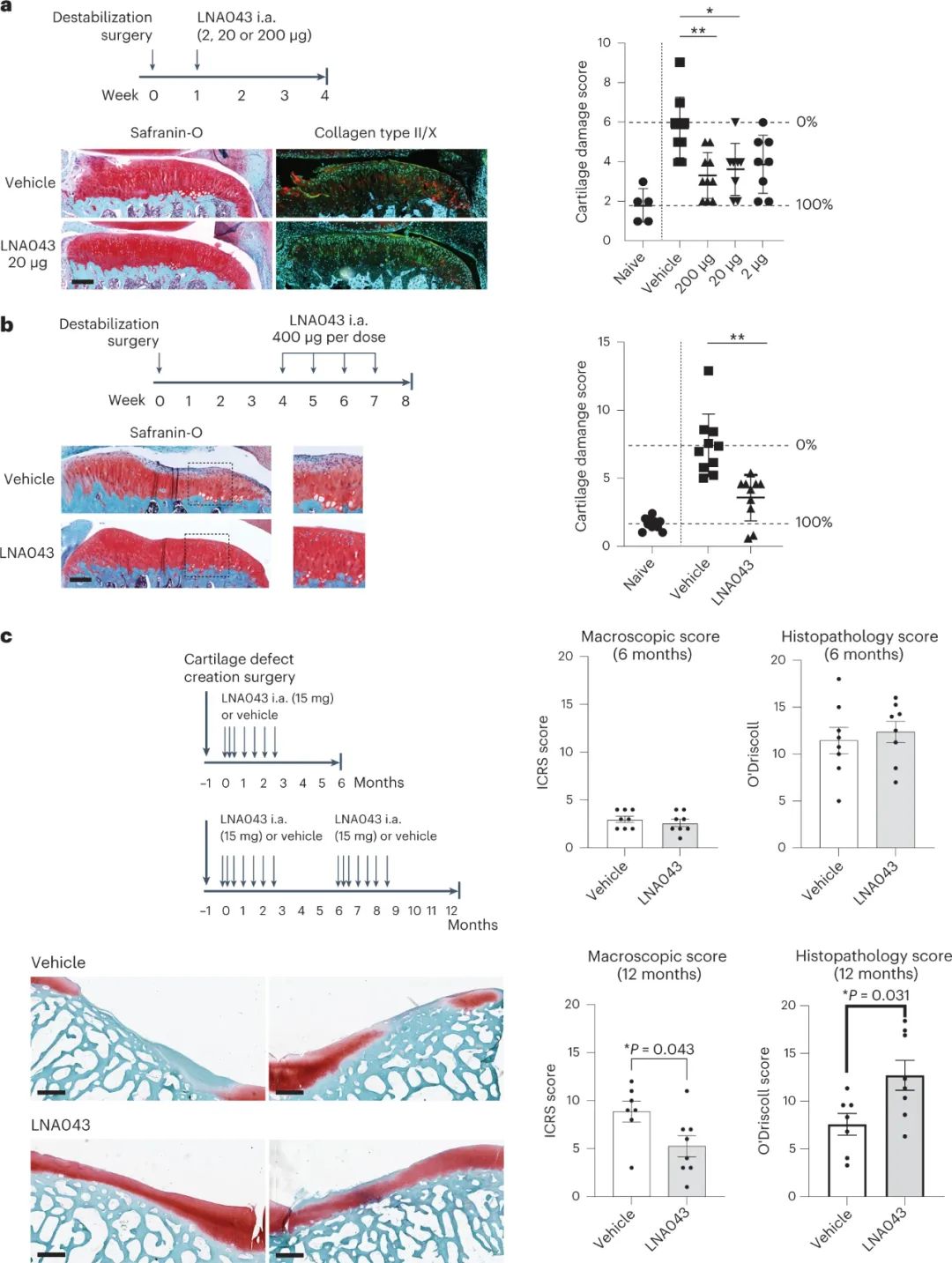
图|LNA043治疗在大鼠OA和小型猪软骨损伤模型中再生软骨
第一项人体临床试验招募了28名膝关节OA患者在全膝关节置换术前2 h、 7d或21 d在关节内注射LNA043或安慰剂。发现LNA043安全且耐受性良好,符合试验的主要安全终点。与服用安慰剂的患者相比,LNA043治疗患者术后采集的软骨转录组分析显示,对OA转录组的影响相反:参与合成代谢信号通路的软骨基质成分和蛋白质的表达被诱导,而OA介质的表达被抑制。这些结果表明LNA043是膝关节骨性关节炎患者软骨修复的一个有希望的候选物,并促使启动2b期试验。
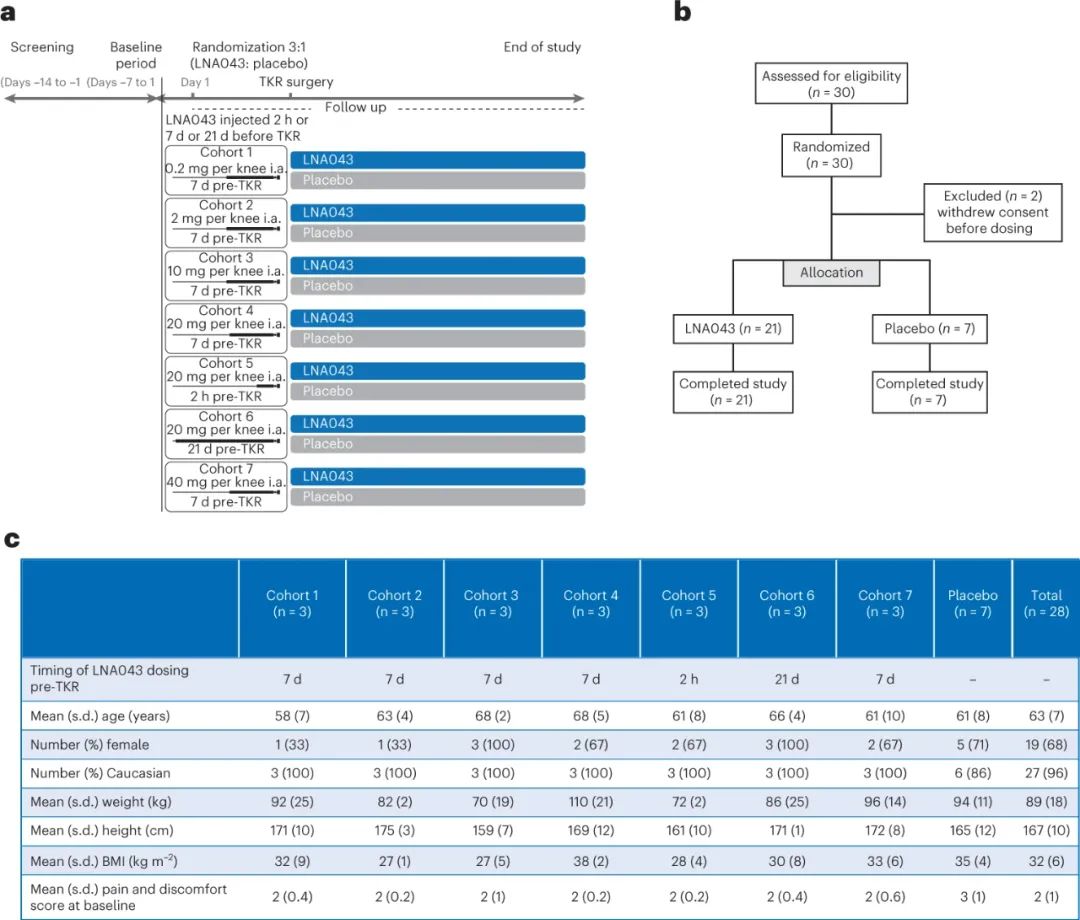
图|LNA043 FIH研究设计和基线数据
转录组学结果和体外试验数据使研究人员能够产生第一个LNA043作用机制假说。FN1似乎在LNA043调节的基因中起着核心作用,因为它是LNA043显著下调长达21d的仅有三个基因之一,并且是在RAAK研究中首次发现的LNA043反调节OA基因的中心相互作用伙伴。FN1是一种粘附性糖蛋白,是软骨ECM的原纤维成分,在基质组装和细胞-基质界面中充当桥接分子。FN1通过激活祖细胞的增殖、迁移和软骨分化来促进软骨修复。然而,在骨性关节炎中,会产生FN1剪接变异体和片段,诱导细胞因子和蛋白酶的表达,从而建立一个降解和炎症反馈环,从而加重骨性关节炎。观察到LNA043对骨性关节炎软骨中FN1的长期下调可能因此阻止了FN1剪接变体和片段的产生,从而阻止了骨性关节炎的恶化。
FN1通过与软骨细胞上表达的整合素α5β1受体结合来发挥作用,甚至高出10倍,在软骨祖细胞上表达。整合素介导软骨细胞与其周围的ECM之间的相互作用,尤其是FN1和II型胶原,从而调节细胞的分化、增殖、存活和基质重塑,并作为力学转导。重要的是,研究人员发现LNA043与重组整合素α5β1结合,这让研究人员假设LNA043至少通过与FN1受体结合和模仿FN1的软骨修复效应发挥其至少部分活性。研究人员证明了LNA043与整合素α5β1的结合介导了WNT信号抑制物Dkk1在软骨细胞中的分泌,LNA043治疗上调了Dkk1和FRZB(另一种WnT抑制物)在人骨关节炎软骨中的表达。
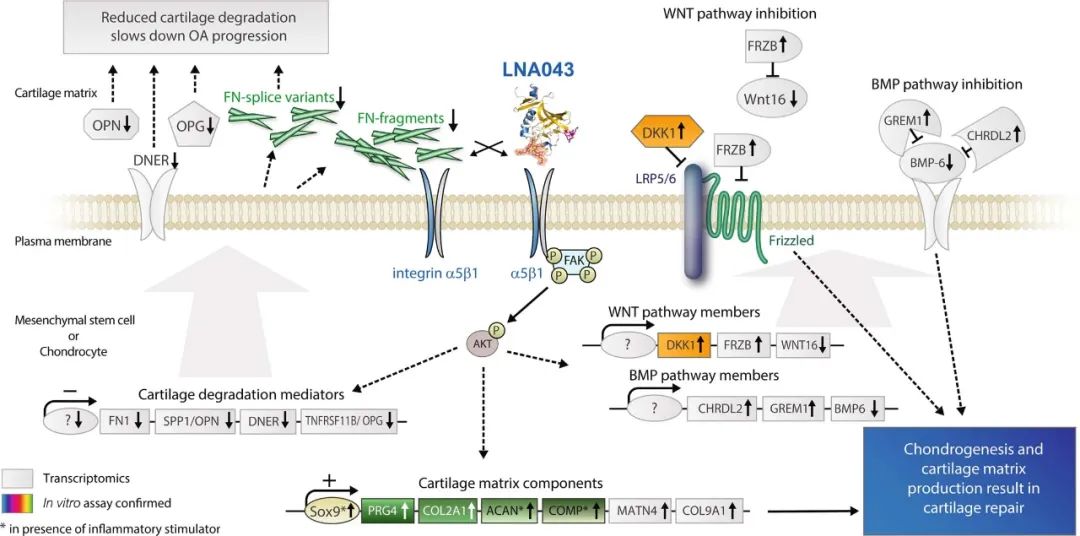
图|LNA043 MoA假设
综上所述,该研究结果表明,LNA043通过模拟FN1与其在骨髓间充质干细胞和软骨细胞上的整合素α5β1受体的结合来诱导透明软骨修复,从而反向调节诱导的基因在骨关节炎中的表达。LNA043对骨性关节炎软骨的这些广泛作用是否都是由LNA043与整合素α5β1结合所介导的,还是LNA043有额外的分子靶点,还需要进一步的研究。为了调查这项研究中观察到的LNA043的活性是否转化为临床益处,LNA043目前正处于膝骨性关节炎患者的2b期试验中。
参考文献:
Gerwin, N., Scotti, C., Halleux, C. et al. Angiopoietin-like 3-derivative LNA043 for cartilage regeneration in osteoarthritis: a randomized phase 1 trial. Nat Med (2022).
https://doi.org/10.1038/s41591-022-02059-9











