特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。
原创丨爱吃带鱼的小分子
编辑丨风云
目前,与开发阴阳极的相比,电解质的开发较少受到关注,而电解质控制着离子和电荷的流动,它在物理上将两个电极与直接电子转移隔离,同时允许工作离子将电荷和质量传输到整个电池,从而使电池反应可持续进行,是与所有其他物质紧密接触的唯一成分,同时电解质也参与了动力学形成的界面以增强电池的稳定性。电解质决定了电池反应的速度(功率密度)和电池的充放电次数(可逆性)。
同时,为了最大限度地提高能量密度,电池中的电极经常被推到极端电位下工作,在这种情况下,没有已知的电解质是热力学稳定的。而在锂离子电池(LIB)等电池中,必须在动力学上实现电解质和电极之间的稳定性。因此,微量电解质被牺牲性地分解,其固体产物沉积在电极表面上(形成固体电解质界面(SEI)),形成保护层(“相间”)防止进一步分解的保护,但几个不太确定因素使其变得复杂:(i)大多数过渡金属氧化物阴极材料已经带有Li2CO3的天然钝化层,而Li2CO3又通过纯化学途径与电池环境中的酸性电解质反应;(ii)通过电化学途径进一步进化,最终形成阴极电解质界面(CEI)化学; (iii)阴极材料的表面也可能参与演变,形成中间阶段,影响CEI的作用。
基于此,美国芝加哥大学孟颖(Y. Shirley Meng)教授等研究综述了目前设计和开发新型电解质的关键:由于电解质在电池设计的独特的作用,必须同时满足许多约束条件:(i)快速传输离子和质量、(ii)有效地绝缘电子以及(iii)保持对强氧化阴极和强还原阳极的稳定性。同时电解质又和界面化学密切相关,所以设计更好的电解质意味着调整和平衡一系列属性,范围从本体到界面结构和稳定性到界面化学和形态。论文以《Design better electrolytes》题发表在Science上。
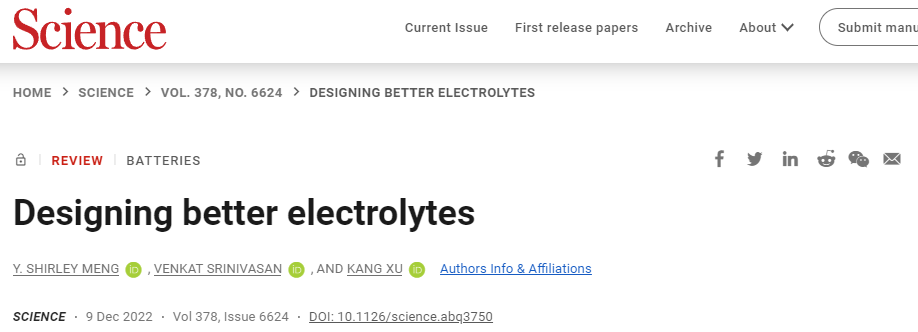
由相间启用的锂离子电池
锂离子电池(LIB)的能量密度和可再充电性取决于界面(图1)。目前商用电解质几乎完全遵循由溶解在碳酸酯溶剂混合物中的六氟磷酸锂(LiPF6)组成的骨架组合物。由于LIB中石墨阳极的电势远远超出电解质的热力学稳定性窗口,可逆锂化/脱锂化学依赖于对界面的保护。目前普遍认为LIBs中的SEI主要来自碳酸盐溶剂和盐阴离子的还原分解,Li+的溶剂化鞘结构已被确定为SEI化学中的关键因素。第一个循环中,当带负电的阳极将溶剂化的Li+吸引到其表面时,溶剂化鞘中的溶剂分子最初经历还原分解,从而成为新生SEI的前体。
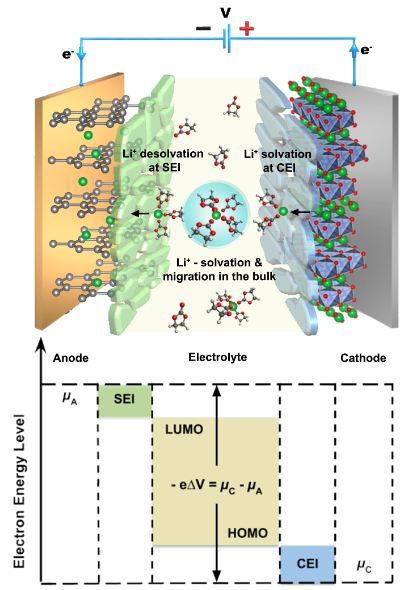
图 1. 电解质原理展示
碳酸亚乙酯(EC)在强溶剂化Li+和在石墨阳极上形成保护性界面的能力使其几乎成为所有LIB中不可或缺的电解质组分。然而,电解质中EC的普遍存在也会导致LIB的低温性能不佳和充电速率缓慢。使用用无环碳酸酯作为主要溶剂的无环电解质逐渐取代EC。与完全覆盖阳极的SEI不同,阴极表面上的沉积物,主要是无机氟化物和氧化物,通常被发现是分散的和不连续的,这也说明CEI化学更加复杂,不仅涉及电解质,还涉及阴极本身的分解和相变,从而导致了定义界面应该开始和结束的位置的问题。因此,电解质和界面是复杂的,在设计新的电解质系统时,Li+(或Na+等)的溶剂化结构至关重要。
电池化学设计电解质和界面
目前电池化学反应要么在极端电位下运行,具有剧烈的形态和体积变化,要么涉及极强的反应性表面,要么依赖难以移动的工作离子,电解质和相关界面的设计必须解决不同的挑战。
锂金属(Li0)阳极面临着更严峻的挑战,由于其能量密度,锂金属阳极被重新视为最终的阳极材料。识别具有有效SEI化学的电解质已成为一个投入巨大的研究方向,目的是Li0沉积可以在高库仑效率(CE%)下均匀地进行。特别是要避开分形状的长宽比晶体(图2),这可能会穿透电池并产生内部短路,或者在根部附近容易切断,形成高度危险的死Li0。相对锂电,参与反应的多个电子将有利于提高比容量使得与多价阳离子相对应的金属作为阳极材料具有更多的可能,但多价阳离子对环境施加的库仑力非常强导致多价盐在电解质中的溶解度有限,或溶剂分子与多价离子的结合非常强它们被静电分解。因此此类电池种电解质设计一般是:(i)形成弱配位电解质,以使阳离子较少溶剂化,并且可以更容易地克服去溶剂化能垒,(ii)使用各种氢化物和有机金属格氏试剂的抗还原电解质,从而不形成SEI,或(iii)超浓缩电解质,其中联网的阴离子簇可以帮助释放阳离子以进行移动。
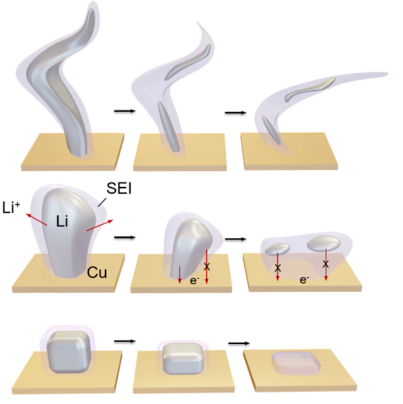
图 2. Li0阳极的挑战
在阴极方面,一直集中在寻找极高的能量密度或独立于钴或镍的材料上,但这两种元素要么在地壳中极为罕见,要么高地缘政治风险。目前已经探索了相对更成熟的材料,即设计为具有更高的HOMO,它们的氧化分解仍然可以主导CEI化学,并对本体电解质和阴极本身形成更好的保护,如插层化合物的改进版本,其晶格的结构修改允许它们在更高的电势下容纳更多的Li+,晶格中的氧可以被用于增加容量。
利用转化反应化学的更成熟材料被视为长期目标,包括金属氟化物、硫化物等。与具有最小结构变化的插层型电极不同,这些电极材料在放电期间经历了完全重组,从而实现了显著更高的容量,但以可逆性为代价,因为几乎不可能完全恢复原始电极结构(图3)。因此,需要相应的电解质和界面来抵抗金属氟化物或硫化物产生的纳米金属颗粒的强烈催化活性,抑制可溶性多硫化物在电池中的穿梭,并保持对氧还原反应性过氧化物或超氧化物中间体的惰性。
图 3. 新兴的转化反应电池化学
新概念电解质和界面
在设计和合成新的电解质组分(溶剂、盐和添加剂)方面,正在做出大量努力。这些可以归纳为几种通用方法:
超浓缩
传统上,电解质被限制在大约1 M的盐浓度,以最大化离子传输。在研究人员意识到,超高的盐浓度可以带来一系列好处(不可燃性、高压防腐、高阳离子转移及新的界面化学)抵消粘度增加导致的离子传输损失。超浓缩概念适用于水性、非水性甚至混合电解质系统。一种特殊的修改是所谓的局部高浓度电解质中引入非配位共溶剂(通常是多氟化醚)以进一步破坏母体电解质的液体结构,从而使总盐浓度接近1.0 M,但局部阳离子仍呈现类似于超浓缩状态的溶剂化结构。
单一化
由于在电极上原位形成的界面在化学和形态上都是高度不均匀的,因此确定哪种化学物质是确保电池可逆性的唯一最有效成分是关键。SEI和CEI中都存在各种有机或无机氟化物,但在氟化物含量和界面性能之间无法建立简单的线性关系。氟是最耐氧化和还原的元素,是设计用于支持电池化学腐蚀的界面的理想成分。界面中的氟化物分布以及与其他物种的相互作用比单独的氟化物含量更为关键。目前为止,关于精确调整这些氟化物物种纳米形态的知识仍然缺乏。根据低温电子显微镜下的观察和分析,Li2O最近被确定为Li0上的替代界面成分,但没有任何可检测的氟化物。因此,尝试了单一化学成分的更纯的界面来观察。
固化
固体电解质(SE)提供不可燃性、零泄漏和对Li0枝晶生长的机械阻力,提供了在宽工作温度范围内实现Li0阳极的更令人信服的可行性。聚合物离子导体由于其灵活性和可加工性而备受关注,但寡醚链的节段运动和离子传输之间的耦合构成了在环境温度下实现足够的离子传导率的不可逾越的障碍。为了将离子传输与聚合物节段弛豫分离,需要取得根本性突破。无机固体材料中,硫化物已成为最高的竞争者,在室温下具有高离子电导率和高顺应性以加工成超薄致密层,但其适度的电化学稳定性需要额外的界面保护,以防止多种阴极和阳极化学物质的极端电势。阴极材料上各种类型的可扩展、低成本、均匀的涂层策略仍在探索中,涂层不仅在化学和电化学上保护界面不被分解,而且作为机械缓冲层稳定固体-固体界面。
SE的最大挑战仍然来自固体-固体界面,因为SE不能流动或渗透到电极的孔隙结构中。克服物理接触问题的常见方法是添加受控量的液体电解质以填充空隙和间隙。这使得系统不那么坚固,并导致混合电解质或半SE。相反,固体-固体接触挑战也可以转化为实现Li或Si阳极的三维(3D)结构的优势,因为界面反应只能发生在这些接触点,而大体积膨胀和收缩可以通过适当的3D设计和动态压力控制来适应(图4)。SE的单离子传导特性消除了浓度极化,并允许调节导致不均匀反应和最终容量衰减的局部效应。
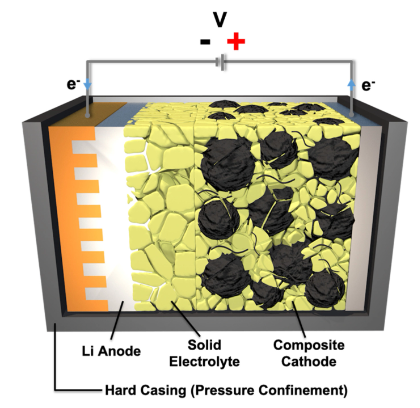
图 4. 固体电解质界面
液化
除了液体和固体之外,还创造了一个新的前沿领域,即准气体被用作电解质溶剂。这些努力使得在较低的温度下操作成为可能。相对极性的气态氢氟碳分子如氟甲烷可在中等压力下液化,该压力在室温下溶解盐以形成液化气体电解质。这些电解质是无毒的,并且具有相对强的共价键,允许宽的电化学窗口。由于其小分子尺寸和弱分子间吸引力,这些溶剂显示出异常低的粘度,这使得能够获得比典型电解质溶剂更高的优异的溶剂介电流动性因子。其他类型的共溶剂也可用于拓宽操作温度范围,特别是在盐沉淀和离子传输关闭发生的上限。这些非常规电解质虽然仅限于有限的应用,因为它们需要密封的不锈钢外壳,但仍有很大的发展潜力。
纳米限制
根据溶剂分子和溶剂化数,大多数离子溶剂化鞘的尺寸从1埃到近1纳米不等。那么溶剂化离子在这些亚纳米结构中的行为如何?当将常规LIB电解质注入平均直径约为40 nm的陶瓷-聚合物复合主体的纳米孔中时,Li0阳极的界面行为和形态发生了显著不同。当醚基电解质冻结到由金属-有机框架结构形成的0.29 nm亚纳米通道中时,电化学稳定性窗口显著扩大。最后,当相同的聚合物嵌入直径小至40nm的陶瓷基质的通道中时,沿着陶瓷-聚合物界面发生了非常快的离子传输,远高于相应的本体聚合物电解质。所有这些现象都有一个共同的因素:在纳米结构环境中,溶剂化的离子很可能与宿主材料的表面相互作用(图5),在此过程中,离子发生了部分或甚至完全脱溶剂化,产生尚未完全理解的化学状态的电解质。
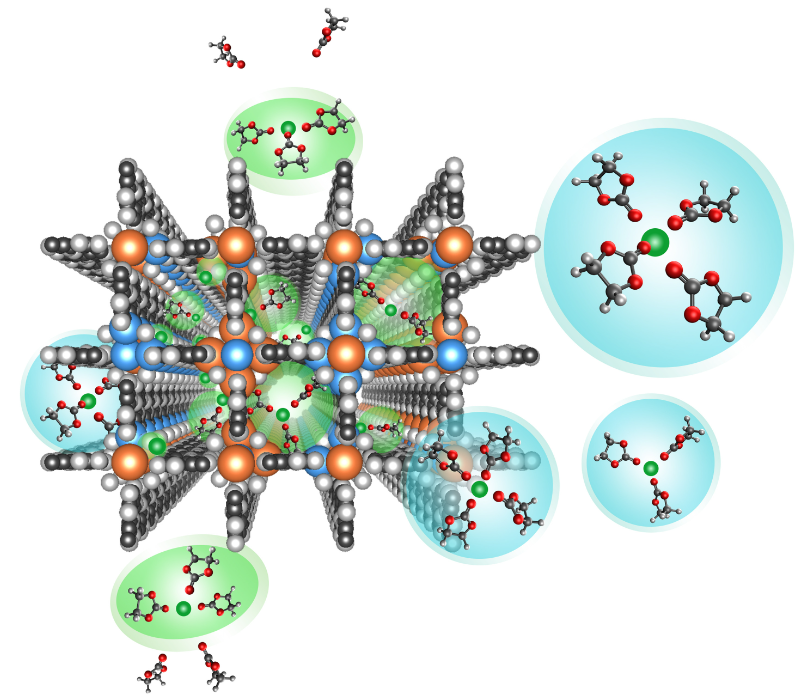
图 5. 纳米约束中的溶解
展望:充满忧虑的美好未来
电池的故障通常不是由单个故障部件引起的,而是由不同部件之间的相互作用引起的。其中电解质通常是衰减部件,许多基本问题仍然没有得到解答,如:(i)离子如何确切地穿过由本质绝缘材料组成的界面?(ii)如何精确测量界面内的电子和离子电导率?(iii)哪些部件在相间有效且功能正常,哪些部件不必要且冗余?
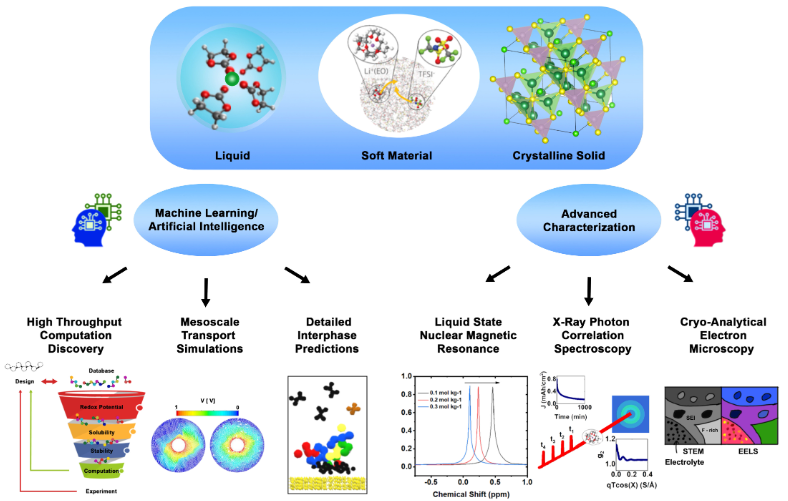
图 6. 以分子分辨率观察电解质动力学
结语:加强文献中电池性能数据的再现性和可比性,强烈鼓励研究人员进行严格的实践和标准化方案。这些是电池、化学和材料研究界都应该严格遵守的不可或缺的准则。
参考文献:
Y. Shirley Meng et al. Designing better electrolytes. Science. (2022), 378.
DOI:10.1126/science.abq3750
https://www.science.org/doi/10.1126/science.abq3750











