
脂肪的位置、功能、分子特征和可干预性各不相同。内脏脂肪(即储存在腹腔中的脂肪)由于其代谢特性以及难以获取和操作的事实而特别耐干预;它也比积聚在其他区域(如皮肤下面)的脂肪更有害。内脏脂肪的积累会增加各种合并症的风险,如2型糖尿病、心血管疾病、脂肪肝疾病和慢性炎症。然而,尽管存在这些相关风险,但尚未开发出针对内脏脂肪的特异性治疗方法。
脂肪细胞浸泡在由胶原蛋白和糖胺聚糖组成的细胞外基质中,后者是体内带负电荷最多的生物大分子之一。因此,这种带负电的基质可能会提供一种吸引和运输带正电分子的方法。阳离子纳米材料是携带多个正电荷的纳米级络合物。在治疗炎症性疾病时,它们已被广泛测试为带负电荷病原体的核苷酸载体或清除剂。因此,考虑到带负电荷的细胞外基质,阳离子纳米材料可能会在脂肪组织内堆积。这种富集可以用来应对针对体内特定脂肪库的挑战。
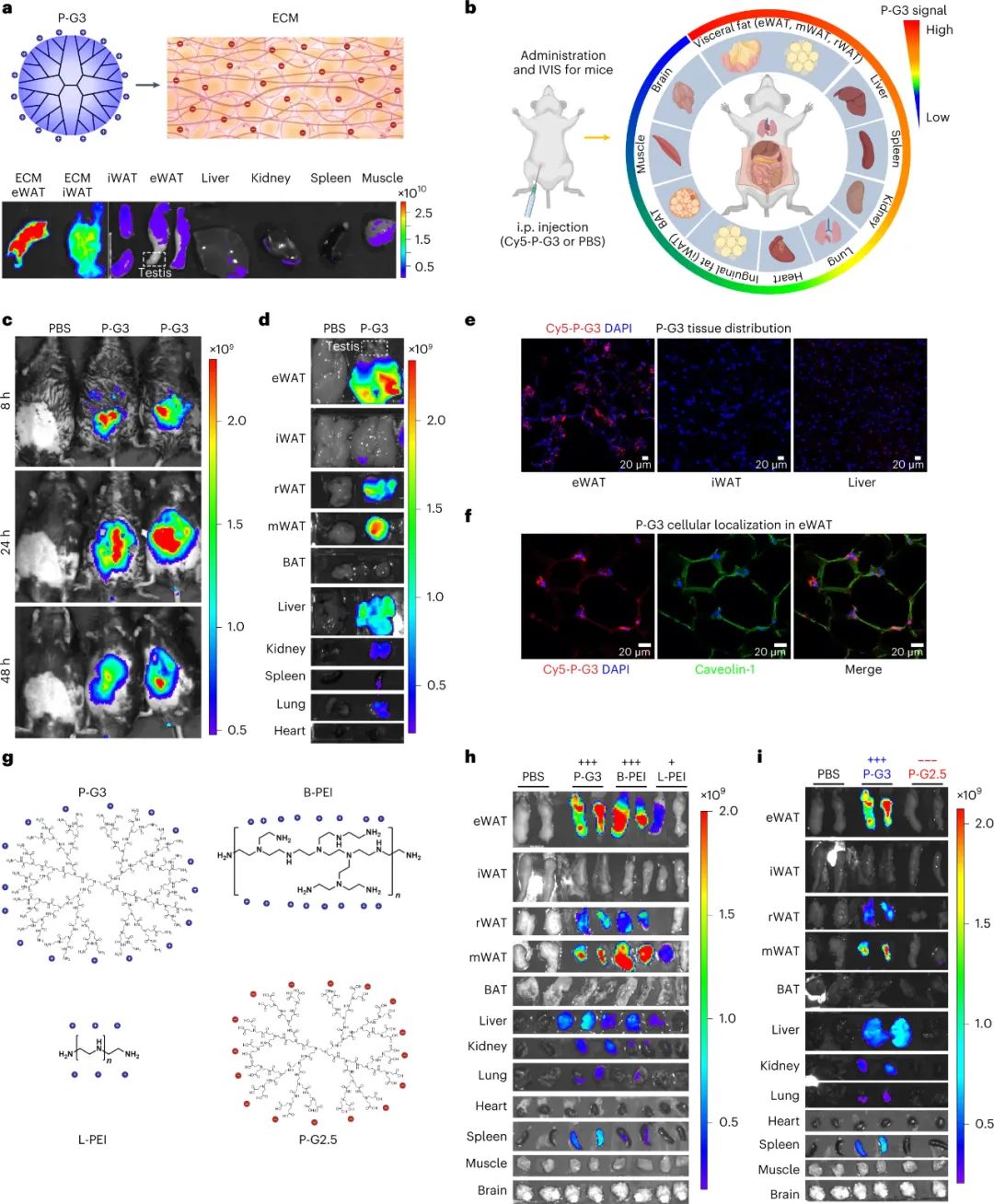
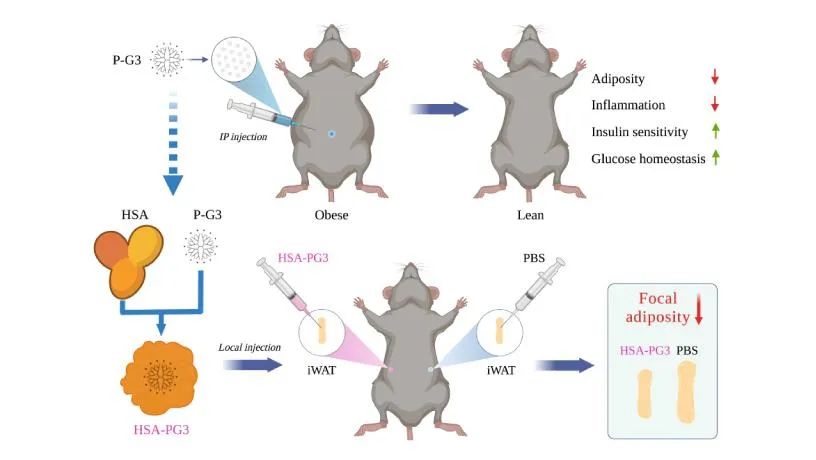
为了研究这种可能性,哥伦比亚大学强力和梁锦荣(Kam W. Leong)院士等人将一种第3代聚酰胺胺(PAMAM)(P-G3)树枝状聚合物注射到肥胖小鼠的腹部,这是一种表面带有32个正电荷的聚阳离子,并发现P-G3优先靶向内脏脂肪,而不是身体其他区域的脂肪库,从而改善代谢健康,如更好的葡萄糖代谢、更高的能量消耗和改善的肝功能。
图|使用阳离子纳米材料收缩内脏脂肪
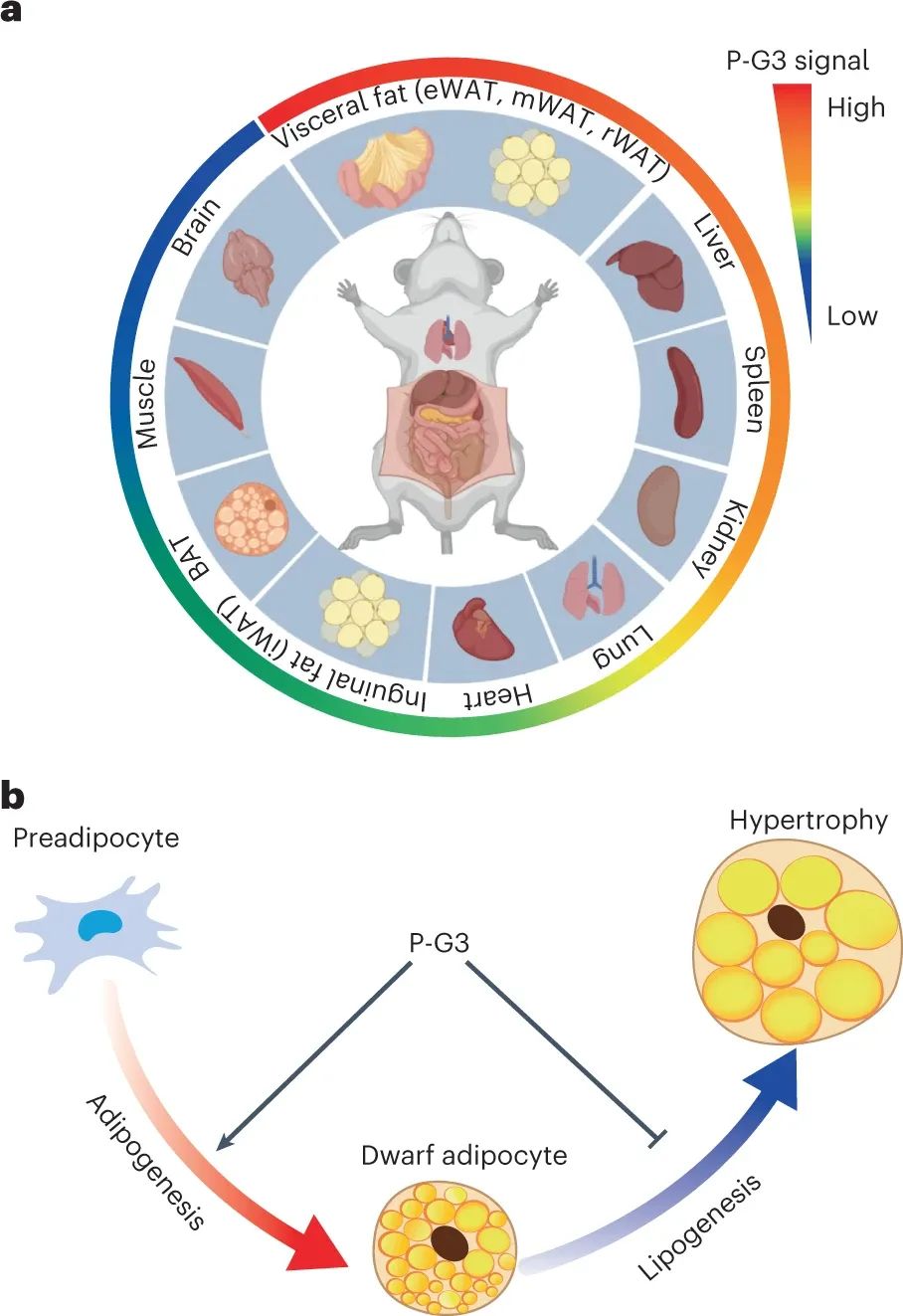
内脏脂肪的意外减少与脂肪细胞储存脂质的能力下降有关,同时维持脂肪细胞的发育和特性,导致dwarf脂肪细胞的产生。这些dwarf脂肪细胞是理想的,因为它们的功能与正常脂肪细胞相似,但体积较小,并且抵抗代谢不健康的肥大脂肪细胞的生长。P-G3的功能很可能是通过干扰营养感应途径来关闭脂质合成和储存程序。因此,正电荷不仅是靶向内脏脂肪的关键,而且赋予了一种有趣的减脂机制。
图|P-G3选择性地分布于内脏脂肪
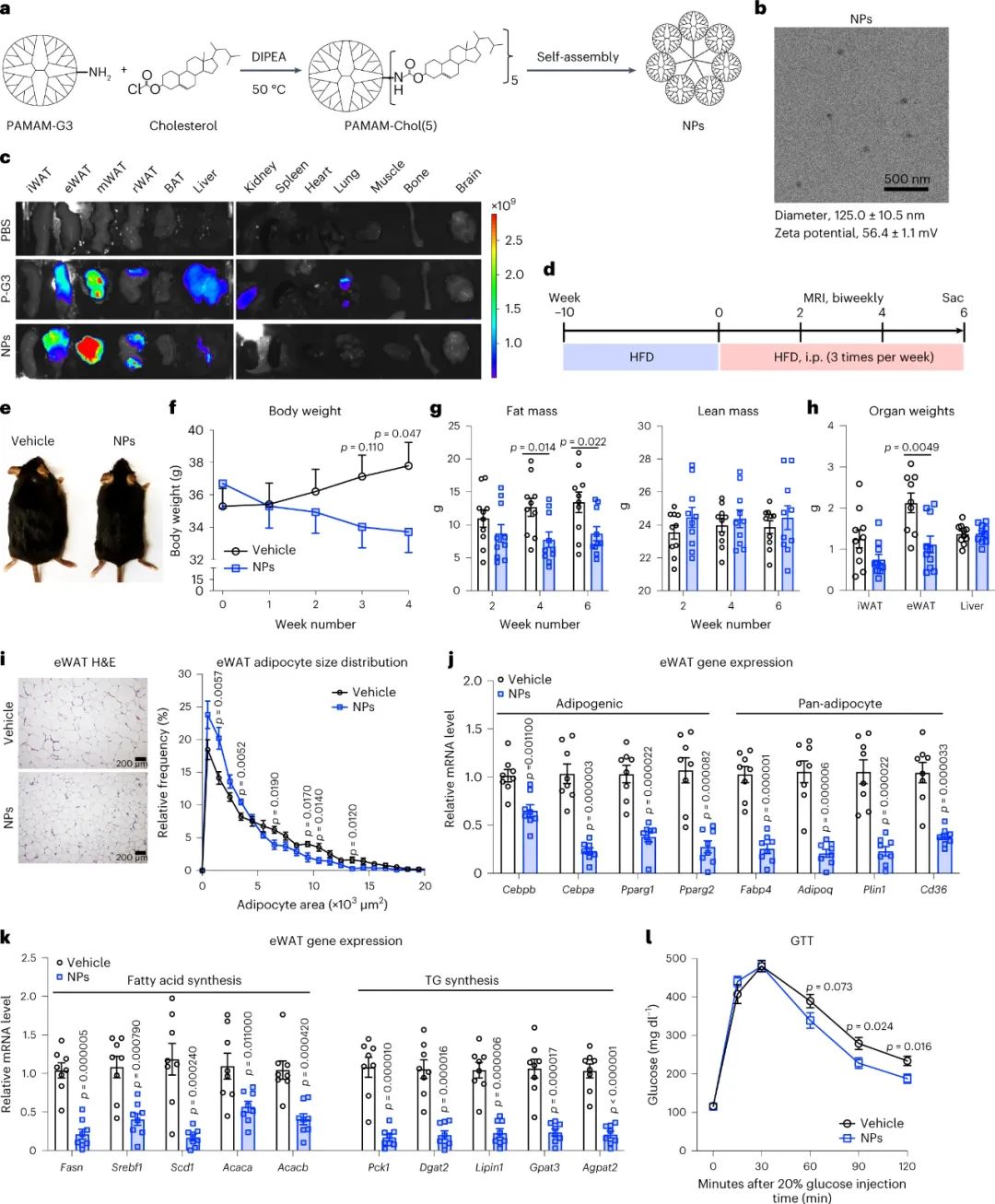
此外,P-G3在非脂肪组织上靶向脂肪的能力可以通过添加胆固醇尾部形成亲脂性纳米颗粒来进一步提高。
正电荷是靶向脂肪的关键这一发现将为阳离子化肥胖治疗开辟一条道路,可以安全有效地控制特定的脂肪库。用P-G3靶向特定的脂肪库需要期望的区域直接暴露于P-G3,例如通过腹部注射内脏脂肪。这一特性可用于局部注射治疗皮下脂肪。鉴于阳离子纳米材料的载体容量,它们可以将小化合物、核苷酸和蛋白质形式的治疗剂输送到给定的脂肪库。因此,通过将阳离子纳米材料的效果与增加的局部药物浓度相结合,可以增加脂肪减少。在制定肥胖干预策略时,安全性是首要考虑因素,阳离子局部给药可避免非脂肪组织中脱靶产生的不良作用。
图|设计P-G3以改善内脏脂肪分布并治疗肥胖症
正电荷越强,纳米颗粒将越优先靶向脂肪;然而,更强的正电荷也增加了纳米颗粒的毒性。应根据电荷密度仔细评估最佳疗效与毒性比的窗口;该比率可能根据特定脂肪贮存库的位置而变化。本研究通过腹部注射P-G3靶向内脏脂肪;然而,需要侵入性更小且更方便的递送途径,例如口服递送。此外,我们还不知道P-G3诱导的脂肪减少会持续多久。因此,仍然需要继续优化针对内脏脂肪的阳离子纳米材料。
此外,近日该研究团队还有一篇发表在Biomaterials上的相关的研究,主要是利用P-G3腹膜内递送P-G3减轻了DIO小鼠的慢性炎症,减轻了其体重,从而改善了代谢功能。

参考文献:
Wan, Q., Huang, B., Li, T. et al. Selective targeting of visceral adiposity by polycation nanomedicine. Nat. Nanotechnol. (2022).
https://doi.org/10.1038/s41565-022-01249-3












