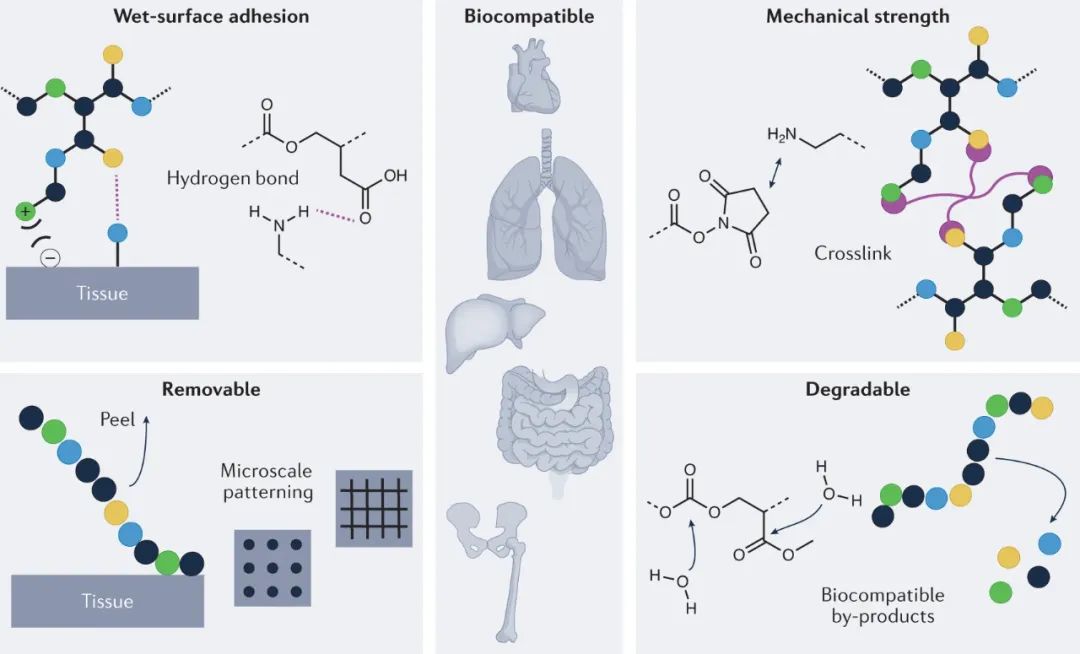
压敏粘合剂是常见的家用物品,广泛应用于日常维修、办公用品和局部伤口护理。通过材料和聚合物科学的创新,压敏粘合剂将从当前的商品发展到新的特殊材料,从而产生新的临床用途和改善的患者护理。近日,美国波士顿大学Mark W. Grinstaff等人在Nature Reviews Materials上评述了用于内伤口闭合的新型压敏粘合剂。压敏粘合剂普遍粘附于各种表面,无论是纸张、玻璃、木材、金属还是皮肤。这些密封和粘合材料广泛应用于消费品、建筑和汽车行业,全球市场规模达70亿美元,预计到2026年将超过100亿美元。在医学领域,尽管创可贴等局部敷料和绷带在商业上取得了成功,但目前的压敏粘合剂并未在体内使用。现有的内部粘合剂仅限于Progel、BioGlue、Tisseel和Adherus等密封剂,这些密封剂通过密封组织表面(如肺或硬脑膜)之间的间隙,仅满足特定手术场景中的少数需求。在临床上,内部粘附的应用多种多样且不断变化——包括伤口闭合、药物输送、组织增强、细胞嵌入组织支架和可穿戴设备——压敏粘合剂具有很高的实用性,它能够将相似或不同的表面连接在一起。如今,将科学上的根本性突破转化为临床用压敏粘合剂的机遇令人振奋。具体而言,聚合物合成和组成的进步,加上对聚合物如何粘附到不同表面结构的理解的提高,将有助于开发设计用于内部临床应用的新型压敏粘合剂。成功取决于临床医生对这些新材料的最终用途及其对患者护理的影响的跨学科整合。重要的是,任何新的内部压敏粘合剂配方都必须满足五个关键设计要求:生物相容性、降解性、湿表面附着力、机械强度和可移除性。这些材料的目标是提供适用于各种生物医学应用的功能性、无毒性和微创性粘合剂。这些材料要么在体内安全降解,要么长期保持患者良好的耐受性。压敏粘合剂被要求满足一系列严格的生物相容性和安全性要求,因为它们是为直接接触活生物体而设计的特殊材料。在产品生命周期内,粘合剂必须表现出最小的过敏可能性,引发适当的宿主反应,并且没有系统毒性。聚合物合成经常使用有毒的金属催化剂和引发剂。对于医疗应用,这些成分必须从最终产品中纯化出来,或者更好的是,聚合物的新合成路线(例如,使用有机催化剂的路线)可以完全避免它们的使用。压敏粘合剂配方通常包含增塑剂、增粘剂和其他小分子添加剂,以优化材料性能,这些添加剂可能会渗入体液并导致意外的副作用。在配方过程中为提高粘合剂的强度、粘性或抗剪切性而包含的任何添加剂也必须是生物相容的。事实上,由于目前使用的大多数添加剂都是50多年前首次开发出来的,当时人们往往忽视了对可持续性的考虑,因此需要研究更环保、更环保的替代品。与通常在涂抹几天内去除的局部粘合剂相比,内部粘合剂必须在更广泛的时间范围内发挥作用。降解的时间尺度(从几天到几周)对应于施用部位的自然愈合过程。体内压敏粘合剂的潜在长期生命周期需要生物相容性降解产品。例如,切除手术后用于将肺组织固定在一起的压敏粘合剂可能会在体内持续数周,以允许下层组织自然愈合。肺组织愈合后,压敏粘合剂分解成良性降解产物。这些副产物被肝脏或肾脏进一步代谢,或从体内排出。相比之下,持久性更长的粘合剂,例如用于固定可穿戴设备的粘合剂,必须在所需的使用寿命周期内保持其粘性和结构完整性,约为数月至数年。与当前的商品材料不同,内部生物医学压敏粘合剂需要与潮湿的、不均匀的组织表面结合。压敏粘合剂和典型基材之间的结合由分子间相互作用(如范德华力和氢键)驱动。组织是一种低表面能材料,包裹有干扰这些分子间相互作用的液体、盐和或糖基化蛋白,对封闭和压敏粘合构成重大挑战。聚合物可以通过亲水官能团、更高的表面积结构和更大的分子量进行工程设计,以创造性地最大化体内的这些界面相互作用。在自然界中,壁虎、贻贝和青蛙具有超强的湿粘附力。这些生物为聚合物粘合剂的分子组成提供了灵感,例如通过使用3,4-二羟基-L-苯丙氨酸(DOPA),其与湿表面氢键和交联。此外,这些生物证明了高表面积地形的实用性,例如凹凸或波纹状的构造。通过这种纳米或微图案化增加粘合剂和基材之间的表面积,增强了驱动粘附和结合的分子间相互作用的大小。无论是通过器官组织的膨胀和收缩,还是通过流体在体内的动态流动,医用压敏粘合剂在其使用期间必须承受一定范围的机械应力。聚合物内部的吸引力,如氢键和范德华力,提高了耐久性,抵抗外力破坏。增加聚合物分子量通过增加链缠结的数量来提高内聚力,从而增加这些分子间相互作用的大小。通过氢键和共价键方法使聚合物交联也能提高材料的内聚力,从而提高材料的剪切强度。然而,聚合物的设计必须在内聚力和材料流动性之间保持平衡,以确保增加的材料强度不会破坏粘性和剥离强度的关键性能。内部使用的生物医学粘合剂必须允许移除和重新定位,理想情况下使用最小的力,以使对下方组织的损伤不会扩散。可移除的压敏粘合剂确实存在于家庭用品中,如Avery标签,也存在于外部医疗应用中,如创可贴和Nexcare绷带。这些医用敷料的可移除性是不完善的,因为它们经常遭受内聚破坏,在移除时在患者身上留下不期望的粘合膜,或者从皮肤上提起是痛苦的。一般而言,剥离强度在0.4和2 N·cm-1之间的180°压敏胶表现出优异的皮肤可去除性,而剥离强度大于14 N·cm-1的压敏胶被认为是永久性的。这些值也为内部粘合剂提供了初始框架。聚合物化学家和材料科学家面临的挑战是开发与组织牢固结合的压敏粘合剂,同时允许按需移除材料,以在手术环境中实现最佳定位。这将通过引入亲水部分的聚合物设计策略来实现,亲水部分与粘合剂和湿表面之间的氢键竞争。此外,较薄的粘合涂层和非连续图案化将降低移除所需的剥离力。闭合损伤部位以防止失血、漏气、体液在不同生物区室之间的转移和感染性污染是外科手术中最大限度降低患者发病率和死亡率的关键要求。压敏粘合剂以快速、定点、非创伤的方式恢复组织完整性并为组织重塑和愈合提供支架的能力,提供了显著改善外科伤口护理和创伤护理、危重护理和外科肿瘤患者护理的潜力。确定聚合物组成和粘合剂性能之间的结构-性能关系对研究界至关重要。有了这些信息,就有很大的机会来设计生物降解性、生物相容性和粘合强度优于现有选择的压敏粘合剂。令人兴奋的是,广泛解决所有伤口护理需求的压敏粘合剂将触手可及。Fitzgerald, D.M., Colson, Y.L. & Grinstaff, M.W. Advancing pressure-sensitive adhesives for internal wound closure. Nat Rev Mater (2022).https://doi.org/10.1038/s41578-022-00516-y