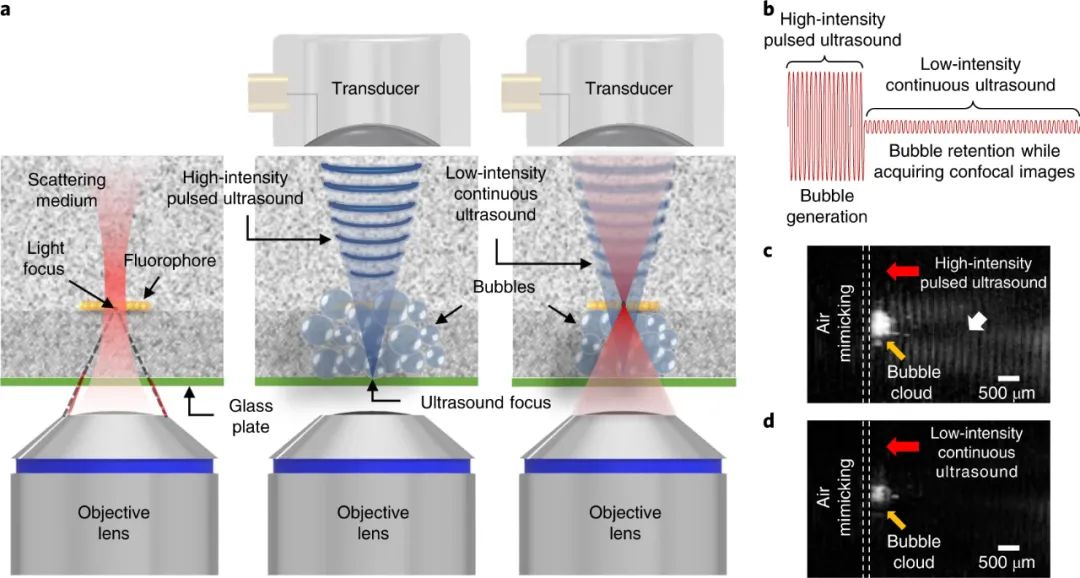
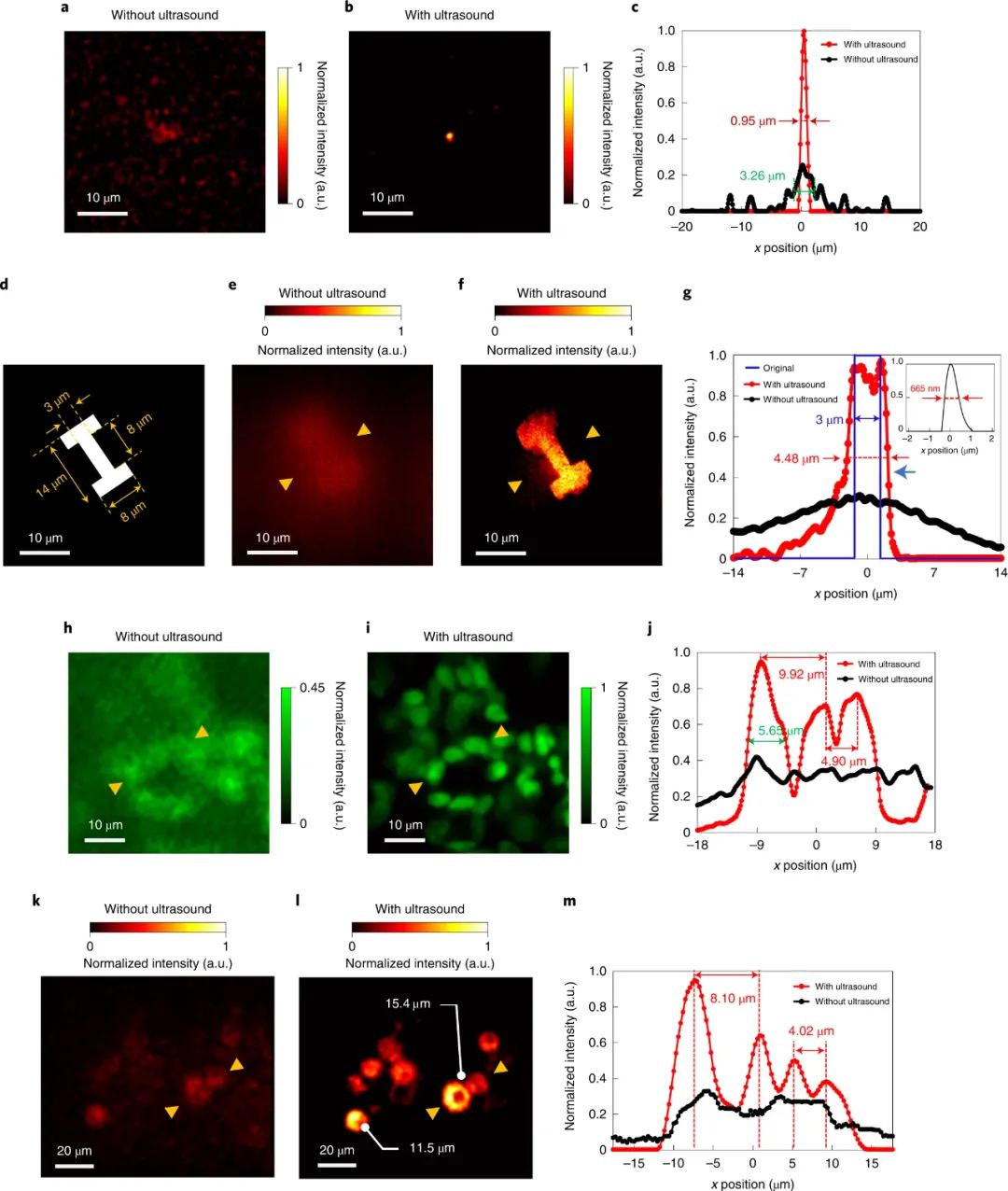
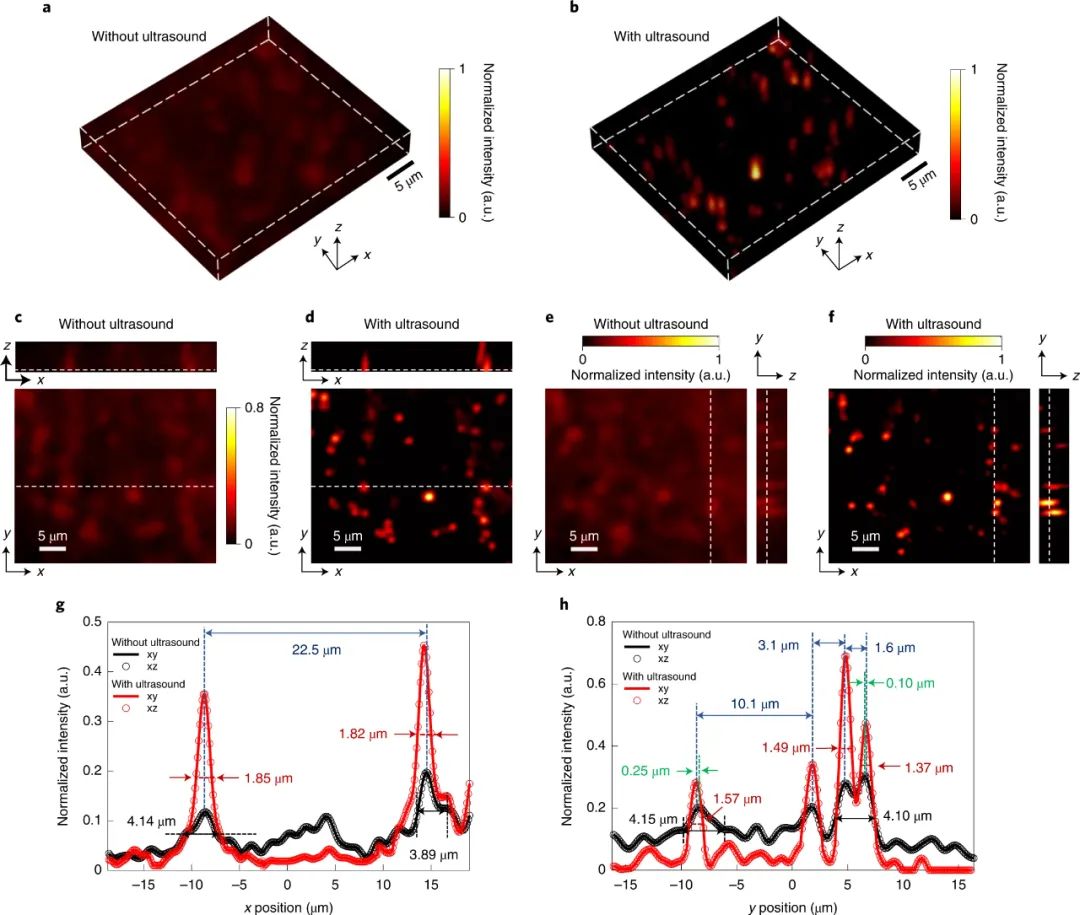
显微镜通过提供亚细胞水平的生物组织的精细图像,彻底改变了我们对生物学的理解。然而,大多数组织表现出的强烈光学散射限制了可以实现高空间分辨率的穿透深度。近日,韩国大邱庆北科学技术院Jin Ho Chang、Jae Youn Hwang等人描述了一种新的方法,即使用超声诱导的气泡云暂时“清除”组织中的散射,从而增加了获得高分辨率显微镜图像的深度。成果发表在Nature Photonics上。使用可见光对组织成像时,会受到组织微观成分(细胞膜、胶原纤维等)与周围介质之间折射率不匹配引起的显著散射的阻碍。通常,光在散射事件之间的平均自由程约为几十微米。这将显微镜和其他依靠最小散射弹道光子的技术在大多数组织中的成像深度限制为小于0.5 mm。困难不在于光不能穿透超过这个深度(在近红外波长下,光可以传播到厘米级的深度),而在于它由于散射而失去方向性并变得漫射。这使得将会聚光线聚集在一起形成高空间分辨率所需的紧密聚焦变得困难。为解决这一问题,已经进行了几次尝试。其中包括在组织散射较低的较长波长下转向多光子成像,但硬件实现可能很昂贵。波前成形方法依赖于调整输入光场的相位和或幅度,以校正散射并在组织深处形成紧密聚焦。然而,这些技术需要一个外部光束整形设备,也需要某种形式的内部引导星。光学仪器的复杂性以及动态活体组织中实时校正的系统延迟带来了进一步的挑战。化学“组织清理”剂可以降低组织中的折射率不均匀性,从而最小化散射。然而,它们需要耗时的准备,会不可逆地改变组织组成,并且与体内使用不相容。该课题组的研究尝试通过光学清除组织而非化学方法来减少散射。相反,他们使用超声波。众所周知,施加超声场允许空化气泡在样品内集结。作者使用这一非常相同的原理,在组织表面下方诱导非散射气泡云。其效果是在组织中临时创建一个透明窗口,通过该窗口可以最小化光散射,并可以在更大的深度处聚焦。这一概念被称为超声诱导光学透明显微镜(US-OCM),它建立在作者早期的工作基础上,通过超声产生低密度气泡云来减少组织散射的影响。这种方法改变了瑞利散射和米氏散射之间的平衡,有利于后者,从而使更多的入射光变为正向。尽管准直光束的穿透可以通过低密度气泡云增加,但显著的光散射仍然阻碍了激光束的紧密聚焦。在目前的工作中,气泡云以类似的方式被超声诱导,但具有高得多的气泡密度。气泡更紧密的填充特性现在大大减少了散射,从而能够在深度处形成相对不失真的光学焦点。下图说明了基本的物理原理。压电环形换能器发射的弱聚焦3 MHz超声场被传递到组织样本的一侧。另一侧由激光扫描共焦显微镜发出的聚焦激光束照射。当存在超声场时,会聚的入射激光束可以以最小的失真传播通过气泡云,以在下面的组织上形成衍射受限的焦点。通过在样本上扫描焦点,然后形成图像。结果显示了在319 μm深度处有和没有超声场时获得的小鼠脑组织样本图像的改善。当超声场存在并且组织被超声“清除”时,获得了更高分辨率的图像。根据对系统点扩散函数的实验测量,作者声称穿透深度增加了6倍,这一增强可能有益于一系列显微镜技术。1)首先,气泡产生的方法。通过在组织中超声诱导空化形成微观气泡的过程在治疗超声领域中是众所周知的。然而,US-OCM面临的挑战是防止气泡的生长和破裂损坏组织。在该研究中,用于形成气泡云的超声场的峰值负压与超声组织检查中使用的峰值负压相当,超声组织检查是一种通过超声诱导的空化作用机械破坏病变组织的治疗方法。那么在US-OCM中如何避免类似的不可逆组织损伤呢?作者声称通过使用两步声化序列来解决这一问题。在第一步中,输送几十微秒的相对高振幅的超声场以形成气泡云。随后是一个较低幅度的稳定场,将气泡保持125 ms,同时激光点在清除的区域上扫描以获取图像。通过对两步过程前后的组织样本进行成像,作者发现组织结构没有明显变化。相比之下,当仅在较长时间内输送初始高振幅场时,由于气泡云产生的机械破坏,组织结构发生了不可逆的改变。2)第二个值得注意的一点是存在位于与超声换能器相对的组织表面上的薄玻璃板。这充当反映入射超声场的超声镜,从而建立驻波。作者认为,这将超声场的高振幅部分以及气泡云限制在几百微米的深度,这与所使用的特定共聚焦显微镜系统的工作距离相当。在没有驻波的情况下,清除的深度可能会延伸到几毫米,但需要适当更长的工作距离光学器件。然而,对声反射器的要求确实施加了显著的限制。超声场和聚焦光束需要从样品的相对侧传送,这使得这种几何形状目前难以在体内使用。3)虽然研究人员将他们的研究局限于使用单一的超声波频率和光束分布导致固定的气泡云体积,但是气泡云的尺寸和位置以及因此清除的区域可以通过修改超声波场特征。这可以通过调整超声频率以改变穿透深度,或者通过使用传感器的电子可操纵相控阵来产生任意的光束分布和位置来实现。精确的深度控制将通过超声清除连续更深的组织切片来实现深度3D成像,在这些组织切片内可以实施传统的高分辨率光学切片。气泡云的重新定位将能够扫描更大的视野。总之,本文描述了一种减少组织中光散射的方法,以可调节,快速,可逆的方式非侵入性地增加穿透深度,似乎不会改变组织解剖结构并且可以以适度的成本实现。不可避免地还存在一些挑战。尽管US-OCM似乎使组织完好无损,但研究的初步性质表明有必要对这方面进行进一步研究。这可能包括进行组织学研究以确定是否发生细微的微观结构变化,研究对代谢和生长等细胞功能的影响以及评估更广泛的组织。其他挑战包括找到从组织样品的同一侧递送超声场和显微镜束以允许体内成像的方法。使用新颖的声学传递机制和仔细设计超声场分布,或者如作者所建议的,使用脉冲激光束播种气泡云可以克服这个限制。如果可以克服这些挑战,该技术可以提供一条优雅的途径来增加成像的穿透深度。许多成像技术依赖于弹道光,因此本方法有望使用共焦和多光子显微镜以及其他方法(例如光学相干断层扫描)生成体积图像。Kim, H., Youn, S., Kim, J. et al. Deep laser microscopy using optical clearing by ultrasound-induced gas bubbles. Nat. Photon. 16, 762–768 (2022).https://doi.org/10.1038/s41566-022-01068-x