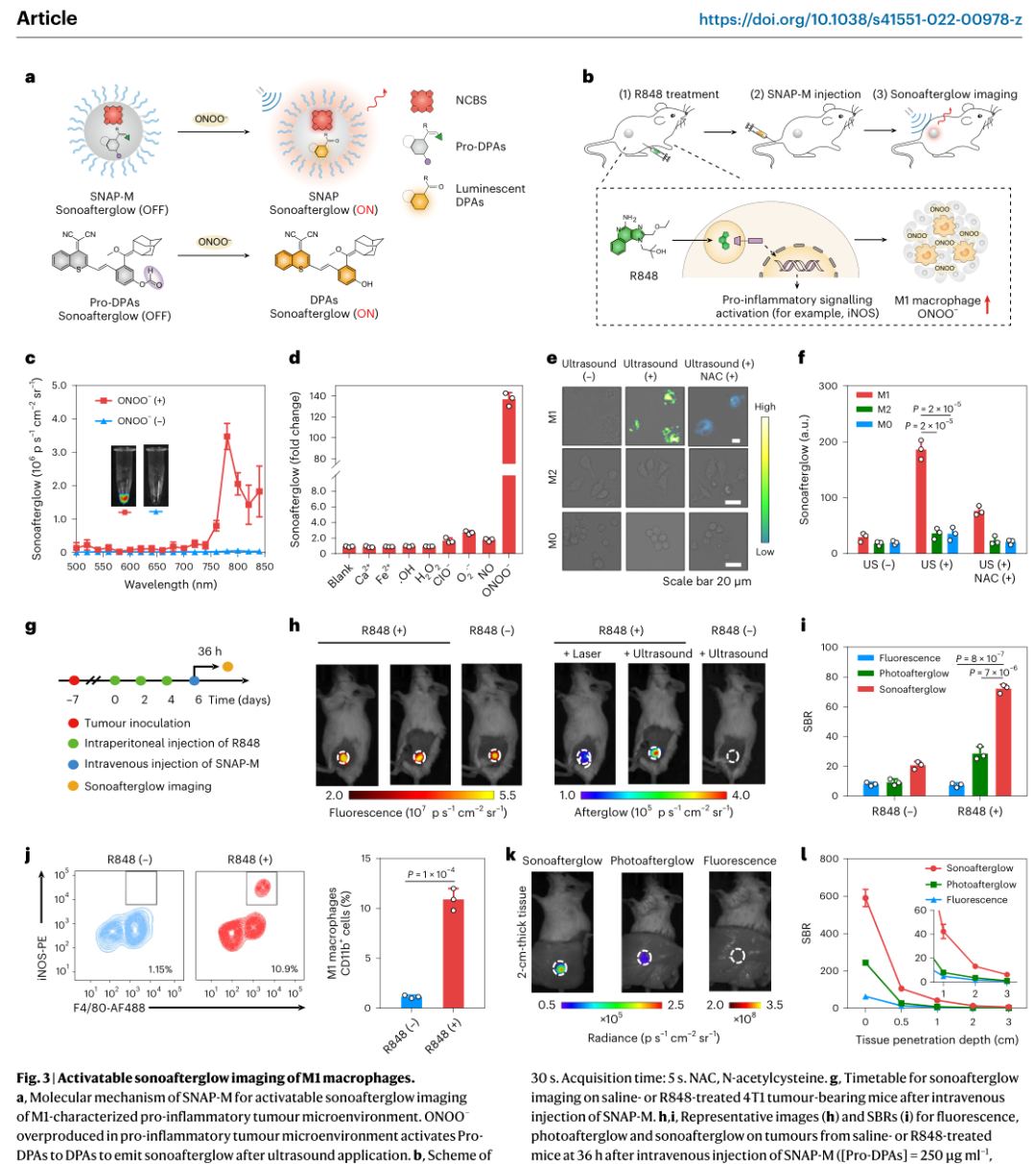
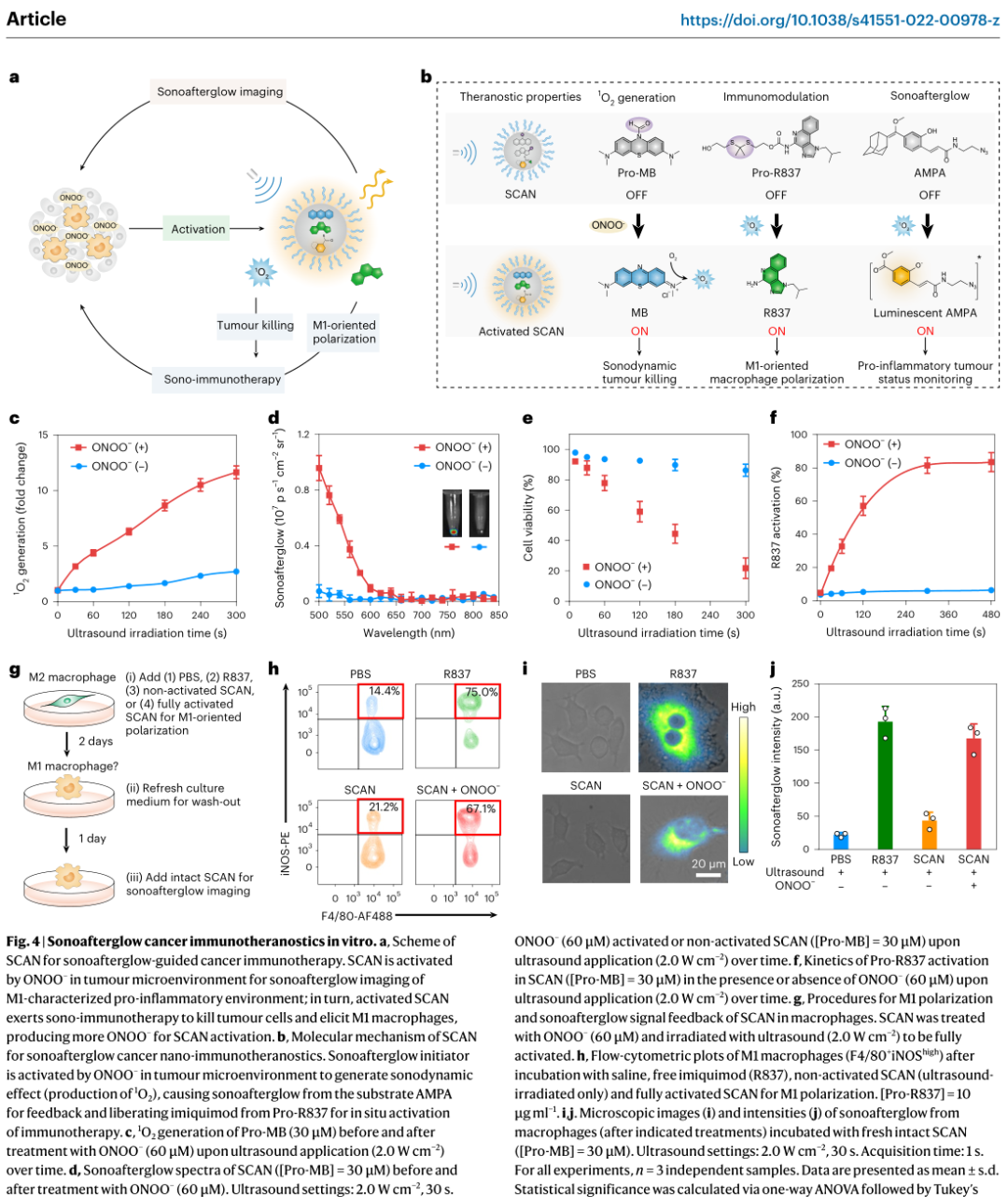
光学成像可以在分子水平上密切监测生理病理过程,因此被常规用于解读生物学和诊断疾病。为了最大限度地减少自发荧光并提高信号背景比(SBR),余辉成像使用材料(如半导体聚合物和稀土掺杂无机纳米材料)作为“光学电池”,将光能存储在缺陷中,然后在光照射停止后缓慢释放光子。相对于酶催化的生物发光和放射性同位素激活的Cerenkov成像,余辉成像具有可调谐的近红外(NIR)发射、可再生和可重复的发光以及长寿命的优点,这使得图像模式适用于各种体内成像应用,如转移性肿瘤的超灵敏检测、术中图像呈现引导手术、药物激活前的实时跟踪和器官损伤的早期诊断。在当前的余辉成像实现中,尽管在信号采集过程中消除了自身荧光,但信号诱导过程需要光照射。由于光在组织中的散射和重吸收,利用光诱导余辉(photoafterglow)在深层余辉剂中诱导信号是具有挑战性的。(换句话说,光对于组织的穿透力是有限的无法在后组织下诱导余辉效应。)这一问题可以通过开发可由深层组织穿透电磁辐射诱导的余辉剂来潜在地解决。然而,X射线诱导的余辉材料是极少的,并且在精确控制探针的结构和表面修饰方面的较为困难,故很难设计出仅在特定生物标记物存在的情况下激活其信号的探针。与X射线的使用相比,非辐射超声是一种更安全的深层组织穿透机械能,但尚未用于体内光学成像。传统意义上,声致发光是指气泡在超声照射下周期性膨胀和抽提后发生空化的自发发光过程。然而,这种声致发光具有较短的波长(蓝光),低亮度和极短的寿命(微秒)。不同的是,超声触发的发光是压电无机材料的能量释放过程,它将光能存储在晶格缺陷中,并在超声机械应力下辐射释放。然而,光充电是超声触发压电纳米颗粒发光的先决条件,这就排除了超声在深层组织中的应用可重复诱导余辉。鉴于此,浦侃裔教授设计出一种发出超声波诱导余辉的有机纳米颗粒,在生物标志物激活的癌症免疫治疗中的具有极好的响应性按需给药治疗。声余辉纳米颗粒(SNAPs)由声敏剂组成,作为引发剂,在超声下产生单线态氧(1O2),随后将声余辉衬底转化为活性二氧烷衬底,其发光持久且能够转移回声敏剂。超声启动机制确保了深层纳米颗粒的声余辉诱导。此外,每种组合物的分子工程允许开发“智能”声余辉纳米探针,仅在特定疾病生物标志物存在时才开启其声余辉信号。通过在纳米颗粒中加入巨噬细胞极化前药,我们合成了一种声波余辉癌症纳米免疫治疗探针(SCAN)。SCAN仅在超声应用下激活免疫治疗作用,发射声余辉信号,可以耦合回肿瘤免疫微环境的促炎水平(以M1巨噬细胞的存在为特征)。因此,SNAP可作为深层组织高对比度生物标志物成像和癌症治疗的模块化系统。
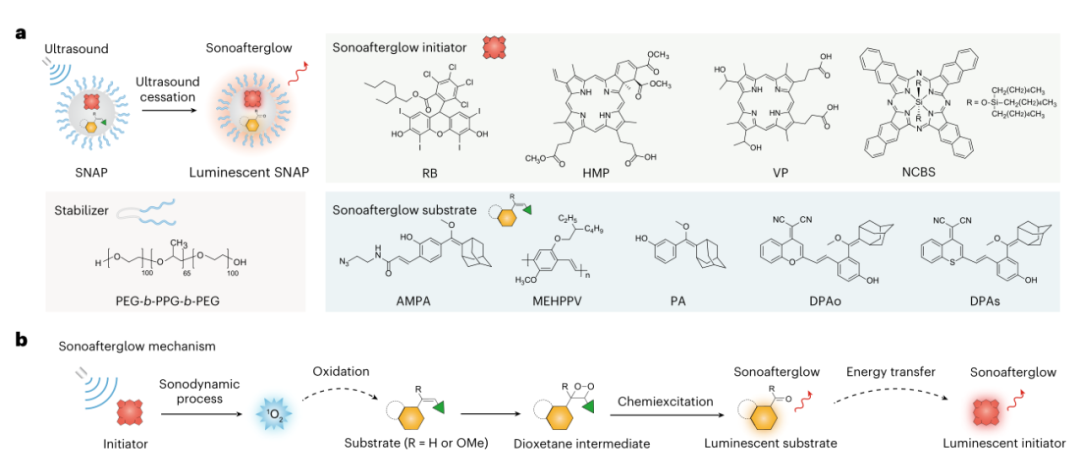
为了避免光诱导余辉所需要的信号诱导的组织深度有限,发明了超声诱导余辉纳米颗粒(SNAPs),从可见到近红外范围(780 nm)发射可调,半衰期长(高达180 s)。从力学上讲,声诱导余辉类似于光诱导余辉,两者都由1O2产生的敏化剂启动,以产生持久的发光中间体。然而,NCBS/DPAs SNAP的声余辉比其光余辉亮2.4倍,因为声动力工艺比光动力工艺具有更高的1O2生产效率。在超声作用下产生更多的1O2可能是由独特的声物理化学过程(即声发光、热解反应和声空化效应)引起的,这些过程促进了能量从敏化剂转移到周围的氧分子,这在光照射下是不存在的。更重要的是,超声能够诱导NCBS/DPAs SNAP深度位于4厘米厚度的组织中,其深度是其光余辉的两倍。由于高亮度和深层组织成像,皮下植入NCBS/DPAs SNAP的体内余辉信号比所有现有的有机光余辉纳米颗粒都要亮,比无机光余辉纳米颗粒至少高出190倍。因此,SNAP在组织深度和余辉成像亮度方面都创下了记录。促炎微环境状态在肿瘤的发生和发展中起着至关重要的作用,因此它可以作为癌症免疫治疗的预后标志。尽管分子成像在癌症诊断和治疗中的重要性,但现有的大多数显像剂都具有持续信号发送,并在被动积累时产生非特异性信号。SNAPs的模块化组成使它们能够开发成仅在癌症生物标志物存在时才开启声余辉的可激活探针。这对于无机纳米颗粒中X射线诱导的余辉可能不太可行。由于产生1O2的引发剂和声余辉衬底是声余辉发射的两个重要组成部分,因此可以对引发剂或衬底进行分子沉默,并设计为可被靶向生物标记物激活。为了检测过氧亚硝酸盐(ONOO −),一种主要由M1巨噬细胞产生的生物标志物,表征促炎肿瘤微环境,SNAP-M和SCAN分别被设计为具有沉默的声余辉底物(Pro- DPA)或启动器(Pro-MB),两者都在ONOO −存在时特异地开启其声余辉。这种生物标志物激活的声余辉在SNAPs中消除了被动累积探针的非特异性信号,允许声余辉与肿瘤内M1巨噬细胞水平直接相关,从而在癌症免疫治疗期间精确监测促炎肿瘤微环境。利用远程超声干预过程,我们进一步将SNAP作为一种癌症免疫治疗剂(SCAN),通过掺杂沉默的免疫前药(Pro-R837)。SCAN需要在促炎肿瘤微环境中同时使用超声和ONOO −来激活其免疫治疗功能。这种双锁设计与现有的纳米免疫治疗药物不同,现有的纳米免疫治疗药物具有“始终打开”信号和药物作用,这些信号和药物作用在正常组织中是非特异性释放的,因此可能导致副作用。除了在肿瘤中远程控制免疫治疗激活的优势外,SCAN发射ONOO −相关的声余辉来实时报告促炎肿瘤微环境中M1巨噬细胞的水平。在这种声余辉引导的免疫治疗方案下,SCAN在合适的剂量下精确地激发了有效的抗肿瘤免疫,从而实现了完全的肿瘤抑制和转移抑制。因此,SCAN可用于指导癌症免疫治疗和远程控制免疫治疗作用。总之,报道了一个用于活体动物深层组织诱导和无背景光学成像的超声诱导余辉纳米颗粒(SNAPs)库。借助模块化声余辉机制,SNAPs可以被开发成可激活的治疗纳米探针,用于准确检测病变微环境中的细微分子变化,并纵向监测治疗结果以指导干预。除了在体内药物筛选和精准医疗方面的潜力外,声余辉成像的组织深度可能为实时无创检测生理病理过程提供机会,其灵敏度和组织深度是其他光学模式无法达到的。Cheng Xu, Jingsheng Huang, Yuyan Jiang, Shasha He, Chi Zhang & Kanyi Pu ,Nanoparticles with ultrasound-induced afterglow luminescence for tumour-specific theranostics, Nature Biomedical Engineering 2022DOI:10.1038/s41551-022-00978-zhttps://www.nature.com/articles/s41551-022-00978-z