记录历史,可以让我们以史为鉴,借古论今。一开始人们利用结绳记事,再到后面的象形字,甲骨文,史书等等,正是由于这些历史记录不断进化,我们的璀璨的文明才得以传流至今。如今,科学家们还想要记录我们体内细胞的生命史,以帮助我们了解更丰富的生命活动。
近日,Nature Biotechnology杂志中的两项研究描述了在寻找追踪单细胞转录活性历史的技术方面的突破。

目前在高时空分辨率下探测细胞动力学的方法具有显著的局限性。由于显微镜的物理限制,使用荧光报告器对活细胞进行光学成像仅限于少量细胞。固定组织中的成像克服了这些空间限制,但不能提供细胞内活动随时间的连续记录。该两项研究的新方法结合了两种方法的优点。研究人员使用以蛋白质为基础的纤维,以稳定的速度生长,使用染料或荧光蛋白在单细胞中“写入”转录事件,然后对蛋白质纤维进行光学读取,以重建事件的历史。以这种方式跟踪细胞历史的能力将有助于研究正常或病理过程中涉及的关键事件的时间。
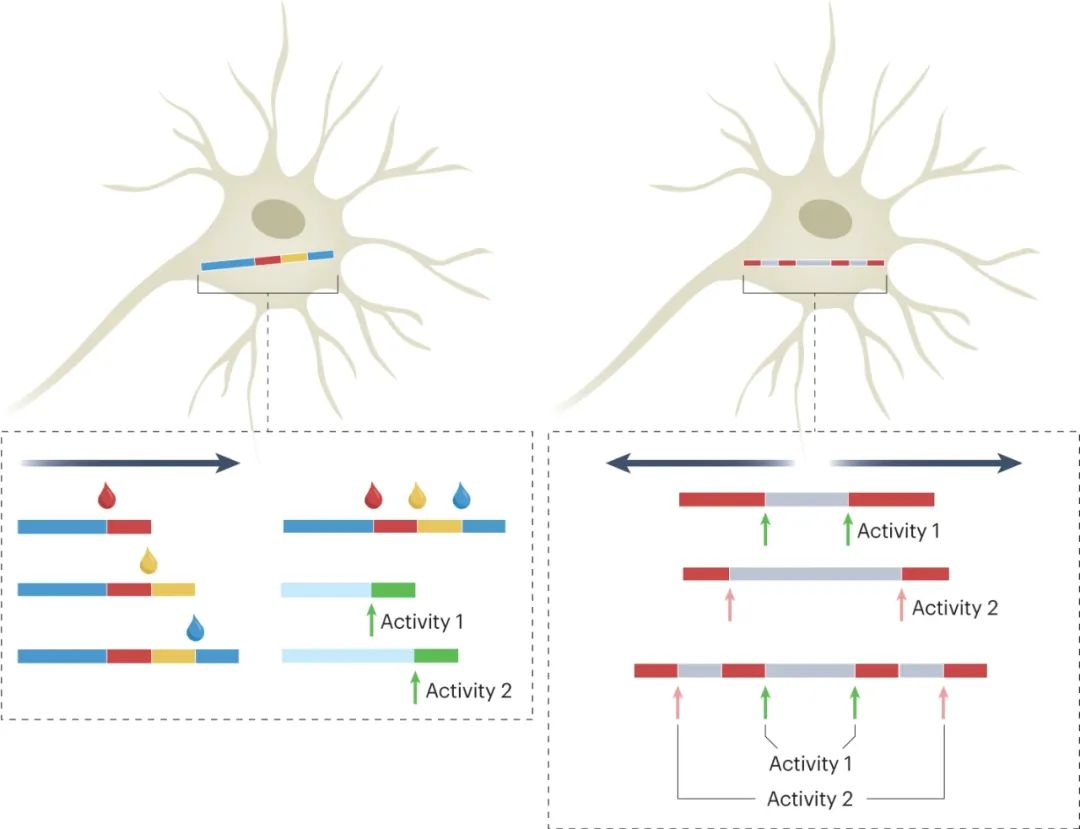
图|记录转录活性的分子系统
先前的研究已经证明了以核酸形式编码细胞历史的可行性。然而,DNA或RNA序列修饰的分析需要细胞裂解,这消除了空间信息。相比之下,这两项研究的基于蛋白质的方法保留了空间信息,使得能够在完整组织的背景下绘制复杂细胞群体的活动图。
第一篇研究Lin等人的方法是一种基于自然结晶现象的录音带(ticker tapes)系统。当融合蛋白iPAK4(由丝氨酸/苏氨酸激酶PAK4的催化结构域和其内源性抑制剂iBox的33个残基组成)在哺乳动物细胞中表达时,它在细胞质中形成杆状蛋白晶体。该晶体有一个中央通道,其大小足以容纳其他蛋白质,如EGFP或HaloTag(HT)。作者首次表明,细胞中EGFP–iPAK4和HT–iPAK5的表达导致HT和EGFP结合到生长的晶体纤维中。
通过添加用户选择的HT配体染料来实现每个细胞中时间戳的精确颜色划分。当表达时,与HT融合的目的蛋白将与染料结合并结合到生长的晶体中。由于纤维在一次染料注射和下一次注射之间以近似恒定的速率生长,因此在该时间间隔内在纤维上留下标记的任何转录活性的时间可以从已知的染料注射时间推断。在细胞间纤维长度和生长率不均匀的实验环境中,这一特性对于插值细胞事件的精确定时非常重要。固定后,可以分析颜色的位置(染料和转录驱动的荧光标记蛋白)。细胞间的差异可以通过单个细胞中晶体生长速率的标准化来校正。
正如Lin等人所证明的,该技术能够以5–10分钟的时间分辨率实现光纤生长的广域延时成像。但这种高时间分辨率伴随着记录持续时间的权衡。由于iPAK4晶体不能在细胞中无限生长,成像时间在纤维成核后约10–24小时。最大记录持续时间可能取决于其环境,需要进一步调查。这种方法有可能在一个小的大脑中实现活动映射。事实上,作者证明了在结合c-Fos诱导的EGFP蛋白报告子和四环素介导的Tet-ON转录的系统中,单个神经元细胞中启动子活性的定量。
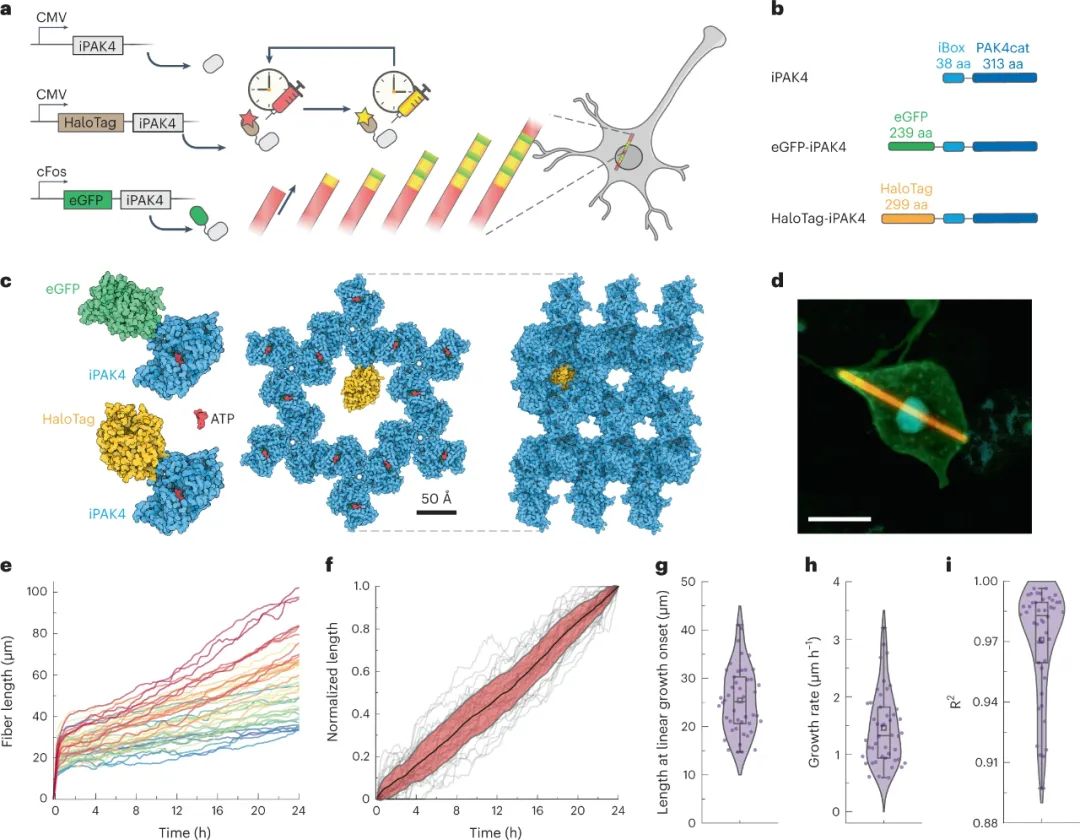
图|iPAK4形成细胞内蛋白纤维
在第二项研究中,Linghu等人描述了一种称为表达记录岛(expression recording islands, XRI)的转录活性跟踪系统,该系统依赖于自组装蛋白链和荧光成像。它在概念上类似于Lin等人的录音带系统,但它是完全基因编码的,因此不需要注射染料。XRI系统使用八聚体同聚体1POK(E239Y)的突变形式,这是一种基于大肠杆菌异氨酰二肽酶的工程化成丝蛋白。作者通过将1POK(E239Y)融合到“绝缘体”成分(如mEGFP或麦芽糖结合蛋白(MBP标签))上来制造其他变体,以确保蛋白组装仅产生纤维样结构,而非蛋白聚集体。
由于蛋白质链以恒定的速率连续生长,较高浓度的蛋白质单体更有可能结合到链中。因此,当具有一个表位标签的蛋白质单体正在形成链时,如果具有不同表位标签的其它蛋白质单体由活性依赖性启动子表达,则每个表位标签的水平可以通过事后免疫染色来定量。
为了了解这个系统的能力,确定蛋白质组装的时间限制和可以测量的最长时间段是很重要的。这些参数取决于细胞状态和所给予的刺激类型。作者证明,在活神经元中,蛋白质组装的延长率在7天内保持一致。时间校准与细胞群中XRI的长度、厚度或曲率无关,也不取决于XRI上携带信息的标签(例如Flag标签)的类型。由于XRI是基因编码的,并允许活细胞长期稳定生长,因此作者能够在清醒的小鼠中记录类似的时间信息,并在同一细胞中发生两个不同的连续转录事件。这种较长的记录持续时间的代价是较低的时间精度。时间分辨率似乎需要几个小时,尽管这个数字的精确确定需要进一步调查。
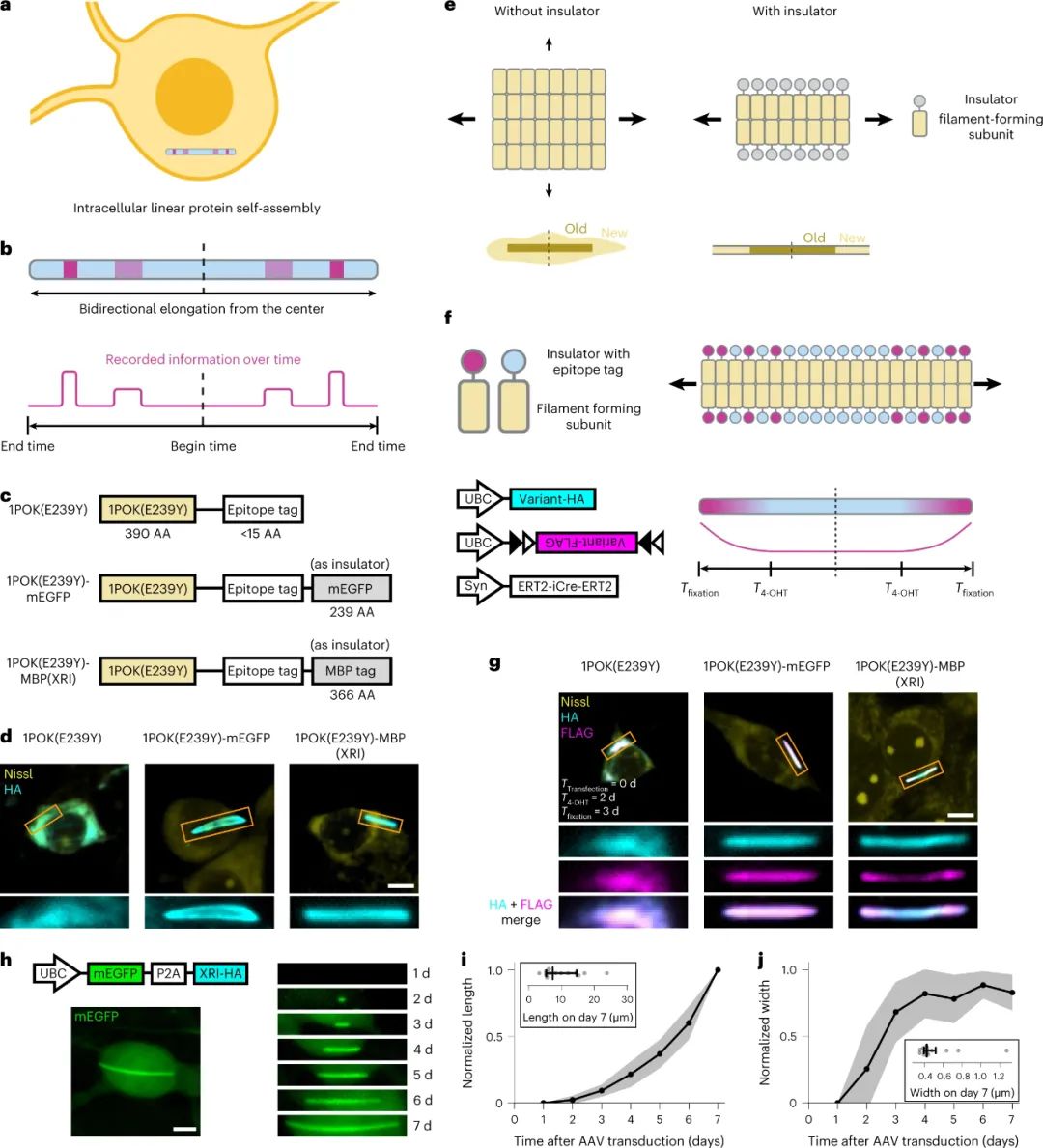
图|基于线性蛋白质自组装的细胞生理记录设备的概念和发展
总之,这两篇论文开创了在1-7天的时间段内测量细胞转录历史的方法,而不需要费力的步骤或昂贵的设备。这些系统在完整的细胞环境中保存生理信息,例如细胞类型或空间位置。尽管当前版本的技术可能无法监测多周的活动历史或报告外源刺激诱导的转基因表达以外的活动,但这一概念有很大的潜力以许多不同的方式应用。人们可以设想未来的发展,其允许创建各种几何形状的蛋白质组件或包括控制组件生长速率的机制。还可以使用多种诱导剂,例如其他药物、钙或光诱导系统,以便蛋白质链可以记录各种细胞事件。以这些方式对记录进行多路复用有望使细胞生命的历史变得越来越丰富。
参考文献:
1.Lin, D., Li, X.,Moult, E. et al. Time-tagged ticker tapes for intracellular recordings. NatBiotechnol (2023).
https://doi.org/10.1038/s41587-022-01524-7
2. Linghu, C., An, B.,Shpokayte, M. et al. Recording of cellular physiological histories alongoptically readable self-assembling protein chains. Nat Biotechnol (2023).
https://doi.org/10.1038/s41587-022-01586-7
3. Kwon, HB. Writingcellular history in protein chains. Nat Biotechnol (2023).
https://doi.org/10.1038/s41587-022-01597-4











