创伤性脑损伤(TBI)是一种由外力引起、影响最为严重的神经系统疾病, 目前它已被世界卫生组织列为造成年轻人死亡和致残的主要原因。脑微血管,作为血脑屏障的重要组成部分,非常容易受到外力而发生损伤,因此,血脑屏障的破坏是TBI中常见且突出的病理特征之一。然而,作为血脑屏障破坏的两大关键证据——脑微血管破裂以及血流灌注不足,由于当前成像技术时空分辨率的不足,仍然难以实现精准的可视化。另外,由于血脑屏障的破坏会引发例如炎症反应以及自由基介导的氧化损伤等等一系列分子生化事件,这些继发性损伤过程将进一步破坏血脑屏障从而导致例如癫痫、帕金森、阿尔兹海默症等长期的脑部并发症,严重影响TBI患者的生活质量。目前,利用自由基清除剂来抑制氧化损伤和神经炎症的神经保护疗法在TBI治疗中显示出良好的前景,但传统的神经保护策略依旧难以为治疗效果的评价提供及时地反馈。
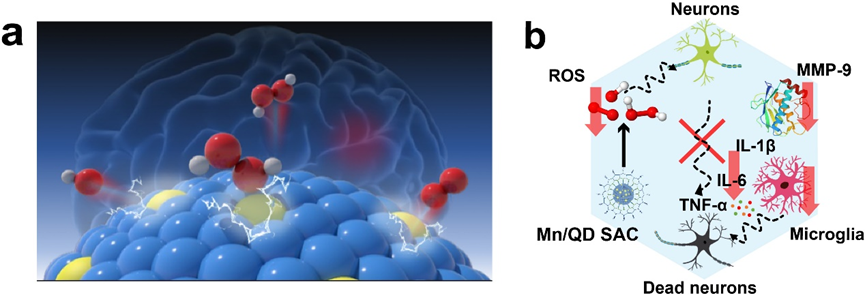
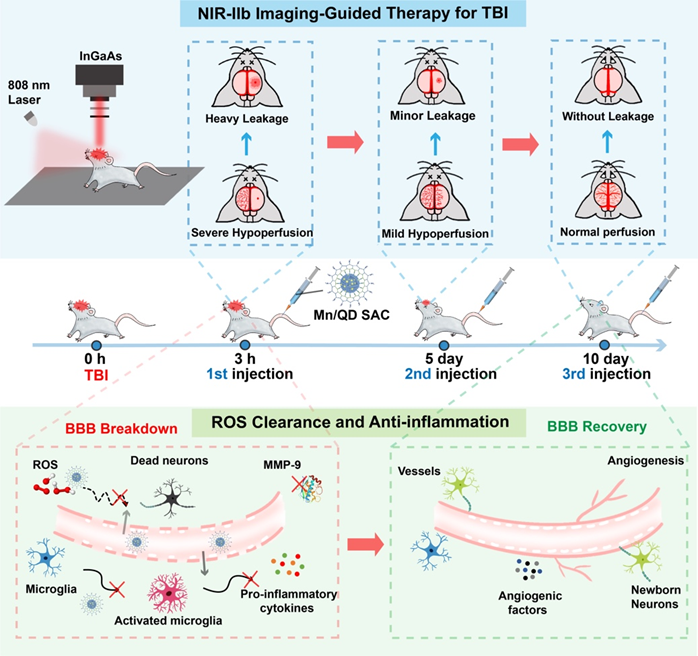
为了实现动态影像引导的精准TBI神经保护治疗,武汉大学化学与分子科学学院崔然副教授、张志凌教授、武汉大学口腔医院孙志军教授和武汉理工大学张明曦副教授受到天然Mn超氧化物歧化酶的启发,创新性地将具有抗氧化活性的Mn2+掺入到近红外IIb (NIR-IIb)区Ag2Te量子点中,构建出一种荧光发射波长位于NIR-IIb窗口的Mn单原子催化剂(Mn/QDSAC),能够成功打开TBI治疗过程中的“黑匣子”——以高时空分辨率实时动态地监测血脑屏障状态,为更加精准的治疗提供及时的疗效反馈和有力指导。另一方面,高度单原子分散于Ag2Te量子点表面的Mn使得Mn/QD SAC呈现高效清除活性氧的催化活性,能够有效缓解TBI后活性氧介导的神经炎症和神经凋亡,借助此治疗策略,成功地实现了血脑屏障的快速重建和神经功能恢复。该工作为实时动态影像引导的精准神经保护治疗以及一些活性氧相关疾病提供了新的思路与研究基础。
本文要点:
1. 基于纳米粒子的“自净化”特性,采用“高温成核、高温生长”的掺杂策略将Mn成功地引入并以单原子形态分散于Ag2Te量子点晶体的表面,构建出一种具有类超氧化物歧化酶(SOD)和类过氧化氢酶(CAT)催化活性NIR-IIb发射Mn单原子催化剂,表现出高效的活性氧(ROS)综合清除能力和NIR-IIb荧光性能。
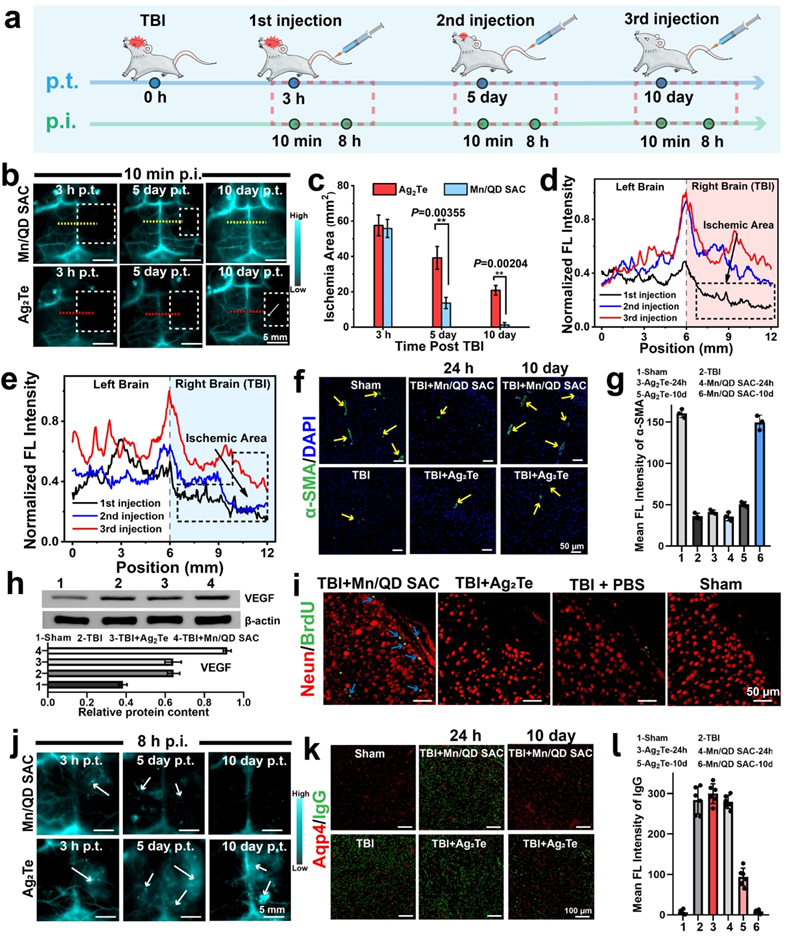
2. 针对在TBI治疗过程中血脑屏障状态难以反馈的“黑匣”问题,该方法借助NIR-IIb荧光成像对TBI后血脑屏障的动态变化进行了无创、实时、高时空分辨率的成像,通过对血脑屏障的损伤程度、范围进行精准时空评估能够及时地获取疗效反馈,对后续采取合适的治疗策略提供有力指导。
3. 单原子催化剂Mn/QD SAC可有效抑制基质金属蛋白酶9(MMP-9)的表达、小胶质细胞的活化以及炎症因子的释放,缓解ROS介导的脑部炎症,减少水肿的发生以及神经元的凋亡,促进血脑屏障的快速重建和提升神经功能的恢复效果。
该研究成果近日以论文形式在线发表在综合性权威期刊Nature Communications上,题目为“Near-Infrared-IIbEmitting Single-Atom Catalyst for Imaging-Guided Therapy of Blood-Brain BarrierBreakdown after Traumatic Brain Injury”。武汉大学化学与分子科学学院2020级博士研究生黄彪为第一作者,武汉大学崔然副教授、张志凌教授和孙志军教授、武汉理工大学张明曦副教授为该论文共同通讯作者,崔然副教授为最后通讯作者。
上述研究工作得到了国家重点研发计划(2020YFA0908800)、国家自然科学基金(22174105,21974104, 22074107, 22274118,82072996)的支持。
文章链接:
https://www.nature.com/articles/s41467-023-35868-8











