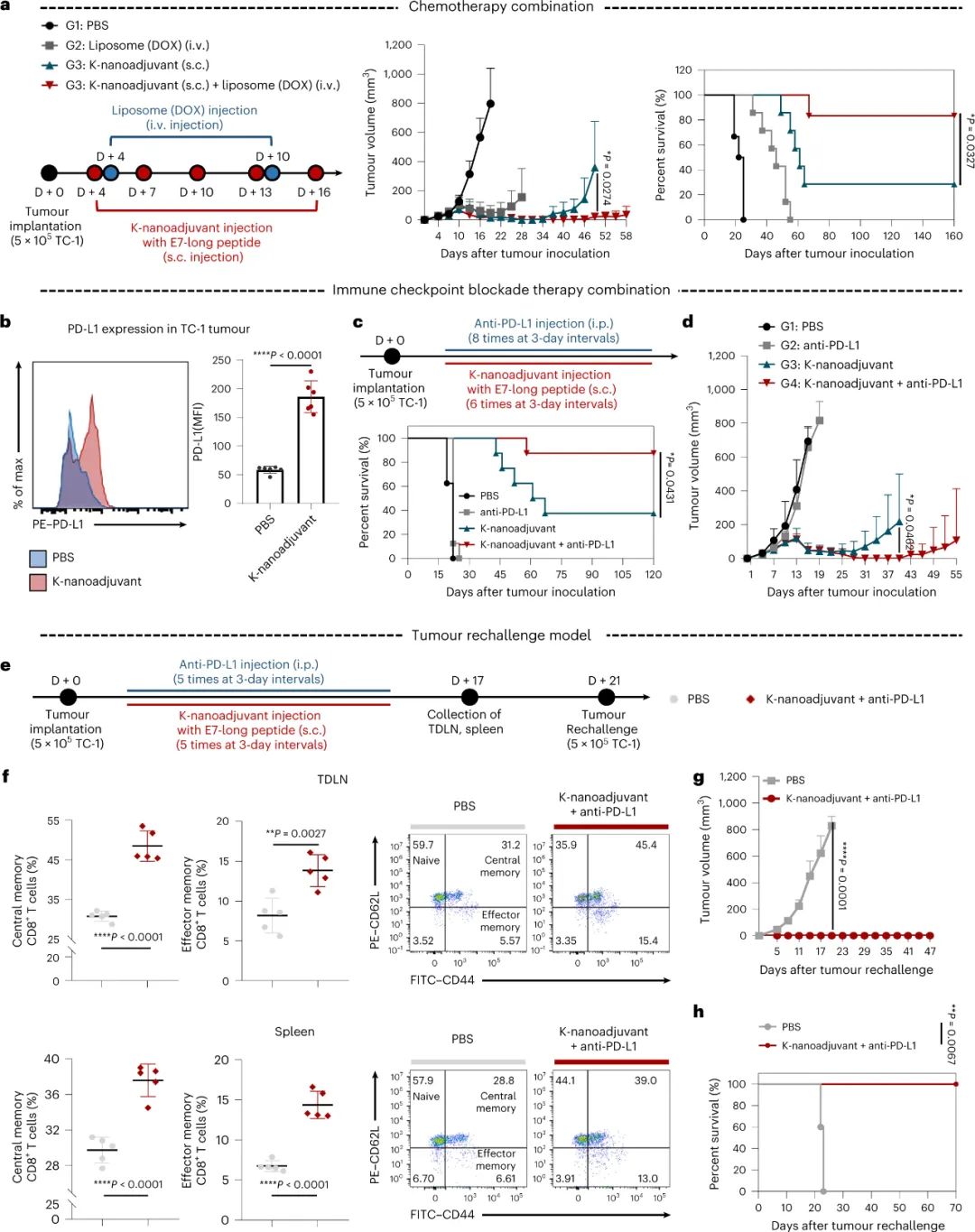
为了增强癌症免疫疗法,需要重新激活癌症患者体内已被削弱或失活的免疫细胞,以对以复杂和动态的方式存活、突变和适应的癌细胞做出特异性和动态的反应。由于静息抗原呈递细胞 (APC) 的激活是启动适应性抗肿瘤免疫的关键步骤,因此采用“病原体模拟”策略,利用了病原体的大小、形状和表面分子组织等关键特征来控制癌症免疫治疗中的先天免疫。然而,APC 的成熟不仅受 APC 成熟刺激的性质的调节,还受刺激的持续时间、组合和时间的调节,它们共同影响随后的 T 细胞反应。此外,尽管传统的先天免疫刺激,如 Toll 样受体 (TLR) 激动剂,有助于免疫激活,但它们最终会导致 APC 和 T 细胞耗竭,导致癌症免疫治疗效果不佳;因此,调整先天免疫的策略对于实现有效的癌症免疫治疗尤为重要。特别是,如何控制 APC 的免疫调节动力学以实现强大的先天性和适应性免疫反应而不诱导耗竭的免疫细胞仍然未知。从触发组合TLR刺激的病原体中获取线索,试图通过 TLR 刺激物的物理化学操作将多个 TLR 刺激物整合到一个确定的“时间窗口”中,以诱导效应物/未耗竭的树突状细胞(DC),从而延长白介素(IL)-12(p70)的分泌,已知它不仅可以诱导 CD8+ T 细胞和自然杀伤 (NK) 细胞的效应功能,还可以保护 CD8+ T 细胞免于耗竭。为了解决这些问题,韩国成均馆大学Yong Taik Lim等研究人员设计并开发了一种基于纳米脂质体的K-纳米佐剂,它可以同时将 TLR3a 和及时激活 TLR7/8 激动剂 (t-TLR7/8a) 递送到 APC 中,从而以同步方式实现TLR激活的最佳顺序、持续时间和时间窗。假设在最佳时间窗内使用TLR3a介导的免疫激活作为第一波刺激和t-TLR7/8a激活作为第二波刺激的K纳米佐剂中的刺激的顺序组合,将比同时组合刺激物更有效地诱导效应器/非耗竭DC,其可编程IL-12的高强度和持续分泌。研究人员还推断,由K纳米佐剂启动的定制免疫激活可以产生效应/非耗竭CD8+ T细胞和活化的NK细胞,作为单一疗法或与抗 PD-L1 或脂质体(多柔比星)的联合疗法,导致有效的抗肿瘤免疫。为了开发时空激活的t-TLR7/8a,研究人员设计了一种新的TLR7/8a,其基于TLR7/8a中推定活性位点(C4胺,一种已知通过氢键与TLR7/8相互作用的胺部分)的瞬时化学失活,以及通过可被γ-干扰素诱导的溶酶体硫醇还原酶(GILT)在溶酶体内微环境中裂解的化学连接体恢复活性。这项研究报告了GILT的使用,GILT是已知的唯一催化内吞途径中外源抗原二硫键还原的酶,作为 APC 动态免疫调节的静态免疫刺激剂的触发因素。
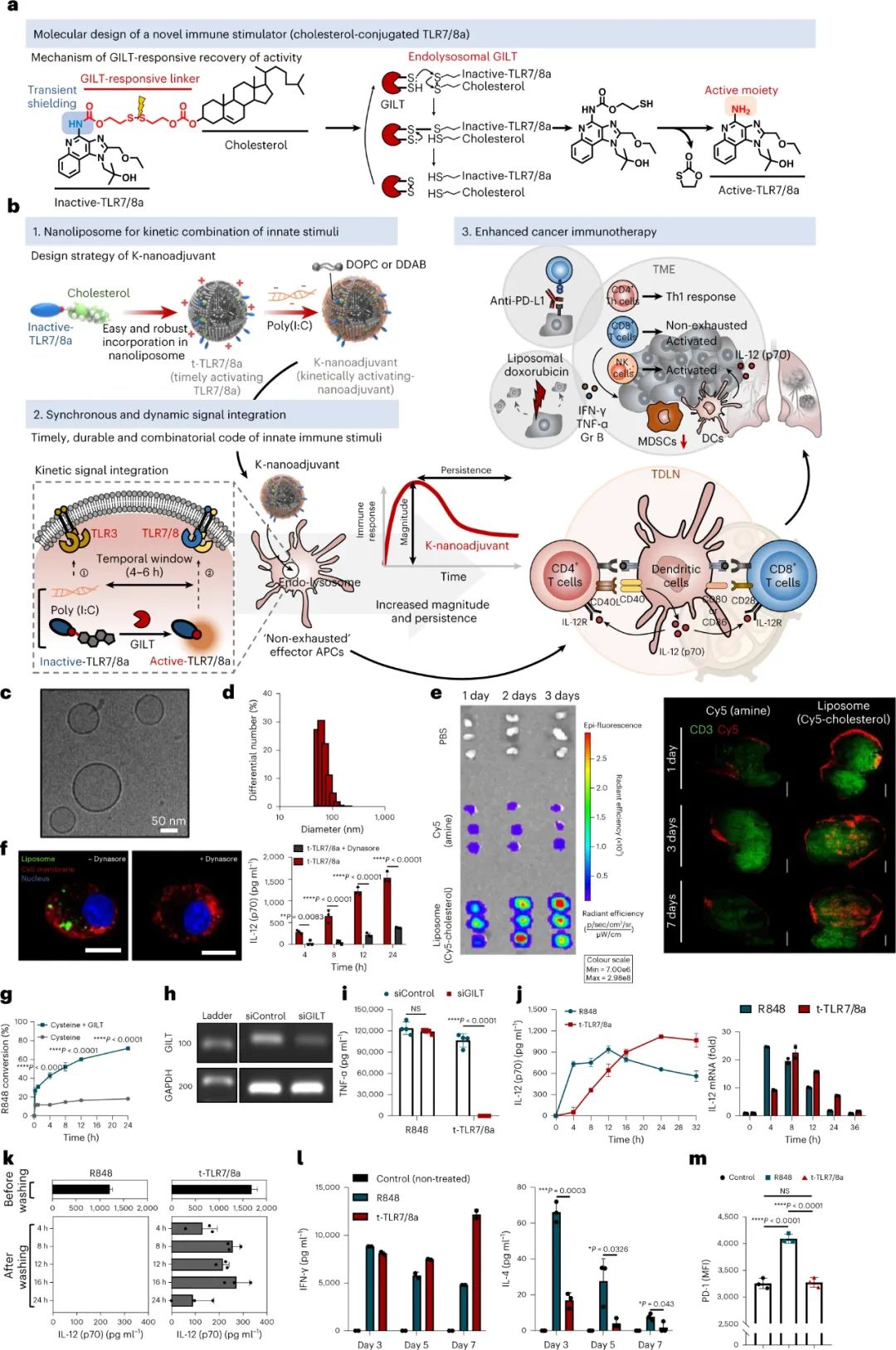
图|t-TLR7/8a 和 K-纳米佐剂的设计和表征及其时间依赖性免疫调节活性胆固醇被选为瞬时屏蔽阻滞剂,因为它具有固定在脂质膜中的能力,因此能够轻松地将胆固醇-TLR7/8a 偶联物掺入纳米脂质体中,并具有高包封效果。t-TLR7/8a 在大约 100nm 处表现出均匀的尺寸分布,这可以促进皮下给药后直接引流到淋巴结 (LN) 并滞留在淋巴结 (LN) 中。重要的是,由于 t-TLR7/8a 的重新激活需要 4 小时,这个理想的“时间窗口”使得能够通过用 t-TLR7/8a 和 LPS 或poly(I:C)同步处理来实现 BMDC 产生有效的 IL-12(p70),因此,受此组合编码的启发,研究人员开发了一种由 t-TLR7/8a 和poly(I:C)组成的 K-纳米佐剂作为纳米脂质体制剂,并通过测量稳定构象和非聚集纳米颗粒制剂的静电相互作用。
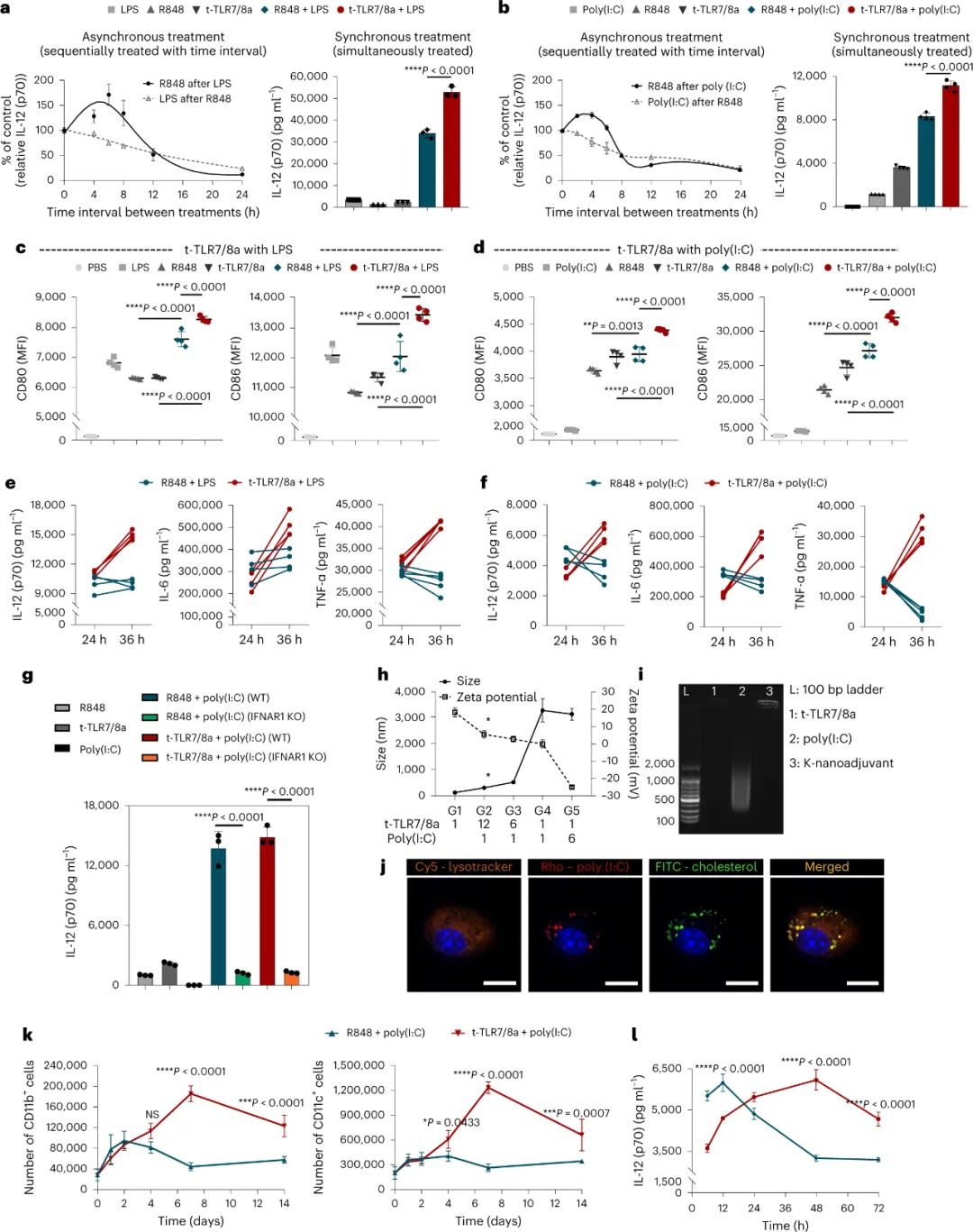
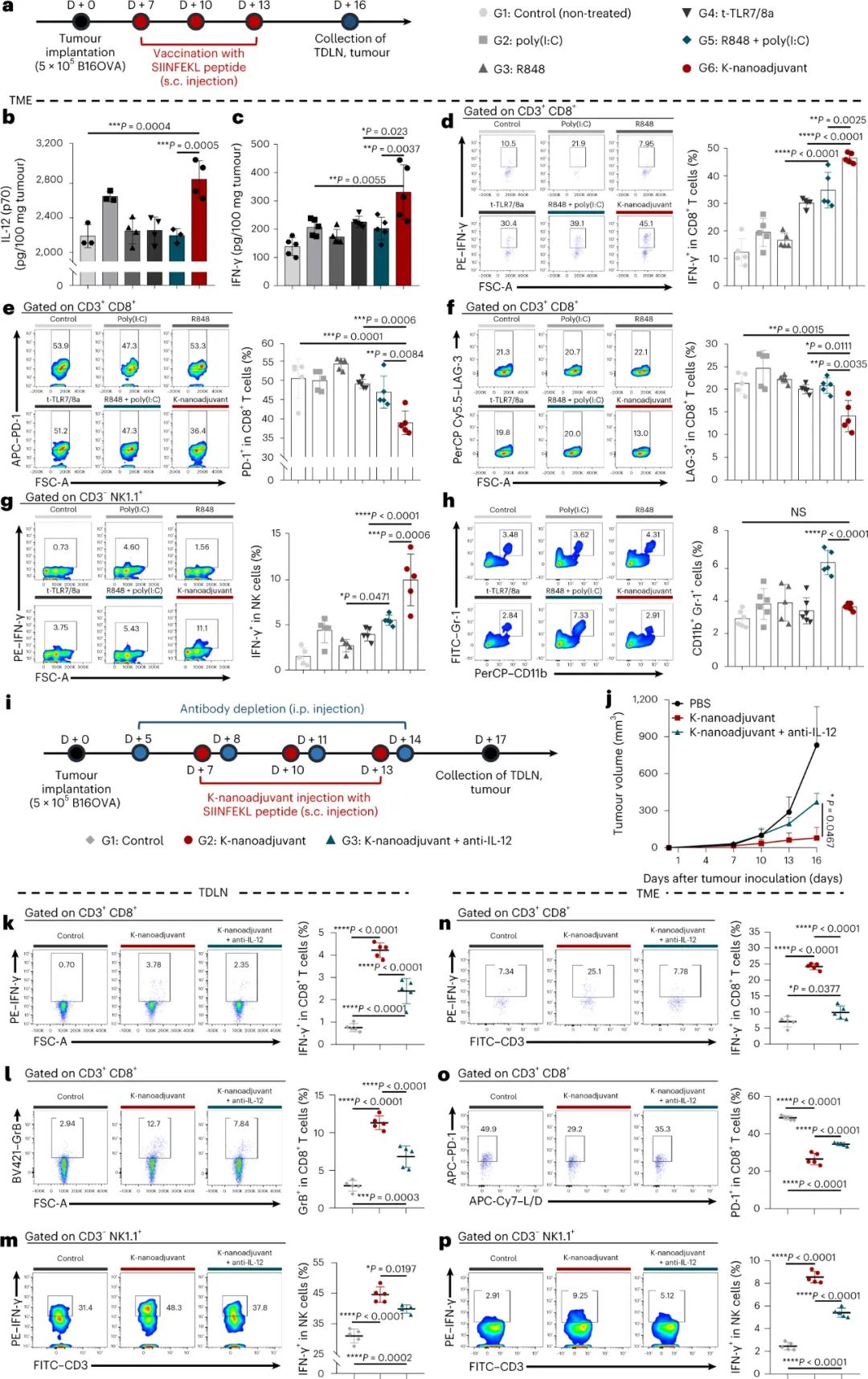
图|t-TLR7/8a 和 TLR3a 或 TLR4a 的组合编码以及 K-纳米佐剂的表征GILT处理的用于 t-TLR7/8a 和 TLR3a 或TLR4a 信号整合的 K-纳米佐剂的组合编码可以在顺序、持续时间和时间窗口方面进行优化,从而产生效应/未耗竭的 DC 诱导增强和持久的IL-12 分泌和高迁移能力。研究人员进一步证明,用 K-纳米佐剂免疫的小鼠表现出显著增强的抗原特异性 CD8+ T 细胞,产生细胞因子(IFN-γ、颗粒酶 B 和 TNF-α)并表达激活标记物(4-1BB、CD28 和 CD69),并激活 NK。与施用R848和poly(I:C)的可溶性混合物的小鼠相比,TME中CD8+ T细胞上抑制分子如PD-1和TIM-3的表达降低。IL-12的中和基本上消除了K纳米佐剂对TDLNs和TME中T和NK细胞的抗肿瘤活性的影响,表明IL-12作为K纳米佐剂介导的先天免疫调节和适应性抗肿瘤免疫之间的关键连接物发挥了重要作用。研究人员还注意到,当与抗PD-L1或脂质体(阿霉素)联合使用时,局部注射的K纳米佐剂可诱导显著的系统和记忆免疫反应,并与癌症免疫治疗协同作用。图|B16OVA 模型中 K-纳米佐剂诱导的体内抗肿瘤免疫反应及其对 IL-12 的依赖性该研究应该与一些创新性进展有所区别,这一方法证明了APC的动态免疫调节,其基于“非靶位点的休眠(良性)和靶位点的恢复(活性)”策略以及GILT诱导的多个TLR刺激的时间调节,以实现最佳信号整合。此外,本研究中提出的策略可以扩展为通过时空激活原理最小化TLR刺激的系统免疫相关副作用的方法。预计基于对其他TLR7/8a药物成分的瞬时化学失活,该动力学调节策略具有普遍性,这可以赋予它们动态免疫调节能力。还观察到GILT酶在人moDC中高度表达,这表明K-纳米佐剂的免疫调节特性可以作为一种新的临床方案应用于人类,用于具有强趋化能力和高IL-12(p70)产生的DC的成熟。此外,该研究结果还对临床试验具有广泛的适用性,因为t-TLR7/8a可以与临床环境中研究的各种先天免疫刺激物(poly(I:C)、干扰素基因刺激物(STING)激动剂、单磷酰脂质A(MPLA)、TLR2/4激动剂(BCG细胞壁骨架)和α-半乳糖神经酰胺)结合。K-纳米佐剂还可以与SARS-CoV-2的棘突蛋白抗原一起配制成疫苗,以改善体液和细胞免疫反应。总之,这样一种动态激活的佐剂,它优化了t-TLR7/8a与其他先天刺激的组合编码,可以转化为用于免疫治疗和未来大流行的人类疫苗的开发。Jin, S.M., Yoo, Y.J., Shin, H.S. et al. A nanoadjuvant that dynamically coordinates innate immune stimuli activation enhances cancer immunotherapy and reduces immune cell exhaustion. Nat. Nanotechnol. (2023).https://doi.org/10.1038/s41565-022-01296-w