在2023年首篇Nature Nanotechnology中,麻省理工学院Jeremiah A. Johnson、Caroline A. Ross等人报道了关于新型三嵌段共聚物的设计和合成,这种共聚物能够在多种长度尺度下产生结构有序性,从而形成复杂和分级的纳米级相。(2023年首篇Nature Nanotech.:自组装!)
才刚过半个月,Jeremiah A. Johnson等人在Nature Nanotechnology上再次发表了关于上述自组装嵌段共聚物研究的进一步生物医学的应用。控制药物在组织中的暴露仍然是现代癌症治疗最持久的挑战,也是药物输送的圣杯。通过利用尺寸、形状、组成和释放动力学等特征,纳米载体可以通过增加其在患病部位的暴露和或避免主要毒性部位来提高药物的治疗指数。纳米药物组合疗法的发展代表了现代癌症治疗的前沿。尽管最近癌症生物学的开创性进展大大提高了识别和预测药物组合的合成致死性的能力,但这种组合的临床转化面临着根本性的障碍。例如,由于不同药物的不同物理特性,那些在体外具有协同作用的药物的组合可能不会在体内的靶组织/细胞中积累。由于这种脱节,许多临床联合疗法都是基于每种成分药物的最大耐受剂量(MTD)而非合理协同作用的经验得出的。联合疗法提供了一个令人兴奋的纳米医学机会,其中药理学上不同的多种药物可以以精确的比例输送到相同的组织/细胞,以增强其协同机制。例如,Vyxeos (CPX-351),一种临床上成功的脂质体制剂,由 5:1 阿糖胞苷:柔红霉素组成,在注射后 24 小时内在血液隔室中保持协同药物比例(从 5:1 到 9:1),而游离药物注射后15 分钟的比例为 1923:1。尽管通过封装、化学偶联和或自组装将结构不同的药物混合物的策略进行了广泛研究,但同时实现受控药物比例、多药释放动力学和或两种或多种药物顺序释放的纳米载体仍然很少见。此外,由于细胞摄取途径、细胞内化速率和或药物释放动力学的差异,多药纳米载体可能表现出不同于其游离药物对应物的协同比率,因此需要在纳米载体背景下确定最佳比率。鉴于大多数纳米载体依赖于药物、载体和或表面活性剂之间的超分子相互作用,这取决于药物的物理性质,将一种药物换成另一种药物可能会导致最终纳米载体的物理性质发生变化。因此,很难制备具有不同药物比例但其他特性相同的多种单药纳米载体和多药纳米载体。因此,在迄今采用的纳米载体组合中,游离药物的协同药物比例通常直接转化为纳米载体,而不考虑这些比例可能不再是最佳的可能性。此外,多药纳米载体是否比单一药物纳米载体的混合物具有根本优势仍不得而知。鉴于此,麻省理工学院Jeremiah A. Johnson、哈佛医学院P. Peter Ghoroghchian和Irene M. Ghobrial等人介绍了一种纳米载体设计,使能够在血液系统恶性肿瘤(多发性骨髓瘤 (MM))的背景下解决这些问题,这种疾病在大多数患者中仍然无法治愈。
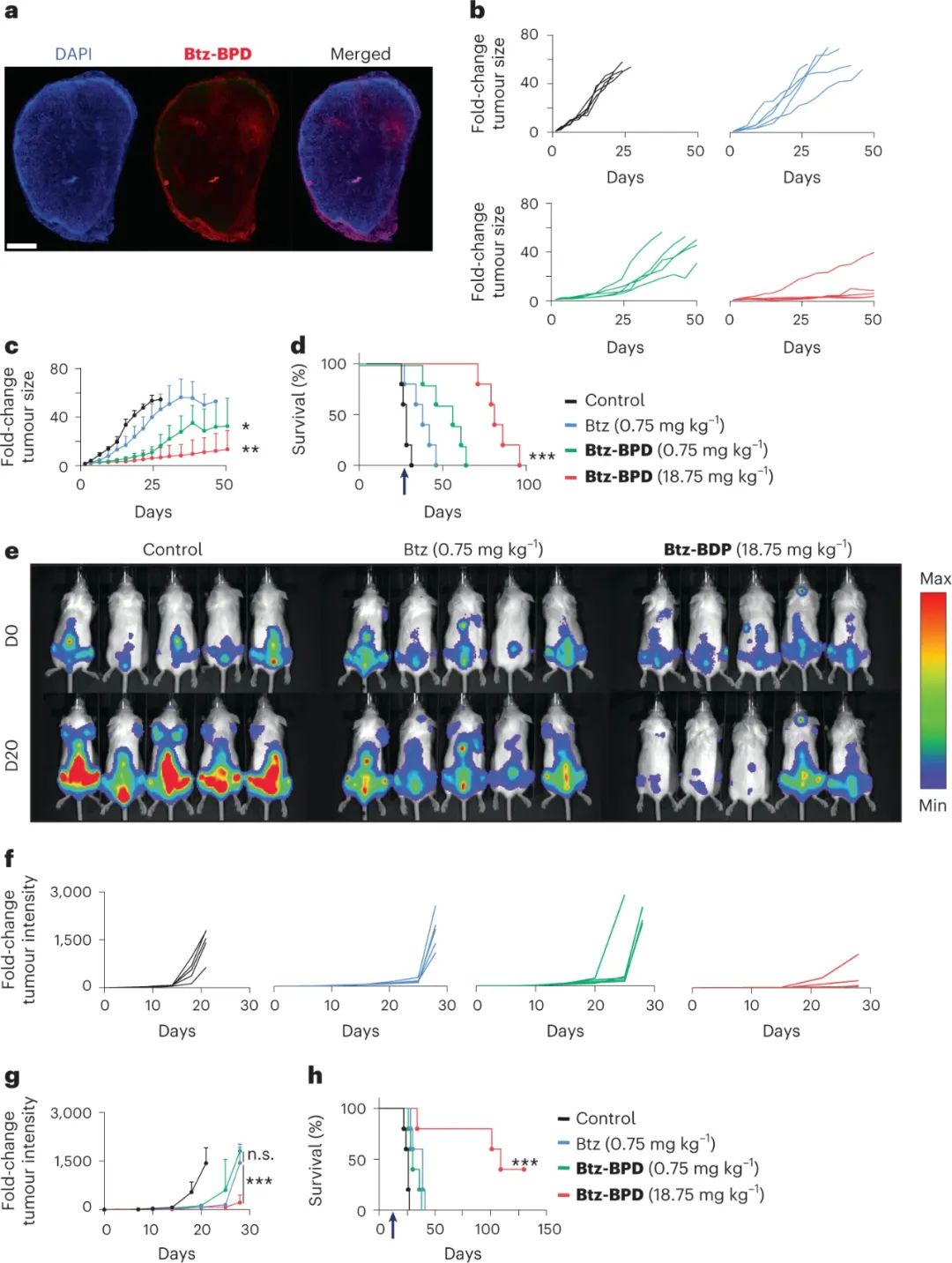
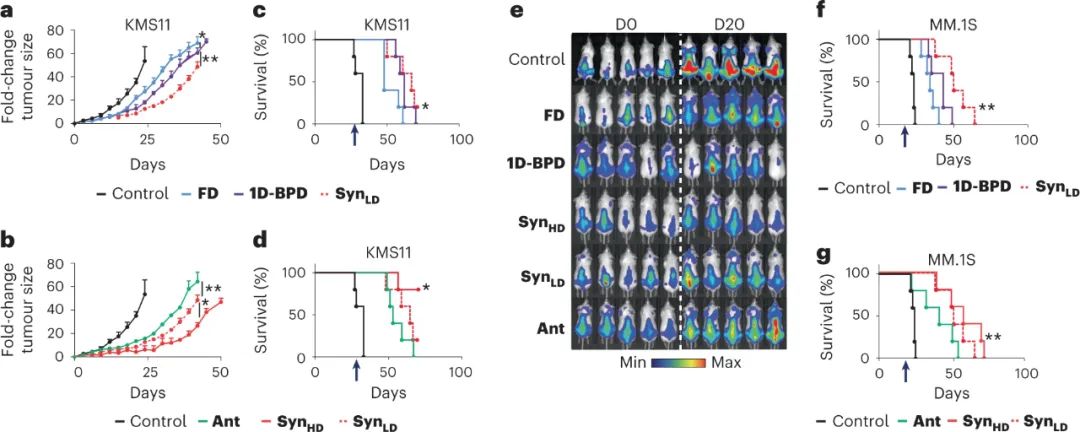
该研究利用“瓶刷前药”(Bottlebrush prodrugs, BPD),包括蛋白酶体抑制剂 (PI) 硼替佐米 (Btz)、免疫调节药物泊马度胺 (Pom) 和皮质类固醇地塞米松 (Dex) 的临床相关三药组合。这种药物组合能够克服对来那度胺 (Len)/Btz/Dex 一线和标准护理方案的耐药性,因为与 Len 相比,Pom 具有更高的靶标结合亲和力。尽管在临床上根据经验推导了这种组合,但它在 Len 难治性患者(17.8 vs 9.5 个月)和非 Len 难治性患者(22.0 vs 12.0 个月)中提供了延长的无进展生存期;此外,它提高了两种环境下的总生存率(分别为 85.90% vs 50.80% 和 95.37% vs 60.00%)。然而,该组合存在主要由组织外毒性、稳定性差和 Btz 耐药性发展引起的重大缺陷。尽管基于纳米颗粒的 Btz 制剂的几个例子已被报告为单一疗法,但到目前为止,它们在疗效方面仅比游离 Btz 有微小的改进。相比之下,用于 MM 的组合纳米药物非常罕见,并且尚未报道包含 Btz、Pom 和 Dex 临床组合的纳米载体。此外,在任何疾病背景下,都没有证明具有系统优化协同比的两种以上药物联合疗法的例子。于此,研究人员表明 (1) 体外鉴定的游离药物之间的协同作用不一定转化为BPD,(2)BPD具有协同比率的药物统计混合物,比以相同比率施用的三种不同物理等效的单药BPD的混合物更有效。BPD制备涉及Btz、Pom 和 Dex 大分子单体前药的合成。随后,Btz-M、Pom-M和Dex-M通过开环复分解聚合反应分别得到单药BPDs Btz-BPD、Pom-BPD和Dex-BPD,数均聚合度为10。所有样品,无论有效载荷组成如何(即单药、多药或无药物),都显示出一致的大小(10-15 nm)。
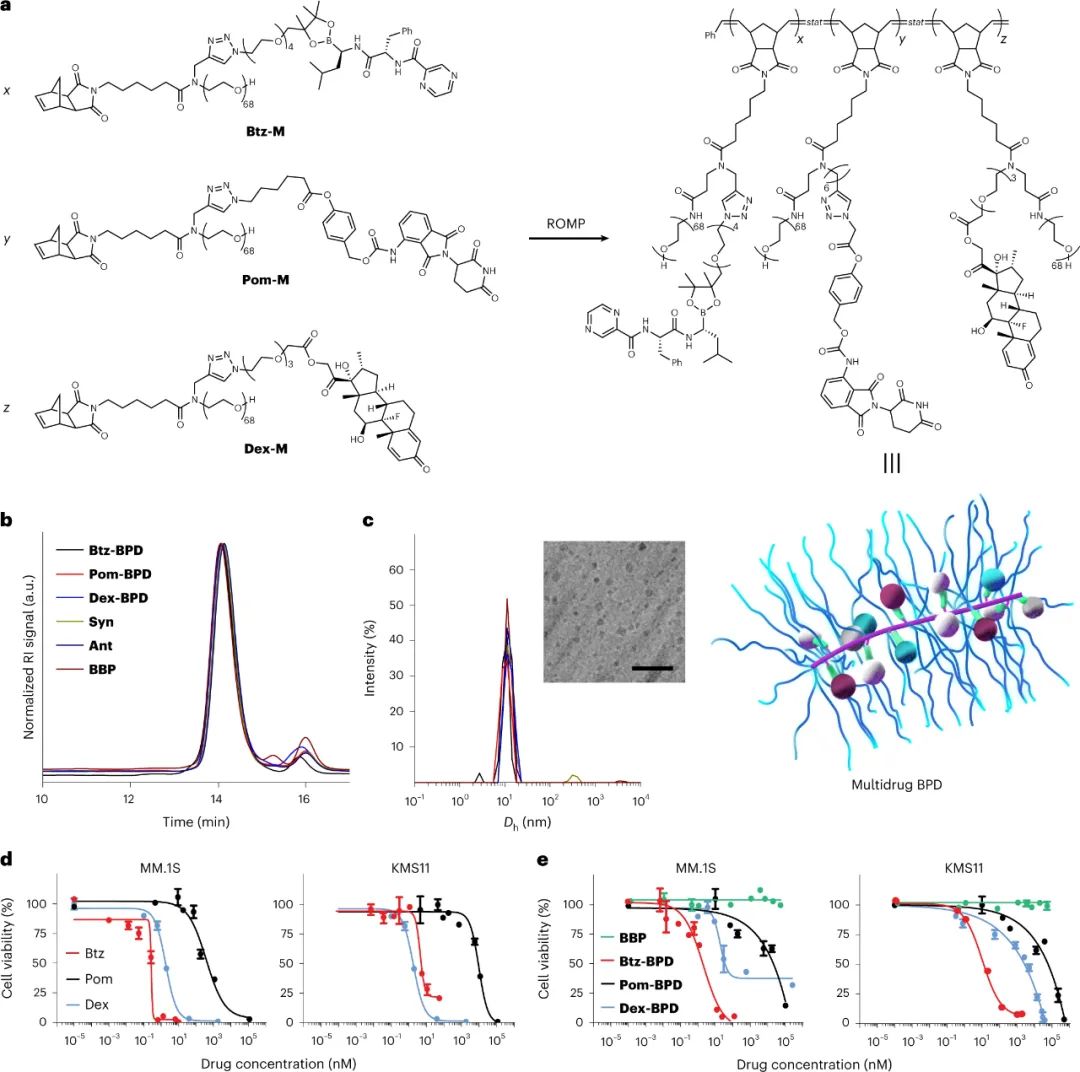
在体内外治疗实验中,首先,研究人员介绍了基于 PI 的单一疗法 (Btz-BPD),与标准 PI Btz 相比,它的疗效显着提高,并且在两种 MM 体内模型中未显示可检测到的毒性。然后,通过制造Btz、Pom 和 Dex的单一药物BPD,研究人员观察到 BPD 分别显示出协同、加和或拮抗模式,这与相应的游离药物对应物不同,表明应在纳米载体环境中测量协同作用。图|Btz-BPD 在 MM两种模型中比 Btz 提供了实质性的治疗增强最后,三药 BPD 在体内表现优于三种单一药物 BPD 和游离药物的混合物,这是定量建模的。总的来说,这项工作为MM 提供了潜在的可转化疗法,并为在其他疾病背景下优化和制造组合纳米药物提供了新的机制见解。图|在 MM 小鼠模型中协同三药 BPD 的治疗效果得到改善综上所述,本文报告了一种纳米药物策略,该策略为MM和潜在的其他癌症提供了一种有前途的新的基于PI的治疗,并能够将体外确定的三种药物协同作用快速转化为体内。然而,这种方法也提出了监管问题,随着联合治疗领域的发展,这些问题将变得很重要。例如,出于监管目的,携带药物统计混合物的纳米载体是否通常被归类为单一实体?如果是这样,与纳米载体的混合物相比,这种方法可能是有利的,其中每个纳米载体都需要独立评估。此外,尽管此处显示 Btz、Dex 和 Pom 之间确定的协同作用在四种不同的细胞系中保持不变,但鉴于 MM 的异质性,不确定该比例是否对所有 MM 细胞系和患者都是最佳的。(2)CI 筛选以确定这些细胞中是否保持协同作用或是否存在替代的协同作用比率;(3)如果保持协同作用,则可以管理现有的 BPD,如果不能,则可以按需生成具有特定患者比例的 BPD。如果 BPD 组合疗法的成分(例如前药大分子单体或单一药物 BPD)可以作为一个包进行转化步骤,则后者将得到促进。总而言之,组合纳米医学领域的这些问题和方向令人着迷。Detappe, A., Nguyen, H.VT., Jiang, Y. et al. Molecular bottlebrush prodrugs as mono- and triplex combination therapies for multiple myeloma. Nat. Nanotechnol. (2023). https://doi.org/10.1038/s41565-022-01310-1