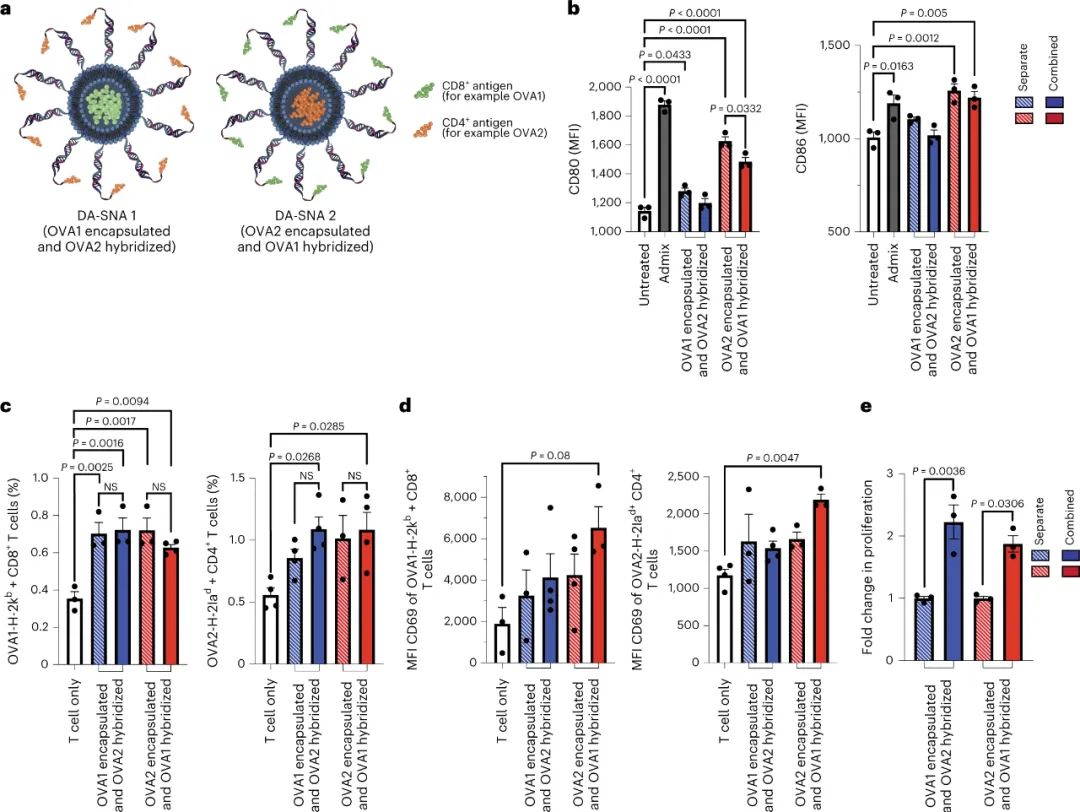
表达特定抗原的癌症是疫苗治疗的理想模型,因此已在该领域得到广泛探索。然而,癌症疫苗表现出不同程度的成功,因为许多侵袭性癌症具有异质性和快速变异,这可能导致免疫系统逃避并降低疫苗有效性。一种改进癌症疫苗的方法涉及整合多个肿瘤靶标,激活全系统的多 T 细胞免疫反应。多种抗原靶标已作为肽或脂质包封的 RNA 的简单混合物掺入疫苗制剂中。然而,这些方法几乎无法控制这些成分的结构呈现,而这会显着改变疫苗的效力。因此,了解如何利用多抗原成分的结构呈现来最大化抗肿瘤反应对于开发有效的癌症疫苗至关重要。球形核酸(SNA)由纳米颗粒核心和免疫刺激性寡核苷酸的致密放射状壳组成,是在Chad A. Mirkin实验室发明和开发的。SNA为设计癌症疫苗提供了一个有前途的平台,因为它们可以进入 60 多种不同的细胞类型而不需要转染试剂,并且它们对核酸酶降解表现出很高的抵抗力。近日,美国六院院士、中国科学院外籍院士、西北大学Chad A. Mirkin教授等人利用SNA平台将两种抗原精确地整合到单一疫苗架构中,每种抗原针对不同类别的 T 细胞,以研究两种抗原类别的空间分布和位置如何影响抗原加工、细胞因子产生和记忆的诱导。

与单抗原 SNA 相比,单一双抗原 SNA 引起抗原特异性 T 细胞活化增加 30%,T 细胞增殖增加两倍。重要的是,研究人员评估了成分相同的 SNA 疫苗,这些疫苗仅在疫苗结构内的纳米级抗原放置方面有所不同,以了解抗原位置如何影响树突状细胞对它的处理。研究人员发现抗原放置改变了转录组水平的免疫通路调节,以及细胞水平的细胞因子产生、细胞因子分泌和免疫表面标志物表达,以及生物体水平的肿瘤生长。通过系统地研究抗原类别的放置与随后的免疫反应之间的关系,该工作提供了一套可转化的疫苗设计规则。
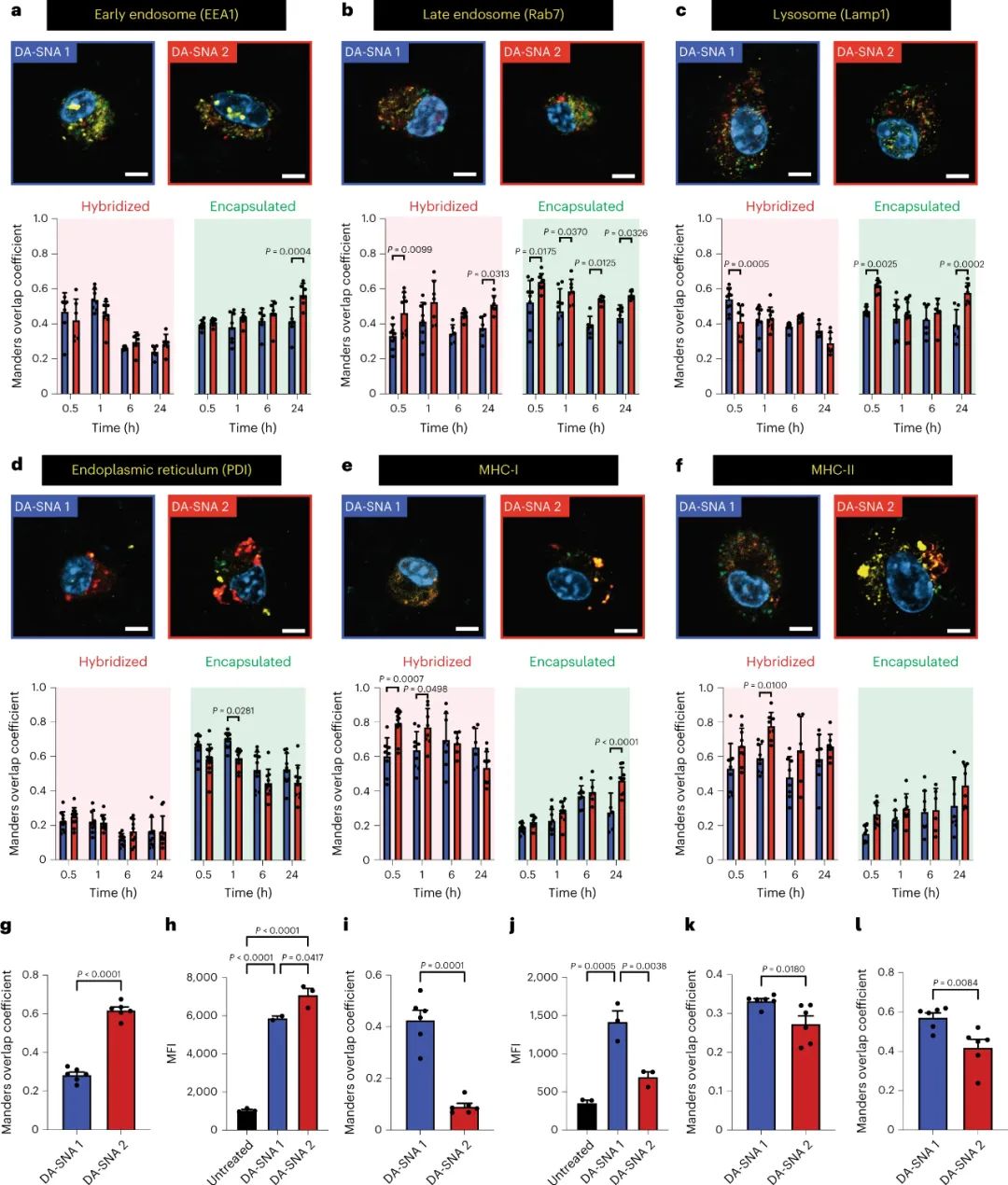
图|球形核酸(SNA)疫苗中两类抗原的递送改变了抗原在体外的处理方式研究人员明确地证明了疫苗结构中的抗原放置是一种会强烈影响疫苗效力的设计标准。研究人员观察到由抗原放置引起的免疫基因表达的变化,其中一种排列导致与炎症反应、趋化性和关键免疫细胞迁移有关的基因上调,这些基因共同影响免疫细胞活性。研究人员得出结论,纳米级抗原放置会改变细胞内抗原加工的时间尺度和抗原在不同细胞区室中的停留时间。抗原加工动力学的变化导致树突状细胞和 T 细胞活化的差异,例如细胞因子分泌和 T 细胞记忆标记表达的不同程度。总的来说,这些细胞效应改变了肿瘤的生长情况。研究人员利用一种带有封装的辅助性 T 细胞抗原和外部偶联的细胞毒性 T 细胞抗原的 SNA 排列,在小鼠体内阻止了三种不同的肿瘤类型,并增强了检查点抑制剂的功效。
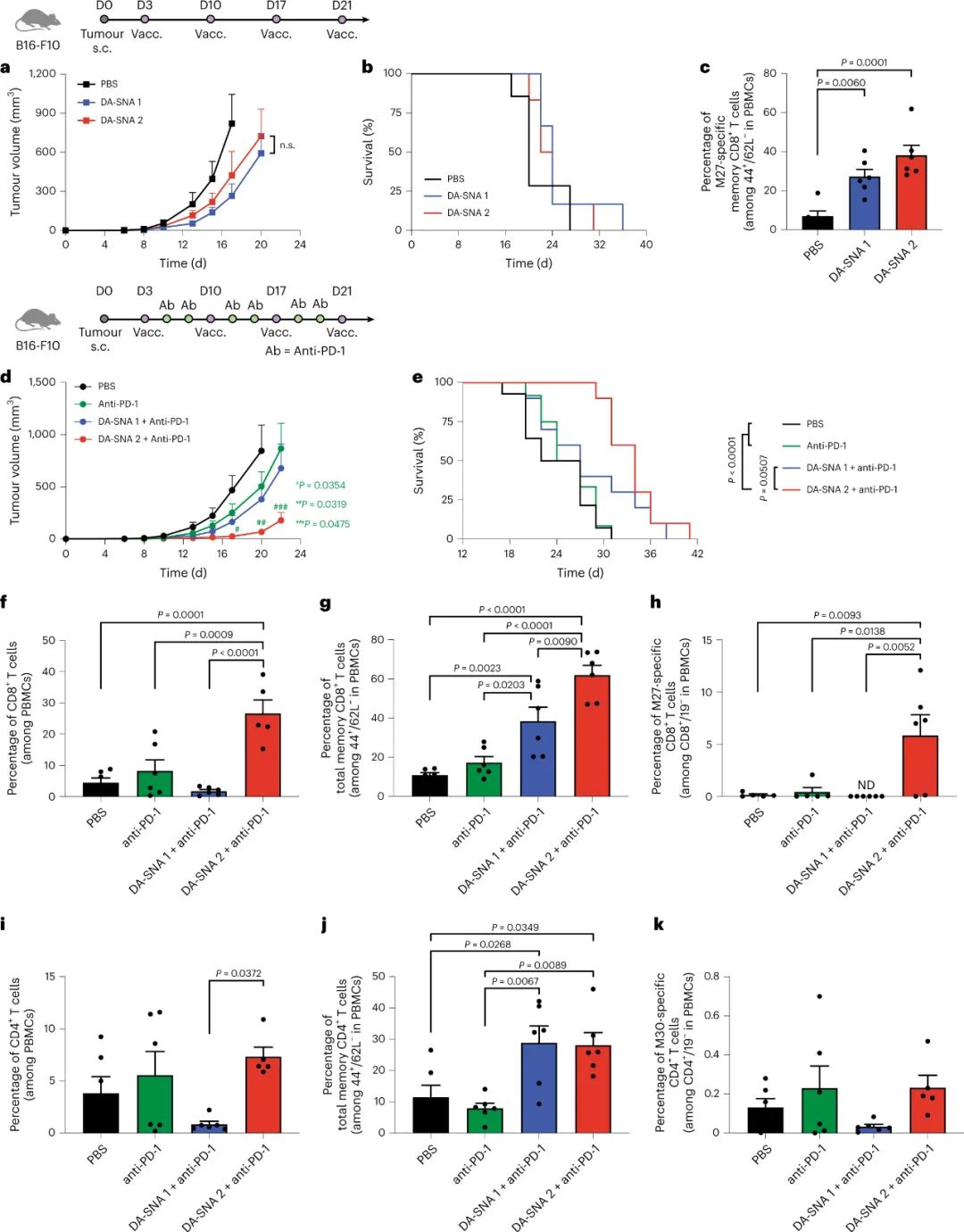
图|双抗原免疫疗法联合免疫检查点抑制剂的抑制作用
综上所述,该工作强调了在设计针对侵袭性癌症的模块化多面疫苗时放置抗原的重要性。研究数据表明,如果不考虑免疫细胞对其进行处理,即使是正确的靶点也可能产生无效的疫苗。此外,这项工作通过提供一个能够控制辅助性 T 细胞和细胞毒性 T 细胞激活时间的平台,将免疫学和纳米化学之间的基础知识联系起来。通过模块化架构(例如 SNA)实现合理的设计参数,可以大大提高疫苗效力。这些结构可用于快速配制针对新抗原靶点的癌症候选疫苗,并提高临床试验中现有抗原的效力。除了本文研究的抗原之外,还有许多其他类别的抗原可用于对抗肿瘤。事实上,扩展这种方法并分析各种其他抗原的结构意义是必要的,因为在这项工作中探索的加工途径对于对抗其他疾病也很重要。通过扩展这种方法并继续系统地评估影响疫苗成分运输的各种结构参数,本文旨在生成设计规则,使研究人员能够将所需的抗原呈递和信号分布与特定的纳米级结构相匹配。Teplensky, M.H., Evangelopoulos, M., Dittmar, J.W. et al. Multi-antigen spherical nucleic acid cancer vaccines. Nat. Biomed. Eng (2023).https://doi.org/10.1038/s41551-022-01000-2