病毒疫苗的开发在长久以来都被质疑着,面对着高突变性的病毒,花费大量人力物力是否值得?目前的流感疫苗主要诱导机体产生针对病毒免疫优势部分——血凝素(HA)的球状头部的抗体。然而,流感病毒不断发生抗原漂移,导致当前季节性流感疫苗的广度有限且有效性不足。同样的问题也出现在严重急性呼吸综合征冠状病毒2(SARS-CoV-2)中,诸多的变异株通常携带含有受体结合域(RBD)的刺突蛋白突变,使得新冠疫苗的有效性大大。因此,迫切需要开发具有广泛保护性的疫苗,以诱导针对多种病毒变异株的交叉反应性抗体产生。
近日,美国斯坦福大学的美国国家科学院院士Mark M. Davis率领其团队在Nature Materials上发表了一项关于病毒疫苗佐剂的工作成果。作者团队描述了一种Toll样受体7激动剂纳米颗粒(TLR7-NP)佐剂,其增强疫苗淋巴结靶向,并导致免疫细胞的持续激活和广泛的免疫反应。TLR7-NP/流感疫苗和TLR7-NP/SARS-CoV-2亚单位疫苗诱导了针对多种异源病毒变异的高水平交叉抗体反应。

TLR7-NP的设计与表征:
TLR7-NP由TLR7-PLA偶联物和PEG-PLGA自组装成制成。TLR7受体激动剂嘎德莫特(gardiquimod)通过可水解的酯键与PLA聚合物偶联构建TLR7-PLA。嘎德莫特负载量高达14.8 wt%,掺入效率接近100%。所得的TLR7-PLA流体动力学直径77 nm。从TLR7-NP释放的嘎德莫特的UV光谱与嘎德莫特初始光谱一致,即纳米粒子释放的嘎德莫特上未残留任何化学基团。嘎德莫特在中性环境下稳定释放,但在pH=5下,嘎德莫特出现爆发式释放。这可能是由于酸性环境下交联键水解速度增快有关,这对于TLR7-NP在免疫细胞内体/溶酶体中成功释药非常重要。
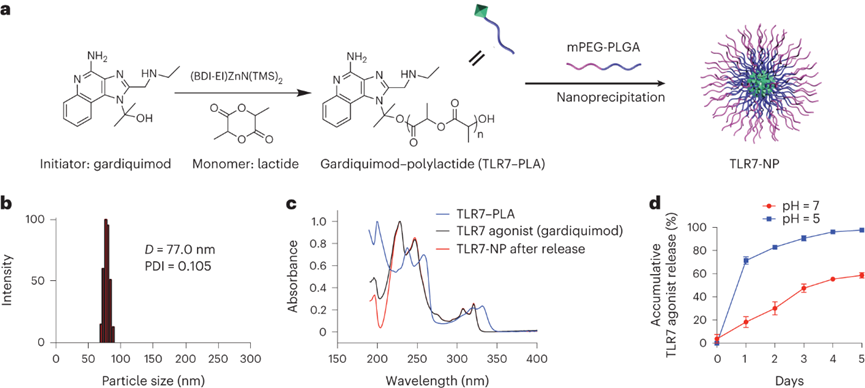
图 TLR7-NP的合成、配制和表征
淋巴结靶向和细胞内化:
进一步研究TLR7-NP对嘎德莫特体内递送的影响。将AF647标记的TLR7-NP或TLR7-明矾与鸡卵清蛋白(OVA)皮下注射到C57BL / 6小鼠的尾基部。TLR7-明矾在注射后仅1天迅速从注射部位清除,而TLR7-NP持续至少3天。与TLR7-明矾相比,TLR7-NP荧光在淋巴结(dLN)中持续存在,免疫后第1天增加22.9倍,第3天增加~10倍。这些结果表明,TLR7-NP优先靶向,并且在dLN中的保留时间比TLR7-明矾长得多。
与TLR7-明矾相比,TLR7-NP组dLNs中绝大多数APC对嘎德莫特的摄取增加5.5至27.8倍,持续至少3天。增强的细胞摄取与dLN中DC和单核细胞谱系细胞的增加和持续活化有关。TLR7-NP在免疫后2天积累在B细胞卵泡中的滤泡树突状细胞(FDC)网络周围。与此一致,TLR7-NP促进B细胞对嘎德莫特摄取并诱导持续的B细胞活化。与TLR7-明矾佐剂免疫相比,TLR7-NP免疫显著增加了共内化OVA抗原和嘎德莫特的B细胞百分比,证明了TLR7-NP在促进抗原特异性B细胞的TLR7活化方面优于TLR7-明矾。
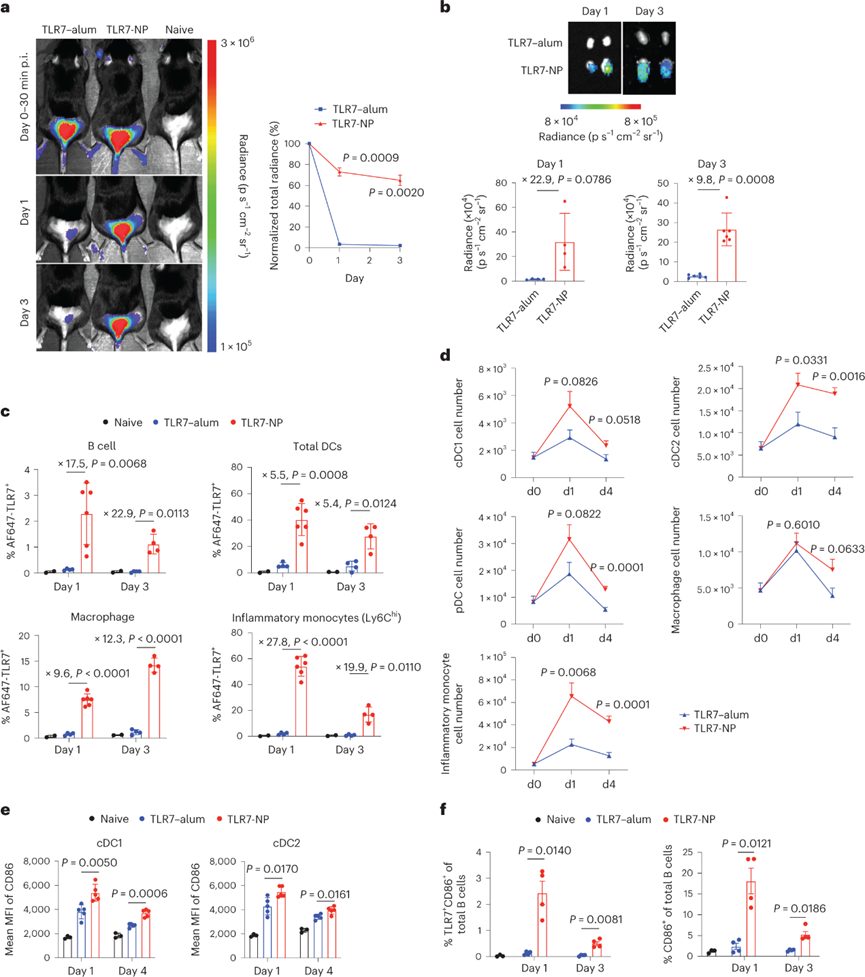
图 TLR7-NP改善嘎德莫特体内性能并诱导淋巴结中抗原呈递细胞持续活化
体液免疫与抗原特异性 CD8+ T 细胞应答:
TLR7-NP增强并持续激活先天免疫细胞和B细胞,这在很大程度上取决于生发中心(GC)的反应。与TLR7-明矾相比,TLR7-NP佐剂抗原免疫诱导dLN中GC B细胞反应水平惊人的升高。与GC B细胞动力学一致,滤泡外CXCR5+ PD1+CD4+ T细胞在TLR7-NP免疫小鼠中也高度扩增。这些滤泡性CD4 T细胞含有T滤泡辅助细胞(Tfh)和T滤泡调节细胞(Tfr)。Tfh 为 GC B 细胞提供协助,而 Tfr 抑制 GC 反应,而TLR7-NP免疫小鼠中Tfr百分比明显低于TLR7-明矾免疫小鼠。除此之外,TLR7-NP还可以促进滤泡外B细胞反应,早期浆母细胞的数量显着增加。用TLR7-NP免疫的小鼠,可以在免疫后第14天产生针对OVA次显性表位的高水平抗体,这表明免疫优势的变化。
TLR7-NP有效地诱导了常规1型树突状细胞(cDC1)的持续动员和活化,这对于交叉启动CD8 T细胞至关重要。TLR7-NP佐剂疫苗在免疫后第4天显著诱导抗原特异性CD8+ T细胞(CD69hi SIINFEKEL+),并在第7天显着增加了CD44hi CD62Llow效应记忆CD8+ T细胞(Tem)。与TLR7-明矾相比, TLR7-NP可以诱导小鼠肺部免疫上调的功能性颗粒酶生成(Gzmb+ )CD8+ T细胞,在免疫后第21天肺组织驻留的Gzmb+ CD8+ T细胞显着增加。总之,TLR7-NP在诱导有效的CD8+ T细胞反应方面优于TLR-明矾,其在杀死病原体感染细胞以控制病毒复制方面起着至关重要的作用。
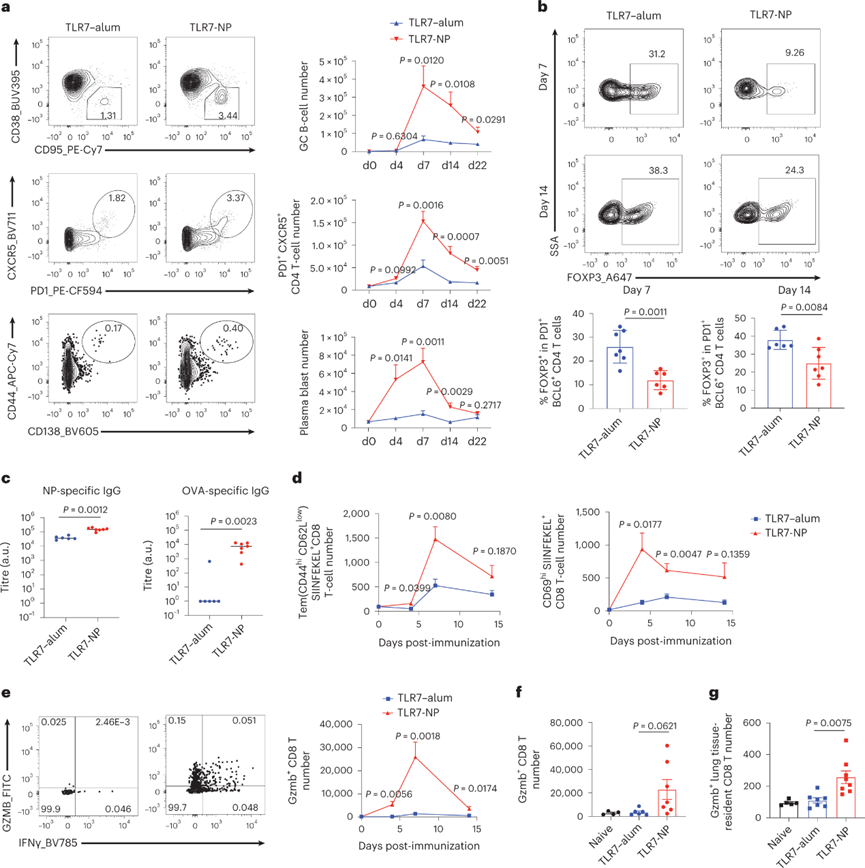
图 TLR7-NP增强体液免疫和CD8+ T细胞反应
血凝素杆状结构特异性抗体反应与交叉反应:
与血凝素(HA)的免疫显性但高度可变的球状头部结构域相比,其杆状基底部机构域的亚显性表位更保守,并有可能产生交叉反应性免疫应答。TLR7-NP在促进GC反应和增加Tfh/Tfr比率方面的有效作用,表明其有可能支持GC中产生更多样化的B细胞克隆,以增加针对流感HA的抗体反应的广度。TLR7-NP在免疫后10天诱导了更多的GC激活。用免疫流感毒株A/Hong Kong/1/1968(HK68)进行验证。TLR7-NP不仅提高了对HK68的H3 HA抗体滴度,还提高了另一种H3N2毒株A/Hong Kong/4801/2014(HK14)的HA抗体滴度。接种TLR7-NP佐剂HK68 HA的小鼠中有80%在第2周产生了来自H7N9 A/Shanghai/02/2013(SH13)的HA抗体,这是一种来自不同亚型的高致病性流感病毒变体。相反,在用TLR7-明矾佐剂HA免疫的小鼠中无法检测到这些异型亚型抗体。平行实验使用来自H1N1 A / Puerto Rico/8(PR8)病毒的HA作为免疫原。与TLR7-明矾佐剂相比,TLR7-NP佐剂PR8 HA也引发了明显更高的跨亚型甚至跨组HA抗体水平。重要的是,TLR7-NP可以促进针对保守但次优势杆状基底部区域的抗体产生。伴随另一种菌株NC99 H1 HA的免疫原变化,TLR7-NP仍然能够增强针对杆状基底部区域以及异源PR8 HA的抗体反应。
为了评估TLR7-NP诱导对异源流感病毒的交叉保护的能力,使用致死剂量的PR8 H1N1病毒(异源菌株)感染小鼠。对增强的交叉反应性和异源病毒中和能力的观察,TLR7-NP可以保护小鼠免受异源病毒攻击并抑制体重减轻。接种TLR7-明矾佐剂NC99 HA的小鼠未能产生针对PR8 H1N1病毒的有效交叉保护,只有43.8%的小鼠在挑战中幸存下来。相比之下,接种TLR7-NP佐剂HA的小鼠中有92.9%在感染后完全康复。组织学分析进一步表明,TLR7-NP佐剂HA疫苗接种可以充分保护小鼠免受感染引起的肺损伤。
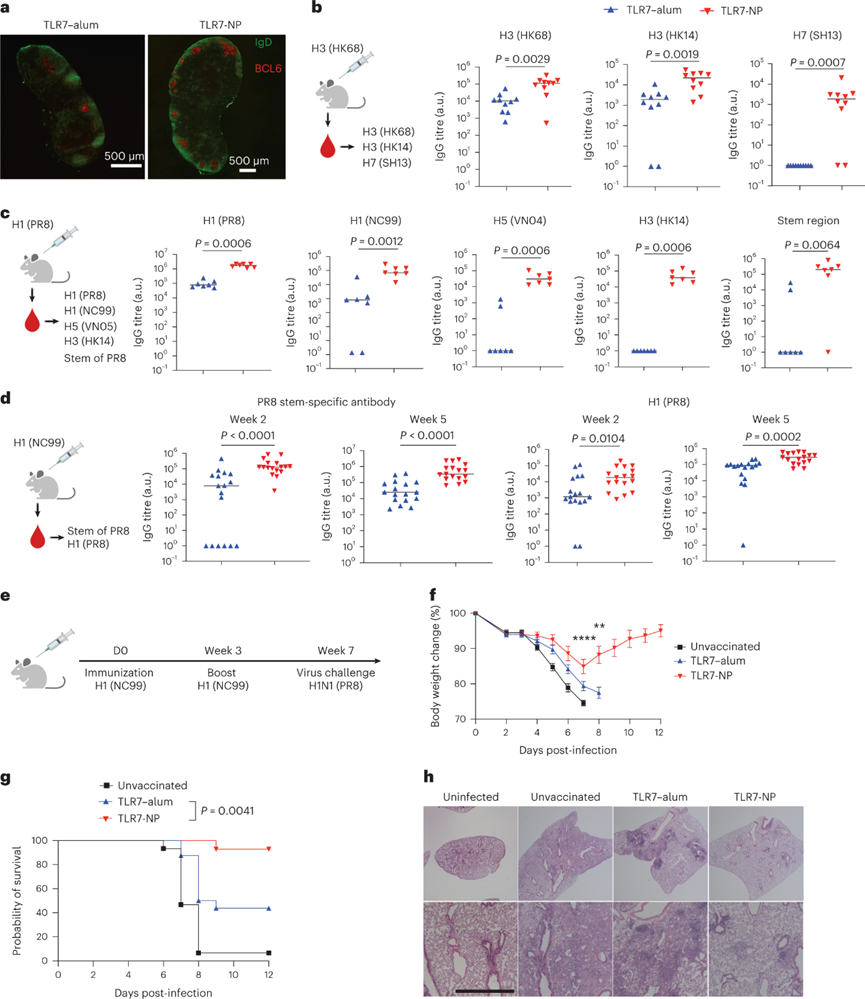
图 TLR7-NP佐剂HA免疫引发交叉反应抗体反应并保护小鼠免受致命的异源病毒攻击。
针对SARS-CoV-2变异株的交叉反应性抗体:
流感疫苗的成功促暗示TLR7-NP佐剂也可能有助于增加针对SARS-CoV-2变体的抗体反应范围。用野生型病毒的TLR7-明矾或TLR7-NP佐剂的SARS-CoV-2刺突蛋白免疫了C57BL / 6小鼠。两次免疫后,TLR7-NP佐剂刺突免疫的小鼠产生了高滴度的N501Y突变RBD抗体,γ(P.1)和Kappa(B.1.617)变体的RBD,以及Alpha(B.1.1.7)和Beta(B.1.351)变体的S1蛋白。而TLR7-明矾佐剂刺突蛋白免疫的小鼠仅仅产生较低抗体反应,对变异株也只产生了部分反应。对于两种高度传染性的Delta变体(B.1.617.2)和Omicron变体(B.1.1.529),TLR7-NP能够在77-89%的接种疫苗的小鼠中诱导针对其RBD结构域的高滴度抗体。
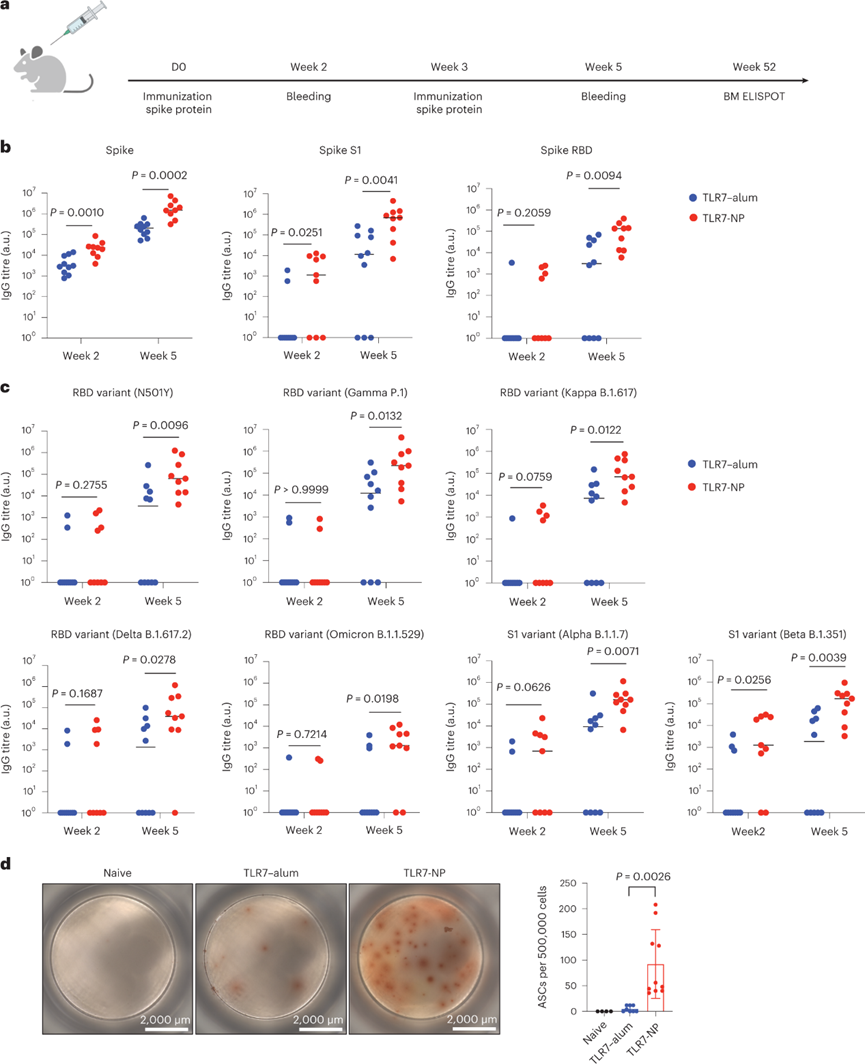
图 TLR7-NP佐剂SARS-CoV-2刺突免疫诱导针对多种病毒变异株的交叉反应抗体
人扁桃体类器官培养物中的B细胞反应:
为了进一步研究TLR7-NP佐剂的临床转化潜力,将其应用于人扁桃体类器官(TOS)培养物模型中。经过14天的培养,TLR7-NP佐剂刺突蛋白可以显着促进前GC B,GC B和浆母细胞分化,增强刺突蛋白特异性IgM和IgA抗体的产生。测试TLR7-NP佐剂与经过临床测试的亚单位疫苗SARS-CoV-2刺突蛋白RBD纳米颗粒(称为RBD-NP)的组合。单细胞RNA测序结构显示,与单独使用RBD-NP或无刺激相比,使用TLR7-NP佐剂RBD-NP刺激后4天,GC B细胞和浆母细胞的频率和数量显着增加。重要的是,TLR7-NP显着增加了TOS中IgM,IgA和IgG浆母细胞的形成,表明其对人B细胞的抗体同种型转换具有广泛影响。基因本体分析进一步表明,与病毒和1型干扰素反应相关的基因在TLR7-NP佐剂RBD-NP刺激的4天TOS中显著上调。
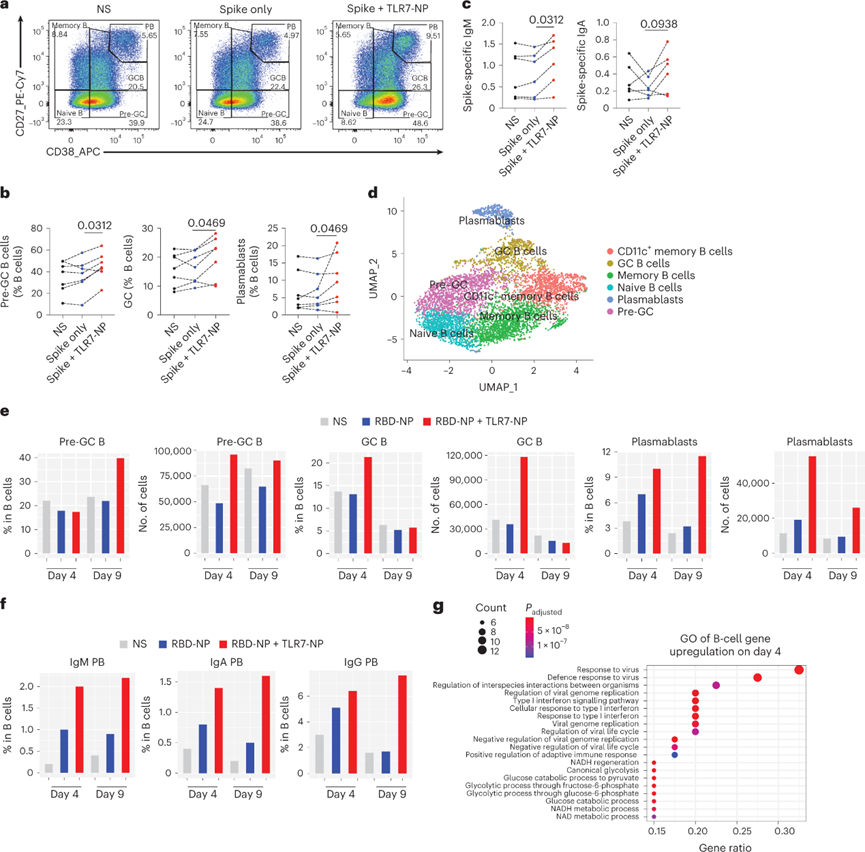
图 TLR7-NP佐剂的SARS-CoV-2刺突蛋白促进人扁桃体类器官培养物中的B细胞分化和抗体反应
小结:
作者团队报告了一种增强疫苗接种抗体反应广度和幅度的一般策略,通过调整佐剂的理化特性以促进疫苗淋巴结积累并产生更强和持久的刺激作用。该研究中提出的TLR7-NP佐剂不仅具有开发针对流感毒株或其他病毒的更有效疫苗的巨大潜力,而且还为了解免疫调节的复杂性提供了有用的工具。
B细胞反应中的免疫优势是由于GC中的少数显性克隆胜过的其他克隆,以产生长寿命记忆。因此诱导广泛抗体通常与克服免疫优势有关。虽然影响GC B细胞反应中免疫优势的因素尚不清楚,但先前的研究表明,表位可及性,前体频率,抗原亲和力,T细胞协助和先前的抗原暴露都会影响抗体免疫优势。TLR7-NP免疫的小鼠中Tfh / Tfr的比例显着增加可能会增强T细胞有助于促进GC中亚优势B细胞克隆的存活。此外,TLR7-NP可以靶向dLNs并增强B细胞对嘎德莫特的摄取,以促进B细胞活化和滤泡外浆母细胞反应。因此,TLR-NP可能会改善亚显性B细胞的募集以参与GC反应以促进GC克隆多样性。
尽管疫苗开发的努力通常集中在诱导有效的抗体反应上,但众所周知,体液和细胞免疫反应协同作用也可以增强免疫保护。值得注意的是,TLR7-NP产生有效的CD8+T细胞反应是疫苗中常用的明矾佐剂不能有效诱导的。这一特性可能促进针对细胞免疫反应的病原体(如疟疾、结核病和利什曼病)疫苗的开发。
参考文献:
Qian Yin, Wei Luo, Vamsee Mallajosyula, et al. A TLR7-nanoparticle adjuvant promotes a broad immune response against heterologous strains of influenza and SARS-CoV-2. Nat Mater. 2023 Jan 30.
https://www.nature.com/articles/s41563-022-01464-2











