特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。Li-O2电池的前景与挑战
基于Li2O形成和分解的锂-O2电池理论上可以提供更高的能量密度,有望成为有前景的一个储能研究方向。但Li2O涉及在放电过程中断开O2键,在充电过程中重新形成O2键,难以实现。而有足够的锂离子和电子供应,就可以像路径(I)(图1)中那样形成Li2O。其中一个关键的方面是LiO2/Li2O2相的初始形成,这两个组分都可以离子和电子导电,并且有一个空气界面作为O2的来源。该体系可以为Li2O的电化学形成提供所需的混合电子/离子传导特性,从而导致路径(I)中的整体四电子反应,并避免电解质不稳定。而实现这种锂-O2电池四电子反应的设想需要开发一种稳定且具有良好的离子导电性,与阴极界面良好的固态电解质(SSE)。而现有的以金属磷酸盐为基础的SSE具有相当低的可逆性和可循环性,并以Li2O2为主要产物,急需开发一种合适的SSE用于开发Li-O2电池。
解决方案
基于此,美国伊利诺伊理工学院Mohammad Asadi 和阿贡实验室Larry A. Curtiss等基于(i) SSE需要与PEO的分子结构相似,避免相分离; (ii) 在一定分子量范围内的高Li+转移数 ;(iii)合成SSE具有电化学稳定窗口和锂阳极稳定性的需求,在PEO-LiTFSI基质中与Li10GeP2S12 (LGPS)纳米颗粒化学结合,使用硅烷偶联剂mPEO-TMS{3-[methoxy(polyethyleneoxy)6-9 propyl]trimethoxysilane}合成目标SSE。论文以《A room temperature rechargeable Li2O-based lithium-air battery enabled by a solid electrolyte》题发表在Science上。

复合聚合物电解质(CPE)的物化和电化学表征
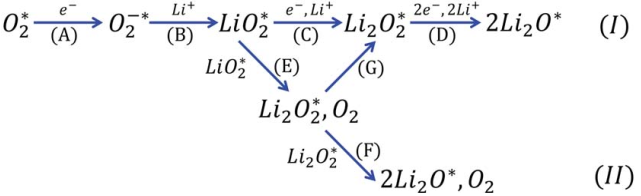
SSE合成过程中结合是由于O-H键和S-Li键之间的相似性。XPS(图2A-B)有力地证明了mPEO-TMS中的Si原子与LGPS中的S原子之间的相互作用以及PEO、mPEO-TMS、LGPS和LiTFSI的存在。SEM(图2C)显示SSE为平均孔径为~d=500 nm的多孔聚合物基质。EIS谱(图2D)表明SSE的离子电导率比没有LGPS的SSE高,合成的CPE的离子电导率比聚合物电解质高约15倍。电化学稳定性测试(图2E)显示CPE具有5.27 V的电化学氧化还原稳定窗口。SSE的Li转移数(图2F)CPE的Li转移数(tLi+)为0.73,比没有LGPS的SSE高约2倍,tLi+的增强归因于Li传输途径的改进:(i) PEO和mPEO-TMS的体聚合物基质,(ii) 体陶瓷部分(LGPS),及(iii) LGPS和mPEO-TMS之间新形成的界面相。
锂空气电池性能分析
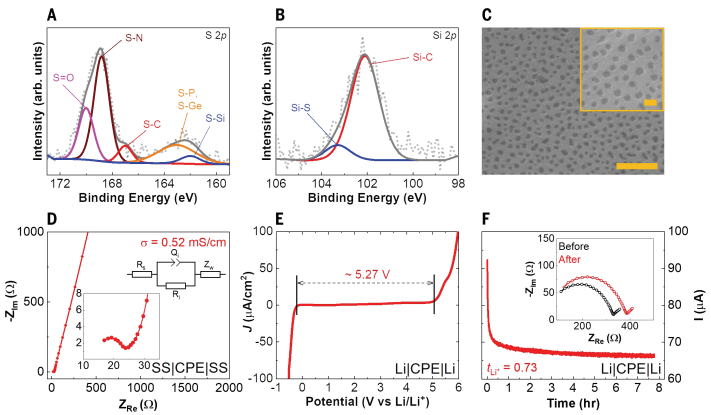
CPE的电化学性能在定制设计的锂空气电池中进行了测试。图3A显示了固态锂-空气电池单元超过1000次循环的运行情况,与第一次循环结束时的Li/Li+相比,充放电电位分别为2.95 V和2.90 V。循环充放电电压分布图(图3B)以及固态锂空气电池单元的库仑效率/能效/极化间隙变化(图3C)结果显示1000次循环的库仑效率为100%,极化间隙从第一次循环的50 mV增加到第1000次循环的~430 mV。第一次循环的能源效率为92.7%,1000次循环后逐渐下降到87.7%。不同速率下的速率能力检查表明,固态锂空气电池可以以更快的速率工作。
产品特性
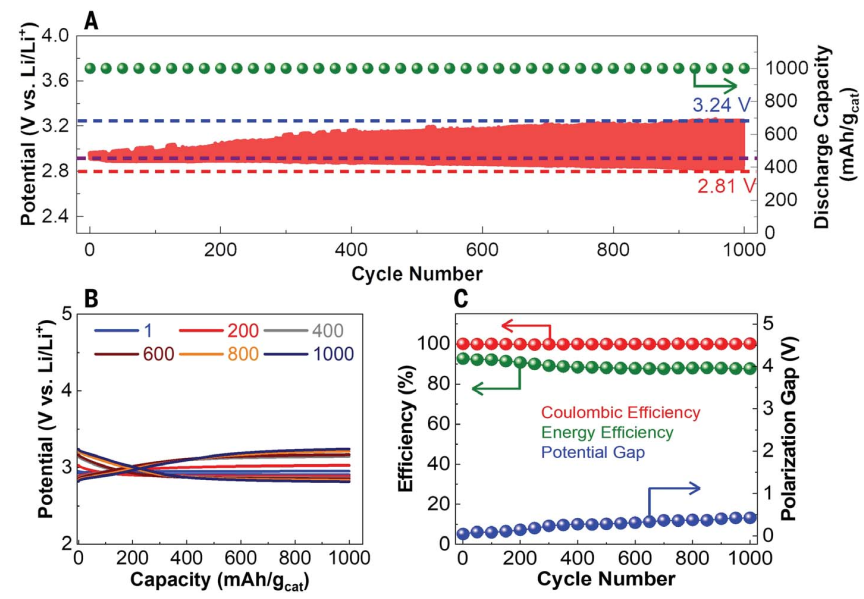
原位拉曼光谱实验进一步表征电池的化学性质,并识别放电产物。图4A显示在放电过程的前7.5 min后,出现了三个与LiO2、Li2O2和Li2O形成相关的新峰,表明所有这些物种都是在放电过程中形成的。比较了相对拉曼峰强度进一步了解放电过程中形成的Li物种之间的相互作用。放电1 h后,Li2O峰值强度不断增加(图4B)。相比Li2O2和LiO2峰值强度在初始时间间隔内逐渐增加,随后在放电过程的剩余时间内保持稳定。为了进一步量化放电过程中形成的产物,我们进行了滴定耦合紫外可见(UV-Vis)光谱实验,作为放电时间的函数。滴定结果(图4C)表明,在放电过程中,平均电子氧比(e-/O2)为3.96,这表明放电产物主要由Li2O组成,这是一个大约四电子转移的电化学反应。滴定实验中获得的测量的e-/O2比分别在放电和充电过程中通过进行原位和原位差分电化学质谱(DEMS)确认。非原位DEMS实验(图4C)发现放电过程中e-/O2比值为3.97,证实了在近四电子转移反应中放电产物为Li2O。充电过程原位DEMS实验(图4D)则表明固态锂空气电池单体的放电产物是可逆分解的,放电过程中没有LiOH和Li2CO3等物种的形成。XRD(图4E)没有发现Li2O2或LiO2峰,可能是因为: (i) 只有少量的沉积Li2O2和发现的LiO2紫外可见实验或(ii) 沉积物种非晶态。综上可以认定SSE电池倾向于近四电子反应化学,主要产物是Li2O的可逆形成和分解。
机理阐明
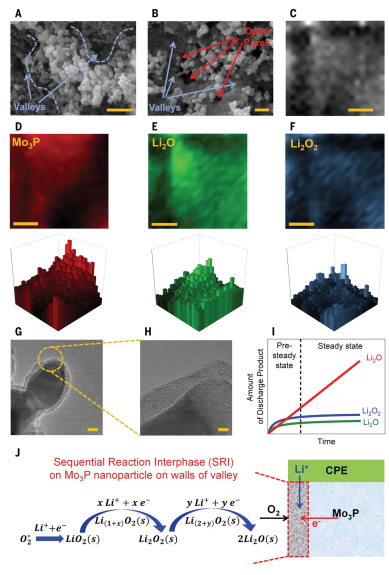
原始阴极和放电阴极(图5)的SEM显示了阴极结构“山谷”底部的放电产品(主要是Li2O2/LiO2/Li2O)。图5E-F可以看出Li2O和Li2O2分布在山谷和山谷两侧。放电产物的TEM图表明,Mo3P纳米颗粒具有10-20 nm厚的非晶态薄膜(图5G-H)。酸碱滴定结合UV-Vis显示Li2O2/LiO2/Li2O产物都开始增长,然后Li2O2和LiO2的量在~15 min后达到稳定状态。四电子Li2O反应在固态锂-空气电池中的优势取决于放电产物的离子和电子导电特性,结合电子源(Mo3P阴极),锂阳离子源(CPE/Li阳极)和O2(空气)的丰度。放电产物有两个生长阶段(图5I):预稳态和稳态。当LiO2/Li2O2在三相结处开始生长后,LiO2/Li2O2将继续生长。DFT)表明O2和LiO2表面上的绑定,这将使步骤A和B在反应(图1)。LiO2到Li2O2的后续反应是通过向LiO2中加入第二个电子和锂离子(图1 I-C)或可能通过LiO2的歧化(图1 II-E)发生的。在预稳态阶段(图5),除了LiO2和Li2O2增长, 在反应I中,最后两个电子/阳离子的添加也会形成Li2O,大约15 min后,LiO2和Li2O2达到稳定状态,由于过量的Li阳离子,Li2O继续增长。而Li2O2的歧化(图1 II-F)可能是Li2O2生成Li2O的机制之一。由于LiO2位于放电产物表面,它可以再生,同时成为Li2O2的形成源,而Li2O2也可以成为Li2O的形成源(图1,II-D)。
研究开发了一种适用于锂空气电池中的高效SSE,可以实现可以在室温空气中以低极化间隙、高速率进行1000次可逆四电子Li2O反应。该固态锂-空气电池单元的工作容量可达~10.4 mAh/cm2,比能量为~685 Wh/kgcell,电池的体积能量密度为~614 Wh/Lcell。该研究为开发>1 kWh/kg(体积能量密度为1000 Wh/L)的锂电池提供了可能。https://www.science.org/doi/10.1126/science.abq1347Alireza Kondori et al. A room temperature rechargeable Li2O-based lithium-air battery enabled by a solid electrolyte.Science 379, 499–505 (2023).DOI:10.1126/science.abq1347












