我国中医历来有着以毒攻毒的治疗理念,即通过辨证对于因毒邪引起的疾病, 应用有毒药物进行治疗以消除毒邪。那从事医学研究的各位,可曾有过一念利用病原体来“以毒攻毒”呢?其实细菌治疗的概念早在就被提出,但选取合适的细菌攻击感染细菌一直是个难题。细菌治疗的应用部位是影响菌种选择的主要因素。理想情况下,所选细菌应自然存在于要治疗的器官中,以确保其存活并限制扩散到其他器官。例如,大肠杆菌Nissle 1917菌株被设计用于治疗肠道中的铜绿假单胞菌感染,但它不能用于治疗呼吸道感染。
而肺部感染,优先想到的就是肺炎支原体为代表的肺部相关菌属。与其他肺部致病菌相比,肺炎支原体在治疗肺部感染方面具有以下优点:(1)基因组小易于改造;(2)可以用现有的抗生素消除;(3)缺乏细胞壁,它不会引发强烈的炎症反应;(4)其主要抗原和毒力因子特征明确;(5)肺炎支原体菌株的重组率可以忽略不计,从而降低了突变风险;(6)它可以在合成的无血清培养基中生长,适合工业化生产。
近日,西班牙巴塞罗那科学技术研究所Luis Serrano与Maria Lluch-Senar教授领其团队在Nature Biotechnology上发表了一项关于工程化的减毒型肺炎支原体M129菌株用于治疗/预防由铜绿假单胞菌引起的感染性肺部疾病的工作。这是一种治疗肺部感染的新方式,通过转位将四个转基因引入工程菌染色体中,以实现杀菌和生物膜降解活性。该工程菌株在小鼠模型中对急性铜绿假单胞菌肺部感染具有优异的疗效。具体机制即工程菌溶解呼吸机相关性肺炎患者气管插管中形成的细菌生物膜,伴随使用靶向肽聚糖层的抗生素以提高对革兰氏阳性/阴性细菌的疗效。

肺炎支原体菌株的选择:
肺炎支原体野生型(WT)菌株在肺部14d左右被清除。通过去除致病基因来改进的肺炎支原体菌株。以下基因被认为是肺炎支原体发病机制的原因:编码社区获得性呼吸窘迫综合征毒素的mpn372; 编码具有细胞毒性核酸酶活性的脂蛋白的MPN133; 编码P30粘附蛋白的mpn453和编码甘油-3-磷酸脱氢酶/氧化酶的 mpn051。此外,在乳腺感染模型中,缺失mpn372和mpn133基因的肺炎支原体菌株(CV2菌株)在感染减弱。与WT菌株相比,mpn453缺失菌株在小鼠肺中形成集落显着减少,这表明附着在上皮上对于维持肺中的肺炎支原体至关重要。因此,作为工程菌在肺清除和驻留之间的折衷,选择了敲除mpn453和mpn051的CV2菌株作为肺部治疗的载体,即该菌株缺失mpn372、mpn133、mpn453和mpn051基因。在2、4和14 d下CV2菌株的细菌计数与WT相似,表明mpn372和mpn133基因的缺失不会影响CV2在肺定植的能力。
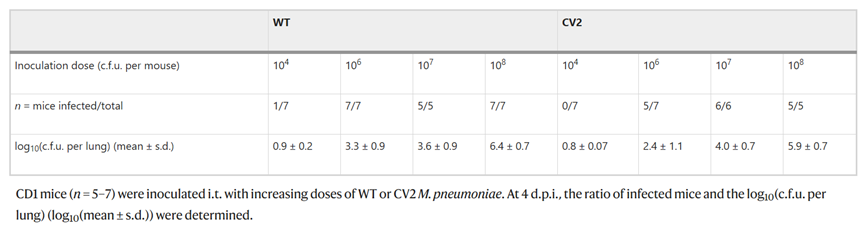
表 WT或CV2肺炎支原体肺部感染的菌落计数
CV2菌株诱导的肺部病变和炎症反应:
进一步比较CV2和WT菌株诱导的感染反应,使用五个参数通过对三个主要肺叶的组织病理学分析来评估肺部病变:(1)支气管周围/支气管周围炎症浸润;(2)支气管周围/支气管周围炎性浸润强度;(3)支气管/细支气管管腔渗出物强度;(4)血管周围炎症浸润;(5)间质性肺炎强度。基于这些参数,构成总分26分的肺部病变评价指标。在2d时,总分表明CV2小鼠的病变与WT感染组相比明显较轻,支气管和血管周围炎症较少,间质炎症也明显减少。在14d时,CV2组与PBS对照组相比没有显着差异,而WT组有残余的支气管、血管周围和间质炎症相关的组织损伤。在45d,分析表明CV2和WT给药组的肺部病变均消退。综上所述,与WT 肺炎支原体菌株相比,CV2在肺部的毒性减弱,这强调它是作为治疗呼吸系统疾病载体的有力候选者。
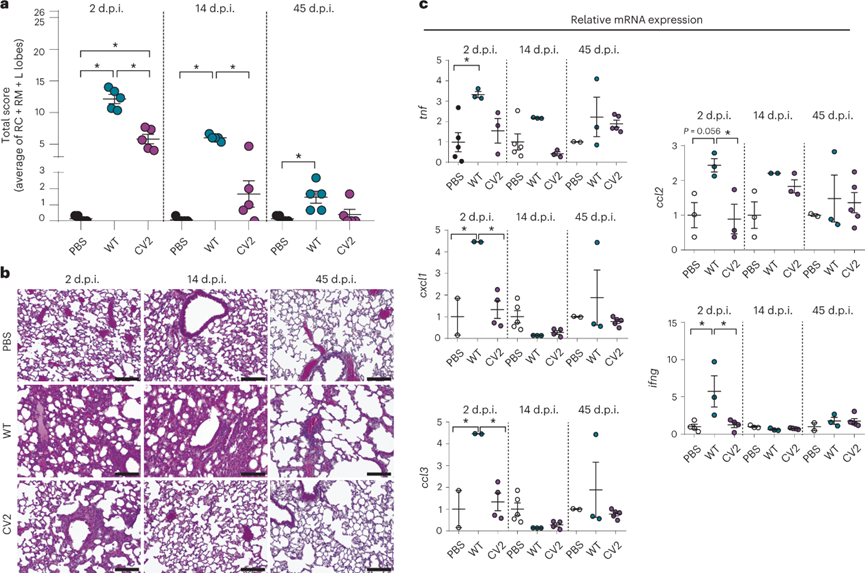
图 感染肺炎支原体WT和CV2菌株的肺部组织病变和炎症反应
使CV2溶解铜绿假单胞菌生物膜:
铜绿假单胞菌生物膜是引起VAP的主要致病菌之一。由于铜绿假单胞菌生物膜主要由多糖Pel,PsI和藻酸盐组成,使用表达靶向这三种多糖的三种不同酶的基因盒设计了WT菌株,期以可以降级生物膜。通过将糖苷水解酶PelAh64和 PslGh55和A1-II′ 海藻酸裂解酶融合到分泌肽(MPN142_OPT)上,构建CV2_HA工程菌株。这种三种酶组合设计的肺炎支原体菌株对铜绿假单胞菌菌株SAT290和PAO1形成的生物膜表现出优秀溶解效应。在一组临床获取铜绿假单胞菌菌株中也证实了CV2_HA的抗生物膜活性。
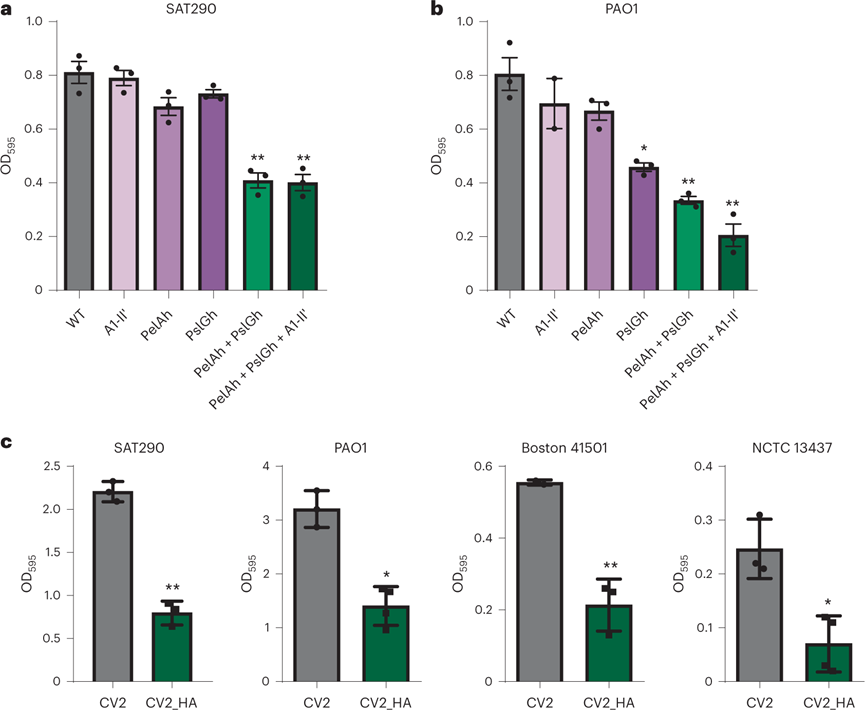
图 肺炎支原体菌株的生物膜溶解活性
CV2_HA中引入抗菌活性:
治疗VAP的理想工程菌在结合生物膜溶解活性的基础上还要实现抗菌。为了引入抗菌活性,设计了表达细菌素pyocin L1的CV2_HA(CV2_HA_P1),pyocin L1先前已被证明能杀死铜绿假单胞菌菌株。在确保改造后的工程菌依旧保留生物膜溶解活性后,验证其抗菌能力。CV2_HA_P1抑制了PAO1菌株的生长,对NCTC13437和BAA-2113菌株表现出中等抗菌活性,但对波士顿41501菌株没有作用。为了使抗菌谱多样化,进一步促使表达pyocin S5,以补全对铜绿假单胞菌波士顿菌株的生长抑制。
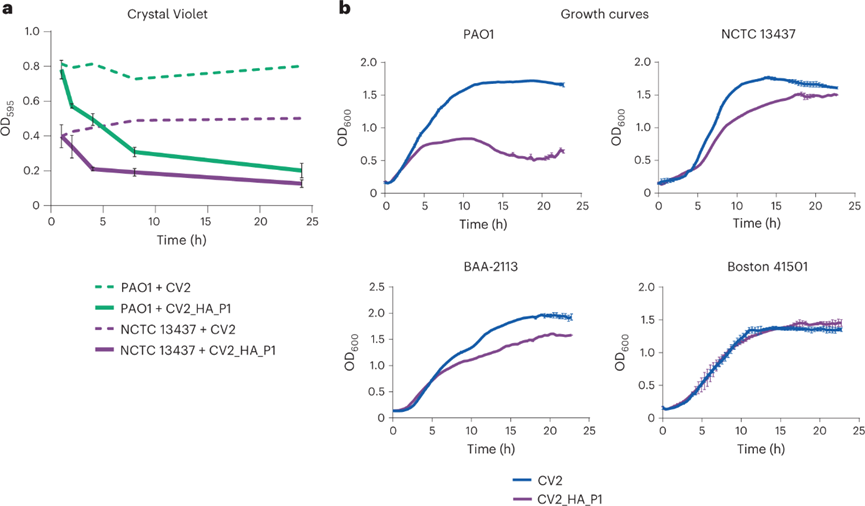
CV2_HA_P1对VAP患者气管插管的影响:
由于肺炎支原体缺乏细胞壁,推测它可以与针对细菌细胞壁肽聚糖的抗生素结合使用。评估临床常用抗生素对肺炎支原体和不同铜绿假单胞菌菌株生长的影响。正如预期的那样,针对细胞壁的抗生素难以杀死CV2_HA菌株,而所有抗生素对大多数铜绿假单胞菌菌株都有活性。值得注意的是,尽管抗生素没有显著溶解铜绿假单胞菌生物膜,但与CV2_HA_P1菌株一起孵育可有效溶解生物膜。
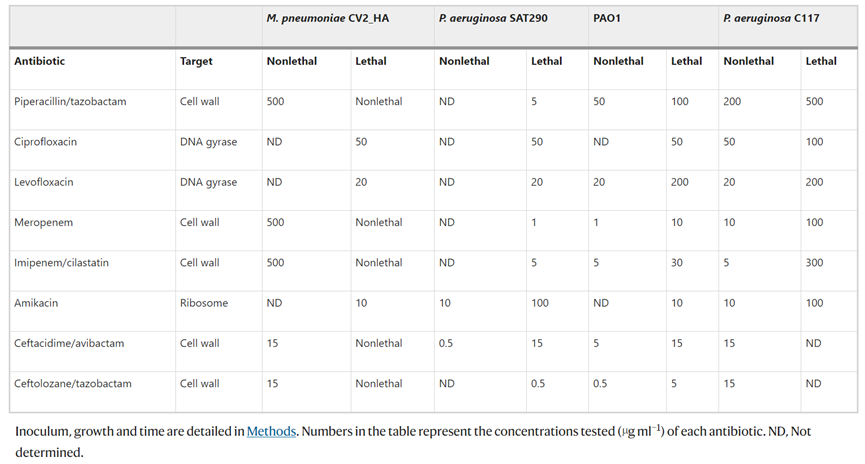
表 肺炎支原体和不同铜绿假单胞菌菌株对不同抗生素的敏感性
对ICU接受机械通气的VAP患者的ETT切片进行处理,以评价工程菌对临床铜绿假单胞菌作用效果。ETTs中的铜绿假单胞菌菌株(代表性)对美罗培南(100%)、亚胺培南(100%)、氨曲南(100%)、阿米卡星(66%)和环丙沙星(33%)具有耐药性,但对粘菌素、哌拉西林/他唑巴坦、妥布霉素和头孢他啶敏感。孵育24小时后,铜绿假单胞菌负荷在对照组和处理组之间显示出显着差异:用抗生素与CV2_HA_P1处理的ETT均降低了负荷,而联合使用时这种减少更显著甚至完全杀灭了细菌。这些结果表明,CV2_HA_P1对不同多重耐药铜绿假单胞菌临床菌株形成的生物膜具有广谱活性。
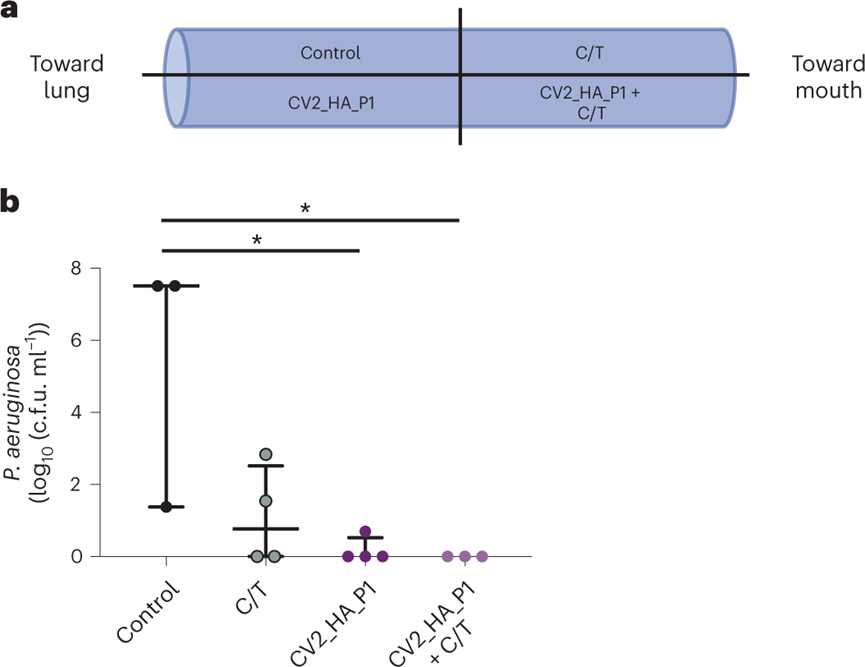
图 VAP患者ETT生物膜的溶解
CV2_HA_P1在鼠肺感染模型中的疗效:
使用PAO1建立小鼠急性肺部感染模型。每只小鼠接种1×103 c.f.u.的PAO1,并在接种后2 h给予CV2_HA_P1、CV2 或 PBS。在肺部检测到CV2和CV2_HA_P1菌落形成,表明工程菌可以在致病细菌菌落优势下定植于肺部。PBS对照中PAO1的平均负荷为1×106 c.f.u./每克肺组织,用CV2_HA_P1 1×108处理的小鼠,肺部PAO1负荷显著降低,而CV2在任何时候都没有显著降低肺部的PAO1负担。肺部的组织病理学变化与PAO1负荷的减少一致,接受CV2_HA_P1治疗的小鼠肺部肺部病变的总分显着降低,血管周围炎症较少,实质肺炎明显减少。与CV2组相比,CV2_HA_P1小鼠肺部的炎症标志物也减少。CV2_HA_P1治疗减少了急性肺炎体内模型中的PAO1肺部感染。大约50%感染PAO1并接受CV2_HA_P1治疗的小鼠存活至8d,而用CV2或PBS对照治疗的小鼠的中位存活率为2d。此外,存活到8d时间点的PAO1感染小鼠的组织学显示,CV2_HA_P1组的肺改变明显少于CV2或PBS对照组。CV2_HA_P1治疗减少了PAO1肺部感染并提高了小鼠存活率。
使用工程菌和PAO1混合物接种小鼠以研究CV2_HA_P1对铜绿假单胞菌感染的预防能力。1×107CV2_HA_P1治疗小鼠肺部的PAO1集落形成单位相比WT_HA_P1组和未处理组显著减少。工程化的肺炎支原体菌株CV2_HA_P1在小鼠模型中有效预防急性PAO1感染。
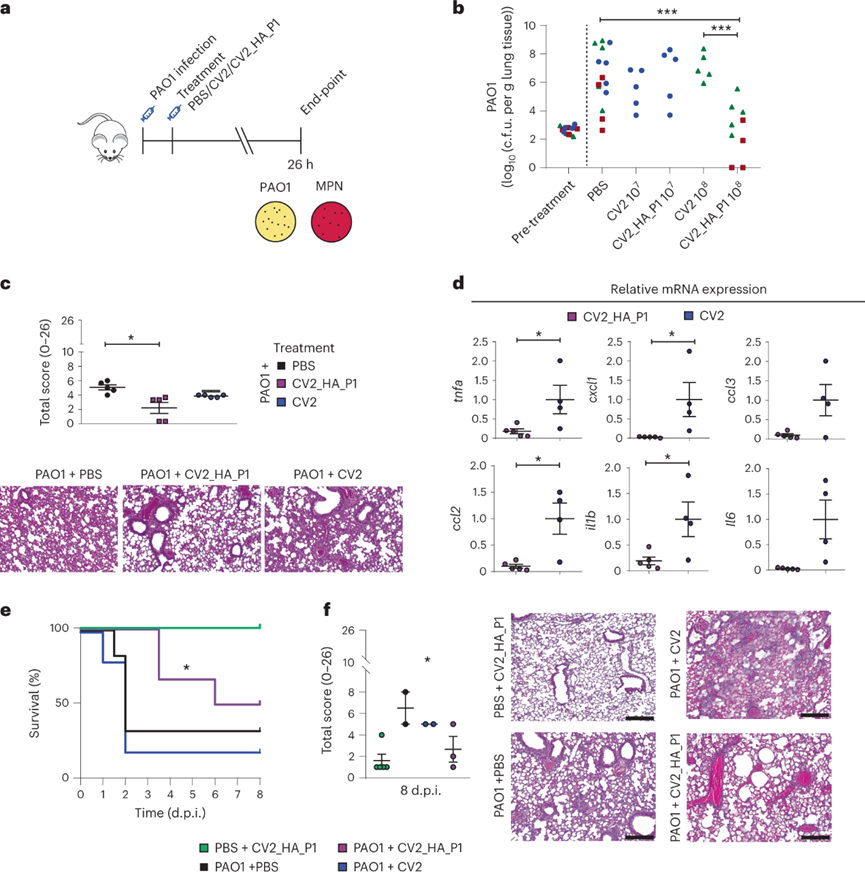
图 TLR7-NP佐剂SARS-CoV-2刺突免疫诱导针对多种病毒变异株的交叉反应抗体
小结:
肺部感染现在仍然是人类死亡的主要原因之一。本研究采用肺炎支原体治疗肺部细菌感染,实现了“以菌治菌”的概念。同归属于病原菌的工程菌载体,天然可以靶向肺部易于细菌感染的脆弱部位,同时实现感染部位的定植,实现长时间的分泌抗菌物质实现治疗效果。但这一理念的困境在于工程载体自身的毒性,难以保证安全性。作者团队通过前置研究筛选出野生型肺炎支原体中的关键致病蛋白表达基因,在天然的低致病性肺炎支原体亚型(CV2)的基础上改造。在成功降低了其致病毒性的同时,保留了其驻留肺部组织的能力。
在这种改造后的低毒性肺炎支原体工程菌株的基础上进一步改造,可以有效拓展其应用场景。针对铜绿假单胞菌细胞壁的多糖与海藻酸盐成分,作者团队引入并促使工程菌表达糖苷水解酶PelAh64和 PslGh55和A1-II′ 海藻酸裂解酶,实现了铜绿假单胞菌生物膜的溶解。结合生物膜溶解和抗菌活性来协同治疗肺部耐药菌治疗,作者团队进一步设计了肺炎支原体来表达活性pyocin L1和pyocin S5。两种pyocins均对目标菌株具有抗菌活性和特异性。最终构建的CV2_HA_P1工程菌株肺部显示出对体内铜绿假单胞菌生物膜的治疗与预防作用,也可用于治疗与其他细菌生物膜形成相关的呼吸系统疾病。该工程菌还可以补强标准护理抗生素的疗效,CV2_HA_P1成功降解生物膜后有效促进了这些抗生素直接作用于耐药菌菌体,这为协同组合开辟了道路。
参考文献:
Rocco Mazzolini, Irene Rodríguez-Arce, Laia Fernández-Barat, et al. Engineered live bacteria suppress Pseudomonas aeruginosa infection in mouse lung and dissolve endotracheal-tube biofilms. Nat Biotechnol. 2023 Jan 19.
https://www.nature.com/articles/s41587-022-01584-9











