化学发光是一种通过化学反应将化学能转化为光能的发光机制。由于避免了外部激发光以及自身荧光的干扰,化学发光成像大大的提高了组织穿透深度以及成像分辨率,逐渐成为体内炎症以及肿瘤微环境检测等的重要手段。然而,传统的有机小分子化学发光探针其发射的波长主要集中在400-650 nm范围,位于该波段的光子在组织中存在严重的光散射和信号吸收,大大降低了活体成像的组织穿透深度以及成像背景比。近年来研究人员发现位于近红外二区(NIR-II, 950-1700 nm)的光信号在组织中的散射和吸收程度大大减少,具有较深的组织穿透深度以及较高的空间分辨率。
所以,如何开发出长波段发射的小分子化学发光探针,以及提高其发射强度是一个急需突破的壁垒。为此,宋继彬教授团队首次设计开发了一种基于Schaap’sdioxetane结构的具有长波长发射的小分子化学发光探针(CD-950),以用于体内硫化氢(H2S)特异性响应成像。
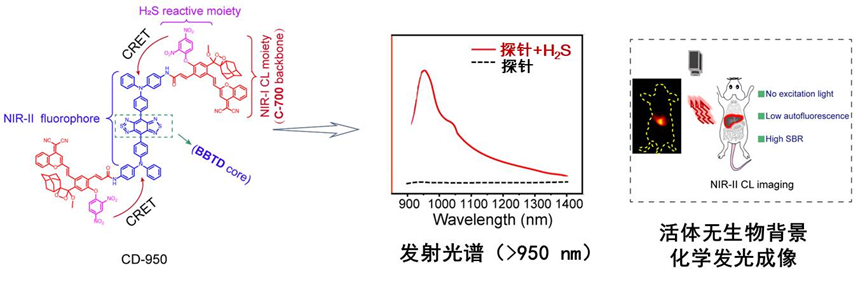
作者首先利用化学发光共振能量转移(CRET)的方式(图A)将两个700 nm 发射的化学发光给体(衍生后的Schaap’sdioxetane 结构)通过共价键连接在一个长波长发射的荧光团(> 950 nm)的两侧,构建了一个硫化氢响应后最强发射在950 nm的单分子化学发光探针(图B)。结合实验数据和理论计算结果,证实了该能量转换效率的可行性以及高效性(95%)。此外,利用该探针可以特异性对小鼠炎症模型中肝脏部位的H2S进行NIR-II化学发光成像分析,证实了长波长化学发光相较于荧光成像具有更高的信噪比(提高了5倍)成像时间(>1 h)(图C)。
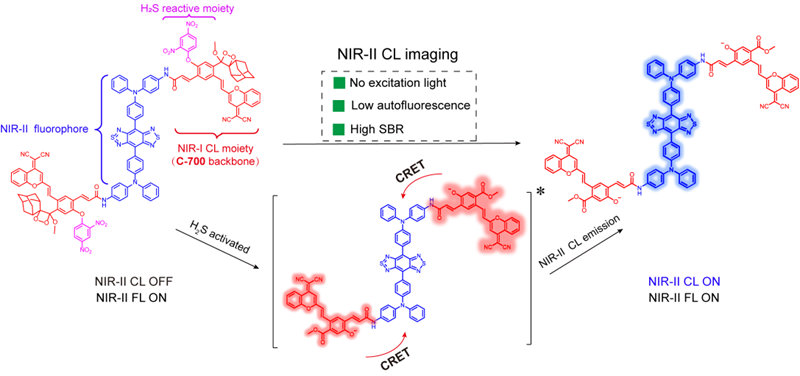

该研究成果为长波长化学发光分子探针的设计及活体分子精准成像和测量提供了一种新的思路。
相关论文以“Design and Synthesis of a Small Molecular NIR-IIChemiluminescence Probe for In Vivo Activated H2S Imaging”为题,在线发表于Proceedings of the National Academy of Sciences(PNAS)。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2205186120











