髓母细胞瘤是小脑实体恶性肿瘤的一种,是最常见的小儿脑肿瘤。四种髓母细胞瘤亚型中的三种表现出完整的功能性血脑屏障。血脑屏障是一个受到严格调控的神经血管单元,由连续的内皮细胞层组成,在细胞-细胞界面、周细胞和星形胶质细胞端足处具有紧密连接蛋白,它们共同维持正常的脑功能和体内平衡。这个神经血管单元创造了一个生物屏障,限制了质量运输和药物向大脑的有效输送。为了安全有效地治疗脑肿瘤,例如髓母细胞瘤,需要新的药物输送技术来克服血脑屏障。当前的临床挑战是将肿瘤治疗药物有效地输送到大脑中。血脑屏障极大地限制了到达大脑的药物量,导致治疗效果降低和在健康组织和器官中脱靶药物积累,这会引起严重的毒性相关副作用。解决这一递送挑战是正在进行的临床前和临床研究的主要焦点,这些研究使用:(1)分子策略,例如受体介导的转胞吞作用、载体介导的转胞吞作用或扩散和细胞旁路转运;(2) 物理和化学策略,如聚焦超声与微泡、纳米粒子或渗透传递;(3) 基于细胞和病毒的策略,例如免疫和干细胞递送,或腺病毒介导的基因疗法。然而,这些新兴战略仍需进一步发展,迫切需要更具体、更高效的递送方式。一种有前途的方法是内皮转胞吞作用,将抗癌纳米药物输送到大脑中。近日,斯隆—凯特林癌症研究所Daniel A. Heller、G. Praveen Raju等人在 Nature Materials 上描述了褐藻糖胶(fucoidan)纳米颗粒通过内皮细胞跨细胞机制,即通过触发纳米颗粒在血脑屏障这些细胞内部的运输,有效地将癌症药物维莫德吉(vismodegib)输送到髓母细胞瘤组织。

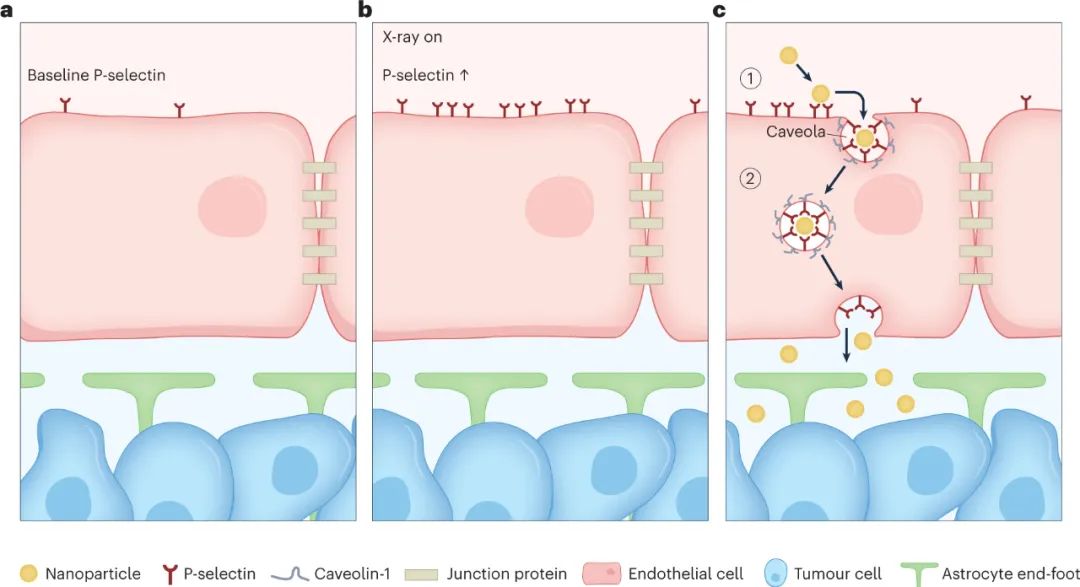
在对超声刺猬髓母细胞瘤小鼠模型进行给药后,纳米颗粒与 P-选择素结合,P-选择素是一种细胞表面受体,其在肿瘤相关内皮细胞上的表达先前已通过 X 射线照射得到增强。纳米颗粒通过褐藻糖胶与 P-选择素受体结合,触发转胞吞作用过程,导致载药纳米颗粒从肿瘤内皮细胞腔内转运至肿瘤内皮腔外侧,从而使vismodegib能够更有效地输送到髓母细胞瘤肿瘤。内皮细胞在报道的递送策略中起着核心作用,因为这些细胞表达 P-选择素受体,并通过转胞吞作用进一步主动将纳米颗粒转运穿过肿瘤内皮细胞。其他细胞表面受体已在文献中报道,用于大脑中基于转胞吞作用的药物递送应用。例如包括转铁蛋白受体、胰岛素受体、低密度脂蛋白受体 (LDLR) 和 LDLR 相关蛋白1 受体。然而,这些受体无处不在,导致外周和脱靶递送,从而损害治疗的安全性和有效性。肿瘤相关内皮细胞上高水平的特异性受体表达对于最大限度地减少脱靶递送和毒性至关重要。研究人员将 P-选择素鉴定为激活的脑肿瘤相关内皮细胞上的候选受体。P-选择素是一种细胞粘附分子,可与循环白细胞上的 P-选择素糖蛋白配体-1 结合,将它们募集到发炎部位。P-选择素进一步结合多糖,如硫酸乙酰肝素和褐藻糖胶。P-选择素表面受体的表达发生在受炎症细胞因子或辐射刺激的活化内皮细胞上。研究人员通过X射线照射增强了肿瘤相关内皮细胞中P-选择素的表达,同时保留了邻近的健康脑组织。所证明的辐射治疗提供了对P-选择素表达的时空控制。
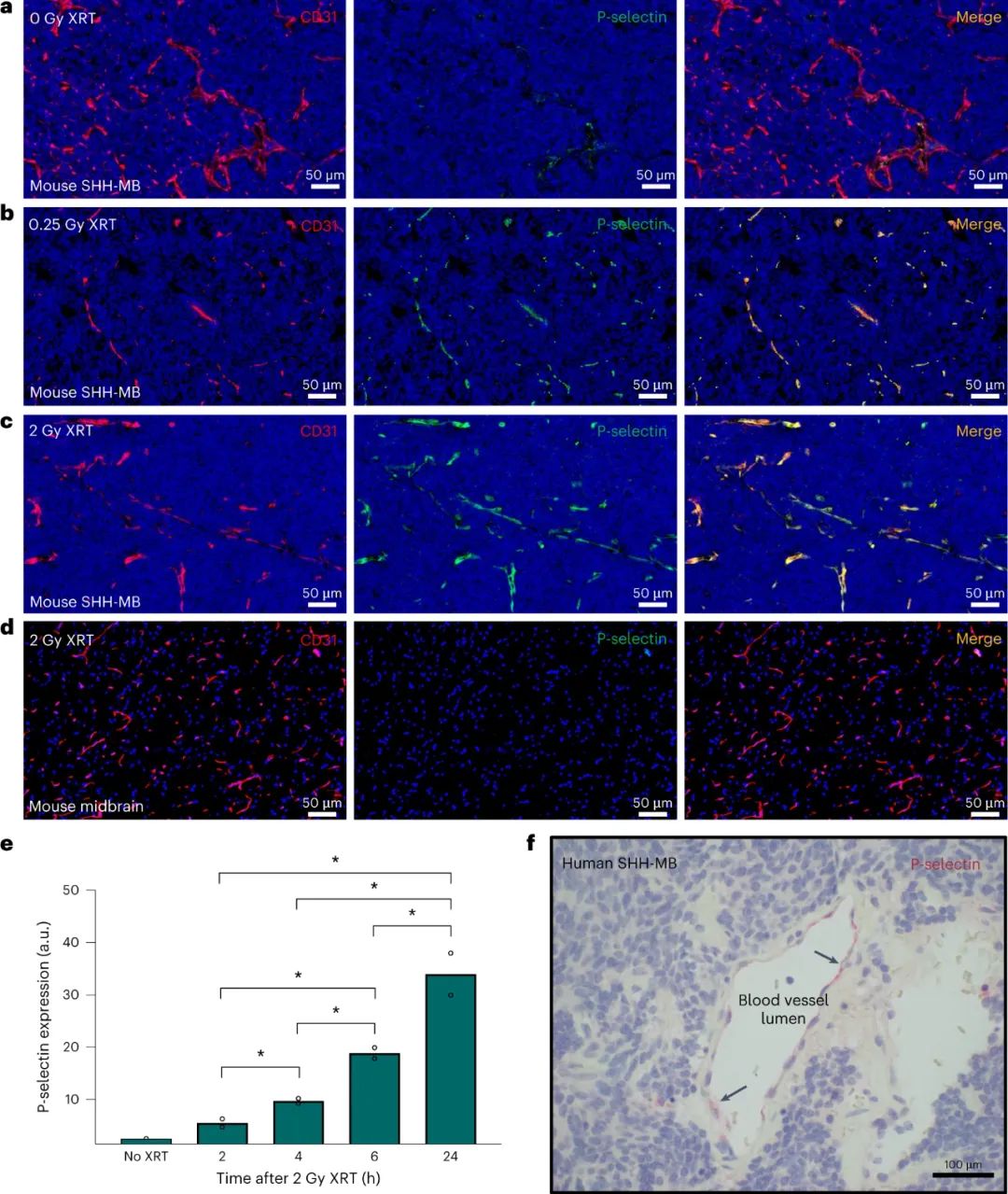
图|低剂量照射诱导髓母细胞瘤肿瘤血管中P-选择素的表达
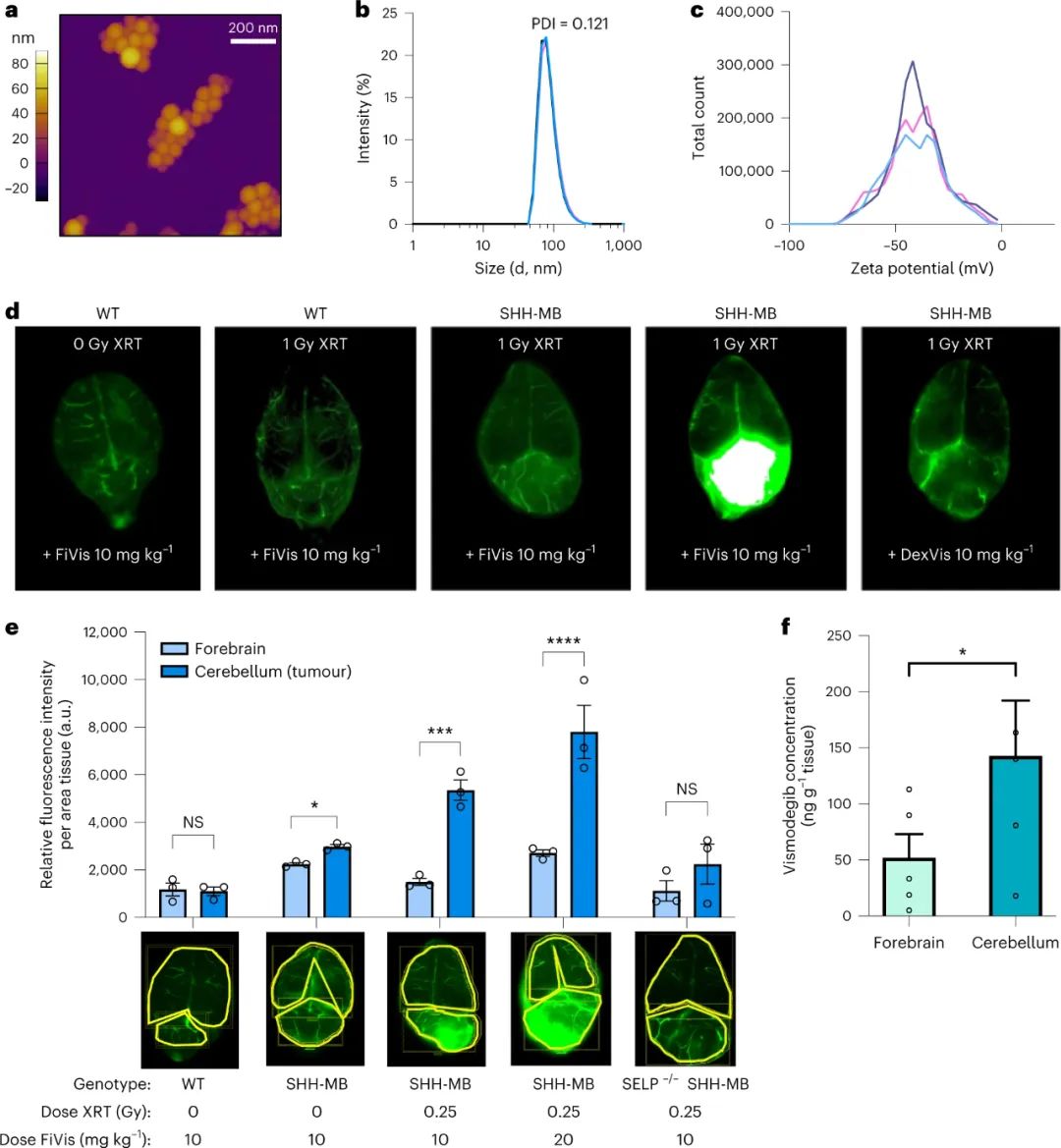
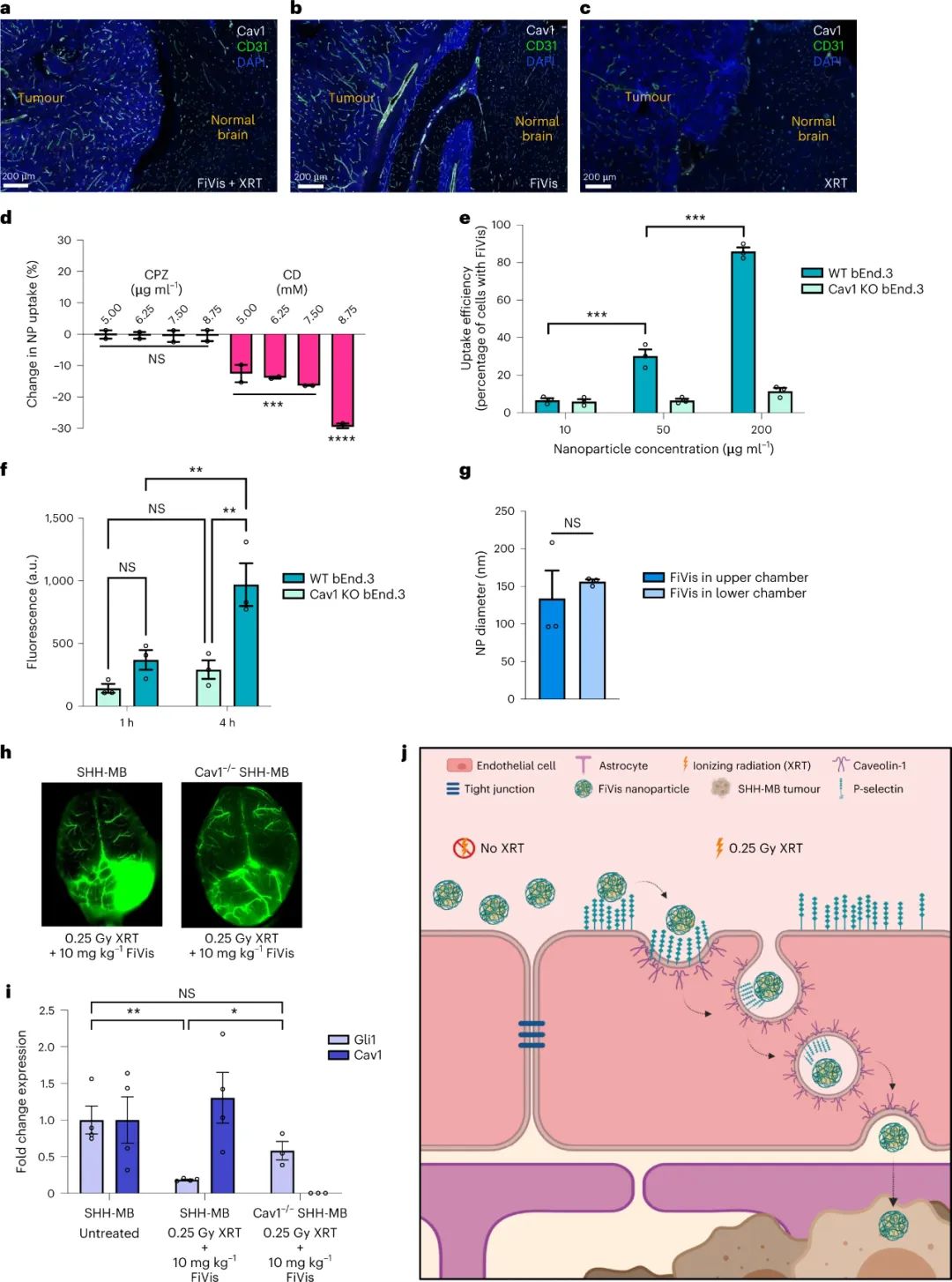
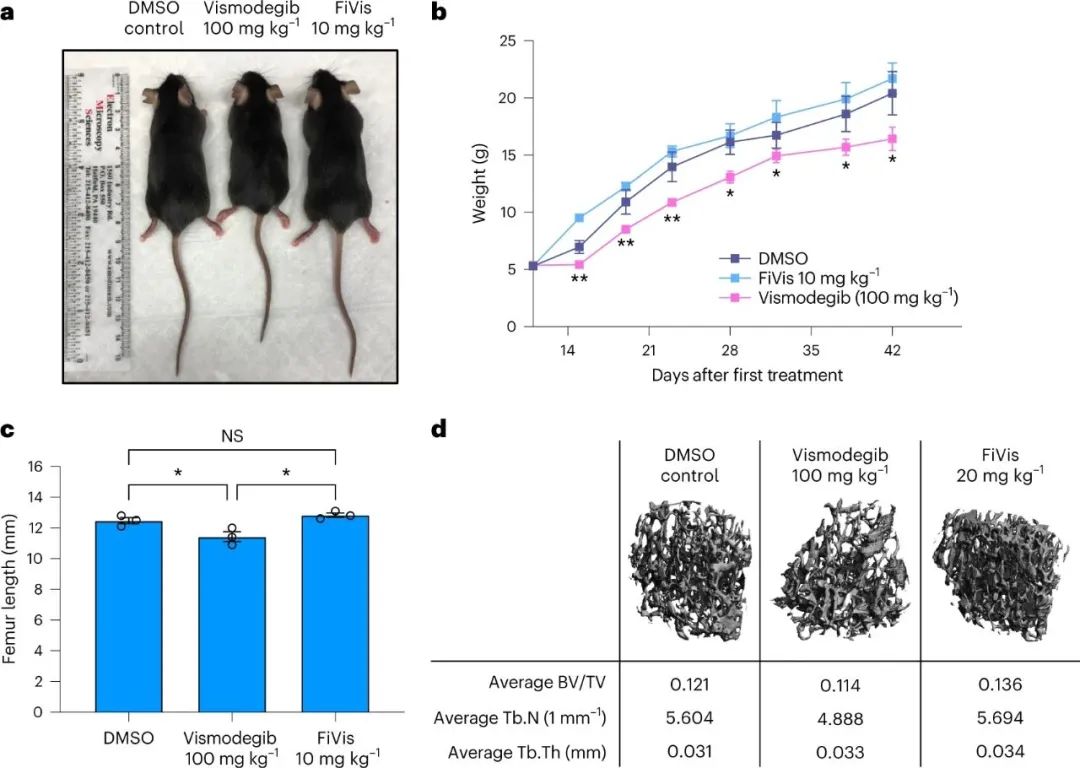
图|低剂量照射后,P-选择素靶向纳米颗粒优先靶向SHH-MB肿瘤该研究的另一个有趣发现是由管腔侧的内吞作用引发的后续纳米颗粒转胞吞作用。转胞吞作用过程依赖于caveolin-1,一种参与细胞膜穴样内陷介导的细胞内转运的蛋白质。研究人员使用基因工程的声波刺猬髓母细胞瘤小鼠模型,展示了在 0.25 Gy 的 X 射线治疗后高效的岩藻多糖纳米颗粒转胞吞作用和药物递送至肿瘤组织。虽然作者没有研究细胞内囊泡分选和腔外胞吐作用的机制,但有效的纳米颗粒递送表明有效的转胞吞作用导致vismodegib治疗髓母细胞瘤的治疗指数提高。图|FiVis纳米颗粒通过血脑屏障是由Cav1介导的图|FiVis纳米颗粒消除了vismodegib治疗对幼鼠的骨毒性因此,内皮转胞吞作用可能是一种优雅的策略,可以有效地将纳米粒子输送到各种实体瘤类型,从而有可能实现更安全、更有效的纳米医学治疗。根据最近的证据表明纳米颗粒进入实体瘤的主要机制是主动的内皮转胞吞作用,作者的研究还支持该领域寻求提高纳米颗粒递送效率的新方法。然而,需要更多的研究来探索这种用于纳米药物开发的递送策略的临床可行性。例如,有机会研究辐射诱导的 P-选择素表达靶向在其他实体瘤模型中的普遍性,同时进一步评估血小板和其他内皮细胞同时表达 P-选择素的潜在安全风险。用纳米药物靶向 P-选择素可能会进一步影响受体的生理功能和炎症或某些免疫疗法期间白细胞募集的可用性。此外,需要对内皮转胞吞作用进行更详细的机制研究,以充分了解纳米药物对实体瘤(包括髓母细胞瘤)的疗效。总的来说,这项研究展示了内皮转胞吞作用克服基于纳米颗粒的药物递送中的生物障碍的令人兴奋的机会。利用内皮转胞吞作用途径可能会促进更安全、更有效的癌症纳米药物的开发,用于治疗脑部恶性肿瘤和其他潜在的实体瘤。Tylawsky, D.E., Kiguchi, H., Vaynshteyn, J. et al. P-selectin-targeted nanocarriers induce active crossing of the blood–brain barrier via caveolin-1-dependent transcytosis. Nat. Mater. 22, 391–399 (2023).https://doi.org/10.1038/s41563-023-01481-9