强大的脊椎动物有一种非凡的能力,可以无疤痕地愈合并再生失去的附属物,即使在成年阶段(大部分已经失去了附属物的能力)。相比之下,哺乳动物会衰老或器官再生。然而,鹿角为研究哺乳动物的自发再生提供了一个独特的模型,因为鹿角的再生与哺乳动物长骨发育相似,并且在临床上具有相关性。每年早春,从鹿蒂中铸出坚硬的鹿角,然后从位于鹿蒂残肢的鹿角骨膜中再生鹿角骨和软骨。在春末夏初,鹿角生长并钙化的时间约为3 ~ 4个月,生长速率为2.75 cm/day,矿物沉积速率为3.2 mm/day,在大中型哺乳动物中最高。在夏末,鹿角失去了天鹅绒的皮肤覆盖,留下的死骨头准备在发情期战斗。鹿角在第二年春天脱落,然后新一轮的再生开始。鹿角再生的研究主要集中在鹿角再生过程的组织学和形态学方面。先前的研究发现了一些与鹿角快速生长相关的正向选择基因、调控元件和高表达基因,但鹿角再生过程中涉及的详细细胞和分子机制尚不清楚。
为了解决这一基本问题,作者开始使用单细胞转录组测序(scRNA-seq)详细研究鹿角组织在整个再生周期中的细胞组成和基因表达动态,然后使用体内和体外实验来评估关键干细胞群体的效力和功能。
鹿角的年度再生为研究哺乳动物器官再生提供了有价值的模型。西北工业大学邱强教授/王文教授、长春理工大学李春义教授、第四军医大学第一附属医院黄景辉教授和吉林农业大学李志鹏教授共同描述了鹿角再生的单细胞图谱。最早阶段的鹿角启动细胞是表达配对相关同源盒子1基因的间充质细胞(PRRX1+间充质细胞)。作者还鉴定了一个由PRRX1+间充质细胞发育而来的“鹿角母细胞祖细胞”(ABPCs)群体,并指导鹿角再生过程。跨物种比较在几种哺乳动物胚细胞中发现了ABPCs。ABPCs在体内和体外均表现出较强的自我更新能力,并能生成骨软骨谱系细胞。最后,作者观察到鹿角生长中心在生长高峰阶段的细胞和基因表达在空间上结构良好,揭示了鹿角快速伸长的细胞机制。
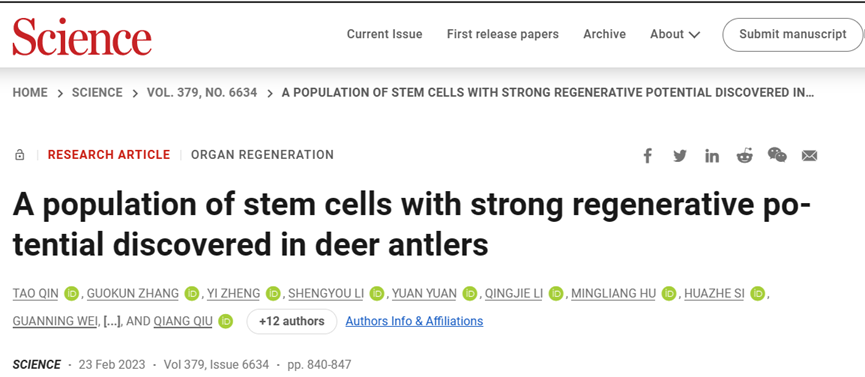
鹿角再生的单细胞转录组图谱
在鹿角的再生过程中,软骨和骨骼每年都以快速的速度完全再生。为了全面评估鹿角再生过程中发生的基因转录动态和细胞类型变化,作者在鹿角再生过程的各个阶段(脱落前10天,脱落后0、2、5、10、45、60和90天)对梅花鹿(Cervus nippon)鹿角应用scRNA-seq(图1A)。作者总共分析了74,730个覆盖鹿角再生关键阶段的细胞(图1B)。将所有样本中的细胞汇总并进行可视化,以便将细胞分配到8个假定的细胞群中(图1B)。这些群体(括号中的相关标记)是PRRX1+间充质细胞(PMCSs;PRRX1, POSTN和LUM), SOX9+软骨母细胞(SOX9和SOX6), PHEX+成骨细胞(PHEX),COL3A1+成纤维细胞(COL3A1和COL12A1), CHAD+软骨细胞(CHAD, SCRG1), ACTA2+周细胞(ACTA2和MYLK), PECAM1+内皮细胞(PECAM1和VWF),和PTPRC+免疫细胞(PTPRC和LCP1)(图1D)。接下来,作者探索了细胞亚型之间的谱系关系(图1C)。再生轨迹以PMCs、成软骨细胞和软骨细胞为主,总体趋势是由PMCs逐步转变为成软骨细胞和软骨细胞(图1C)。与此同时,PMCs中高表达的基因(如POSTN和PRRX1)逐渐下调,而成软骨细胞(如SOX6)和软骨细胞(如CHAD、ACAN和COL2A1)的特征基因在终末分化时上调(图1C)。脱落前10天和脱落后0天的样品具有高度相似的细胞组成,在脱落前10天骨膜中已经存在PMCs,这表明PMCs永久存在于鹿角生成组织中,而不是通过去分化形成的。这与在蝾螈肢体再生中观察到的过程形成了鲜明的对比,在这个过程中,PRRX1+细胞群首先经历去分化形成祖细胞,随后再分化形成PRRX1+细胞群。重建的再生轨迹表明鹿角再生的年度周期是基于PMCs的,这与哺乳动物器官再生是基于干细胞的过程的概念一致。
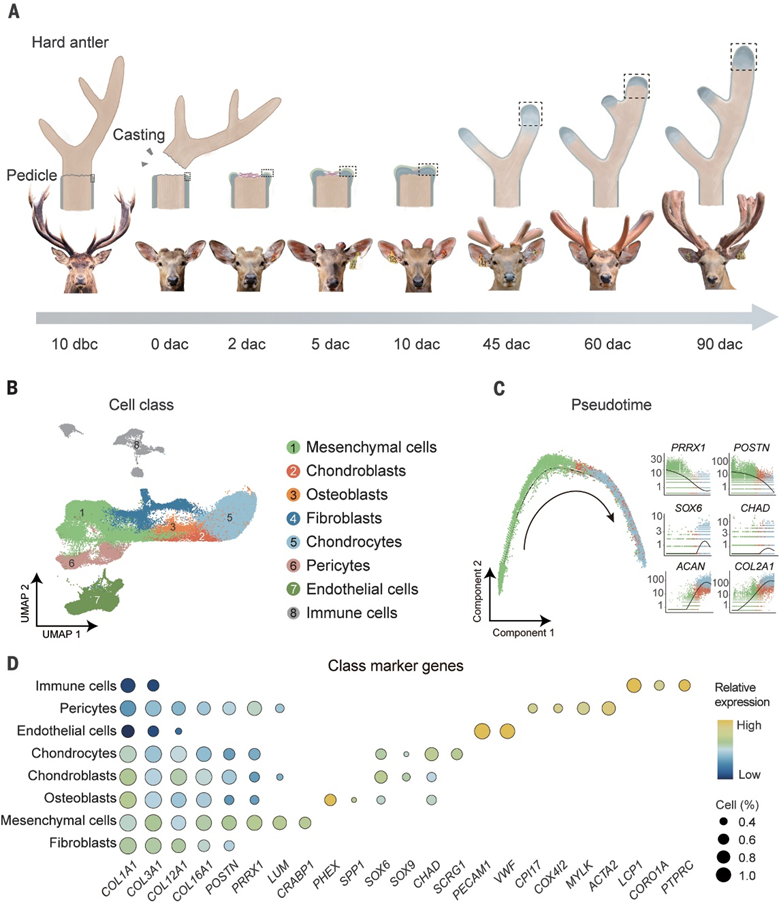
图1鹿角再生的完整发育细胞图谱
鹿角再生过程中的细胞群动态
为了详细分析骨软骨再生过程,作者对标注的细胞类型进行了亚分类分析(图2A)。如上所述,脱落前10天(预再生)和脱落后0天蒂骨膜中,PMCs数量丰富,是主要的骨膜细胞群(图2B),似乎是鹿角骨软骨再生的关键细胞。因此,作者分析了PMCs的细胞组成,发现了三种亚型:骨膜基质细胞(SFRP2+细胞群;PMC1),骨膜间充质祖细胞(PMF1+细胞群;PMC2)和趋化骨膜细胞(CXCL14+细胞群;PMC3)(图2A)。
除了脱落前10天和脱落后0天检测到的三种间充质亚型外,脱落后5天还观察到另一种类型的PMCs (标记为PMC4,表达TNN)以及少量的软骨细胞(图2B),表明细胞异质性增加,脱落后5天开始软骨细胞分化。由于PMCs在脱落后0天和5天都很丰富(图2B),作者比较了这两点的细胞团在裸鼠体内异位生成鹿角的能力。与脱落后0天的细胞团生成纤维结缔组织相反,脱落后5天的细胞团在移植后45天成功分化为鹿角样结构(含软骨和骨)(图2C),证实了其异位鹿角生成能力。作者在将细胞团置于tdTOMATO(红色荧光蛋白)标记的裸鼠头部后5天进一步将细胞团移植。PMC4细胞在脱落后5天高表达多个支持再生的基因,包括PTN、TNC、TNN和DLX5,这些基因主要与软骨发生和肢体发育相关(图2D和E)。作者进一步描述了PMC4细胞群的起源。由于PMC1、PMC2和PMC3出现在更早的时间点(脱落前10天和脱落后0天),而PMC4(脱落后5天),作者首先比较了PMC4与其他PMCSs的转录组相似性。
作者还观察到巨噬细胞(CD86)在脱落后5天增加,这是哺乳动物和两栖动物伤口愈合或非形态再生所必需的(图2B)。这表明免疫系统在鹿角再生中也起着重要作用,类似于其在两栖动物附肢再生中的作用。脱落后5天的细胞群达到囊胚的定义。这是一种细胞团,通过迁移和增殖,在损伤平面上短暂形成,并被赋予器官再生所需的形态发生信息。由于PMC4被确定为鹿角再生的关键细胞群,作者将这些细胞称为“鹿角母细胞祖细胞”(ABPCs)。尽管不同物种的胚细胞组成差异很大,但PRRX1+细胞是物种中最丰富的细胞类型。作者在小鼠指尖(P3)胚细胞中鉴定了一种特定的PRRX1+细胞亚型,其基因表达谱与ABPCs相似,但与不可再生的指尖(中指骨,P2)、蝾螈肢体和斑马鱼尾鳍胚细胞的基因表达谱不同(图2,F至I;无花果。)。这些发现表明,哺乳动物中可能存在一种细胞群,这种细胞群对哺乳动物的附属物再生至关重要。作者观察到脱落后10天细胞群的异质性比早期时间点更大,ABPCs(4.53%)、成软骨细胞(6.75%)、软骨细胞(30.78%)和成骨细胞(8.16%)的比例较大(图2B)。作者还观察到软骨生成基因如SOX6、ACAN和CHAD的表达增加,表明软骨在脱落后10天迅速发育。在脱落后45、60、90天,软骨细胞和成骨细胞的比例进一步增加(图2B)。
在这个阶段,作者主要关注鹿角再生中的骨再生过程。然而,鹿角的再生也需要其他细胞类型的增殖,如软骨的细胞外基质。同时,作者确定了三种成纤维细胞簇,分别为成纤维细胞1、成纤维细胞2和成纤维细胞3(图2A)。在鹿角再生过程中,作者发现再生前(脱落前10天)骨膜中已经存在成纤维细胞1和PMC2(图2B)。成纤维细胞2和成纤维细胞3在脱落后10天开始出现,在再生中期(脱落后10 ~ 45天)维持较高水平,在鹿角骨化期(脱落后60 ~ 90天)大幅下降(图2B)。
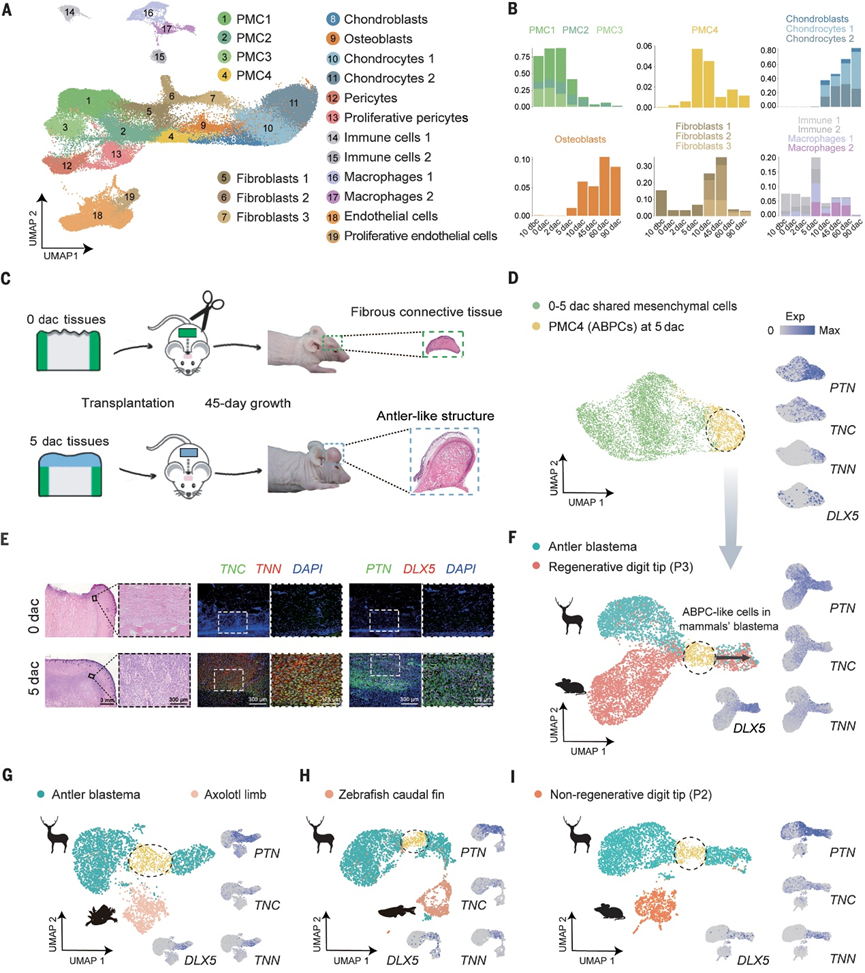
图2 鹿角再生的细胞动态图谱及关键再生祖细胞的鉴定
脱落后5天ABPCs的表型和功能特征
脱落后5天囊胚中的ABPCs在鹿角再生中起着至关重要的作用。作者分离出ABPCs进行进一步的表型和功能表征(图3A)。作者鉴定出ABPCs中富集的一簇基因。两种细胞表面标记物(CX43+和FGFR2+)在ABPCs中高表达且差异表达(图3B)。随后,流式细胞术对CX43+FGFR2+ ABPCs进行功能分析(图3B)。CX43+FGFR2+细胞形成的菌落可以克隆扩增并连续传代,产生二级和三级菌落,保持免疫表型,表明其具有自我更新能力。此外,与CX43+FGFR2−、CX43−FGFR2+和CX43−FGFR2−细胞相比,这些细胞具有更高的集落形成效率,并产生更大的集落(图3、C和D)。接下来,作者对克隆培养进行体外分化试验。CX43+FGFR2+细胞表现出很强的成骨和软骨分化能力,但不具有成脂分化能力(图3E)。这与骨髓基质细胞(BMSCs)的三龄分化显著不同,骨髓基质细胞是目前在骨再生医学中应用最广泛的干细胞。此外,在相同条件下,CX43+FGFR2+细胞表现出比BMSCs更强的成骨分化能力,表现为成骨标志物(RUNX2和SP7)和成软骨标志物(SOX9和COL2A1)表达量较高,而成脂肪标志物(ADIPOQ和PPARG)表达量不高(图3F)。因此,鹿茸CX43+FGFR2+细胞保持自我更新能力,具有很强的骨软骨分化潜能,突出了它们在基于细胞的骨和软骨再生治疗中的潜在应用价值。为了进一步评估CX43 +FGFR2+细胞的体内分化潜力,作者将细胞培养物移植到免疫缺陷小鼠的肾囊中(图3G)。移植后8周,CX43+FGFR2+细胞显示出较强的骨软骨分化能力(图3H)。与骨髓间充质干细胞相比,它们形成的新软骨和骨的面积明显更大(图3I)。此外,再生的软骨和骨来自绿色荧光标记的CX43+FGFR2+细胞(图3H)。
此外,再生的软骨和骨来自绿色荧光标记的CX43+FGFR2+细胞(图3H)。为了进一步评估CX43+FGFR2+细胞在再生医学和骨重塑中的潜在治疗价值,以骨髓间充质干细胞为对照,应用CX43+FGFR2+细胞修复家兔股骨髁缺损。8周后,BMSCs和CX43+FGFR2+细胞都用新形成的骨填充空腔,但CX43+FGFR2+细胞产生了更多的新骨小梁(图3、J和K)。因此,CX43+FGFR2+细胞在体内具有很强的促进骨形成的能力,具有促进骨再生的细胞治疗潜力(例如,用于骨或软骨损伤、骨不连骨折和骨质疏松症)。与其他干细胞类型相比,CX43+FGFR2+细胞具有优越的增殖和骨软骨分化能力以及体外扩增能力。然而,作者强调,在临床中使用鹿CX43+FGFR2+细胞的许多担忧仍有待在未来的研究中解决,包括其详细的分子调控机制和使用中的安全隐患,以及伦理和法律问题。
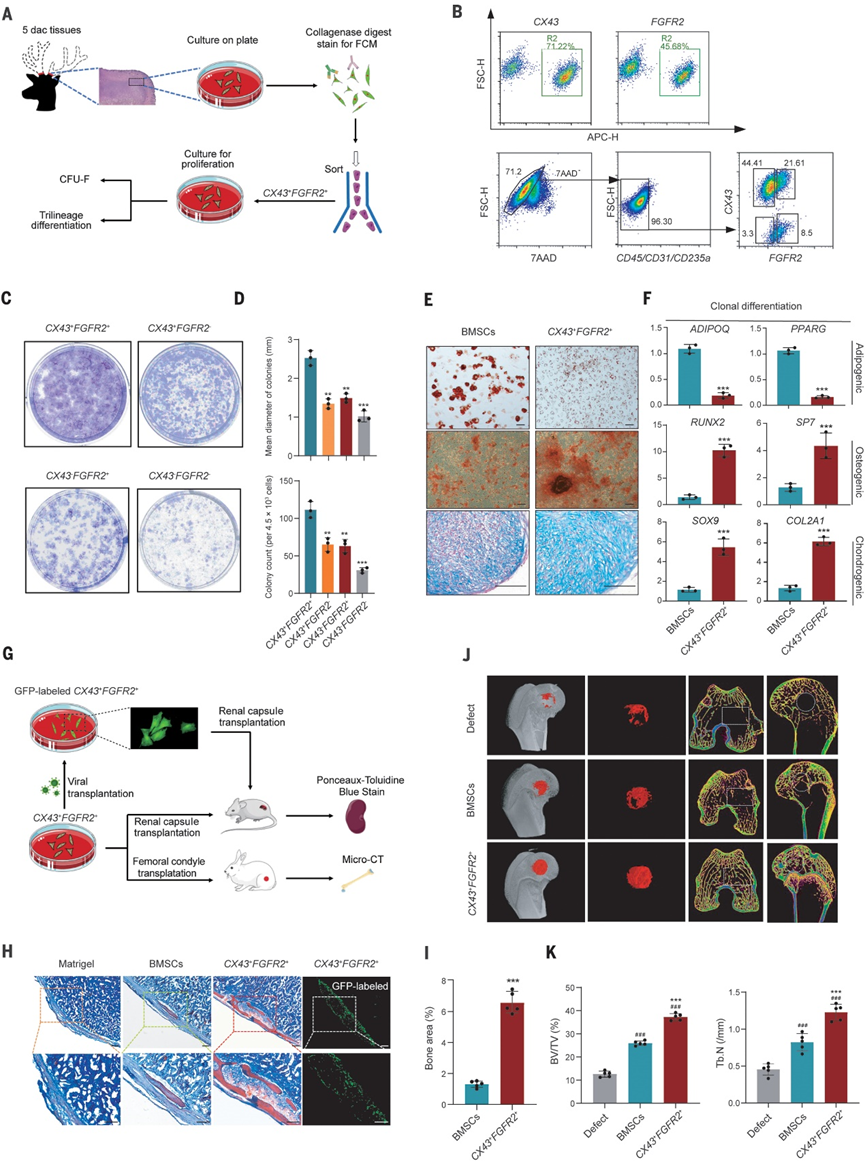
图3 ABPCs (CX43+FGFR2+细胞)的表型和功能特征
鹿角快速生长过程中的空间细胞和遗传异质性
鹿角的骨骼生长速度是所有动物中最高的。鹿角生长过程在空间上组织良好,在鹿角尖端形成了一个鹿角生长中心(AGC) (图4A)。AGC成为鹿角快速伸长的主要生长中心,在组织学上再现了胚胎长骨的生长中心。为了在细胞和基因表达水平上表征其空间异质性,作者在脱落后60天对AGC组织层进行了scRNA-seq和体RNA-seq分析,这段时间大约是梅花鹿鹿角生长最快的时间点(图4A)。单细胞映射符合组织学空间位置分布(图4B)。鹿尖最末端的间充质层主要由内骨体细胞(29.68%)和ABPCs (49.96%)组成(图4、B和C),说明脱落后5天形成的ABPCs作为鹿角生长的干细胞池持续存在于鹿尖。不稳定层以成软骨细胞(51.90%)为主,成软骨细胞是软骨发生的关键细胞,而ABPCs的比例较小(20.52%)(图4B和C)。软骨和增厚前软骨(PH软骨)层以软骨细胞为主(61.47%)(图4B和C)。增生性软骨层主要由成骨细胞组成(63.87%)(图4B和C),这与组织学发现的增生性软骨正在被海绵骨所取代。组织学证实了AGC中细胞组成的空间异质性。间充质层高表达基因参与细胞增殖(如IGF1、IGFBP2和IGFBP4)和干细胞维持(如SFRP1和SFRP2)(图4D)。这是意料之中的,因为鹿角细胞的快速增殖不仅需要刺激细胞的快速增殖,还需要维持ABPCs的干性和控制细胞周期的因素。在不稳定层中特异性高表达的基因(例如WNT10B、WNT10A和WNT6)与Wnt通路相关(图4D),表明该信号通路可能参与干细胞向软骨形成的早期分化。软骨层和PH软骨层中高表达的基因与软骨发育(如SOX6和SOX9)和细胞外基质组织(如COL2A1)有关(图4D)。肥厚软骨层中高表达的基因与软骨细胞矿化有关(如MMP9和MMP12)(图4D)。
鹿的AGCs的组织学类似于哺乳动物发育长骨的生长板,这表明它们可能具有相似的生长机制。为了验证这一假设,作者重新分析了小鼠胚胎肢体的scRNA-seq图谱,并将其与AGCs进行了比较。作者发现他们共享151个高表达基因,主要与细胞外基质组织、骨骼系统发育、软骨发育和细胞增殖相关。丝裂原活化蛋白激酶(MAPK)信号通路的几个核心基因(FGFR2、FGFR3、MAP2K2、FOS和JUN)、骨形态发生蛋白(BMP)信号通路(BMP2和BMP4)和转化生长因子- b (TGFb)信号通路(TGFB1和TGFB2)在AGCs和小鼠新生生长板中均高表达。ABPCs的标记基因(PRRX1、TNC、DLX5、PTN和SOX4)在小鼠肢体快速发育过程中也被鉴定出来,这表明这些基因在哺乳动物骨骼快速发育中具有潜在作用(图4E)。此外,作者在AGC中检测到多个血管生成相关基因(VAV3、ANGPTL2、MYH9和ACTG1),很可能与鹿角中高度血管化的软骨有关。这是鹿角生长的一个显著特征,它与小鼠和人类组织中的无血管软骨形成有很大不同,并满足快速生长的鹿角组织的高代谢需求。
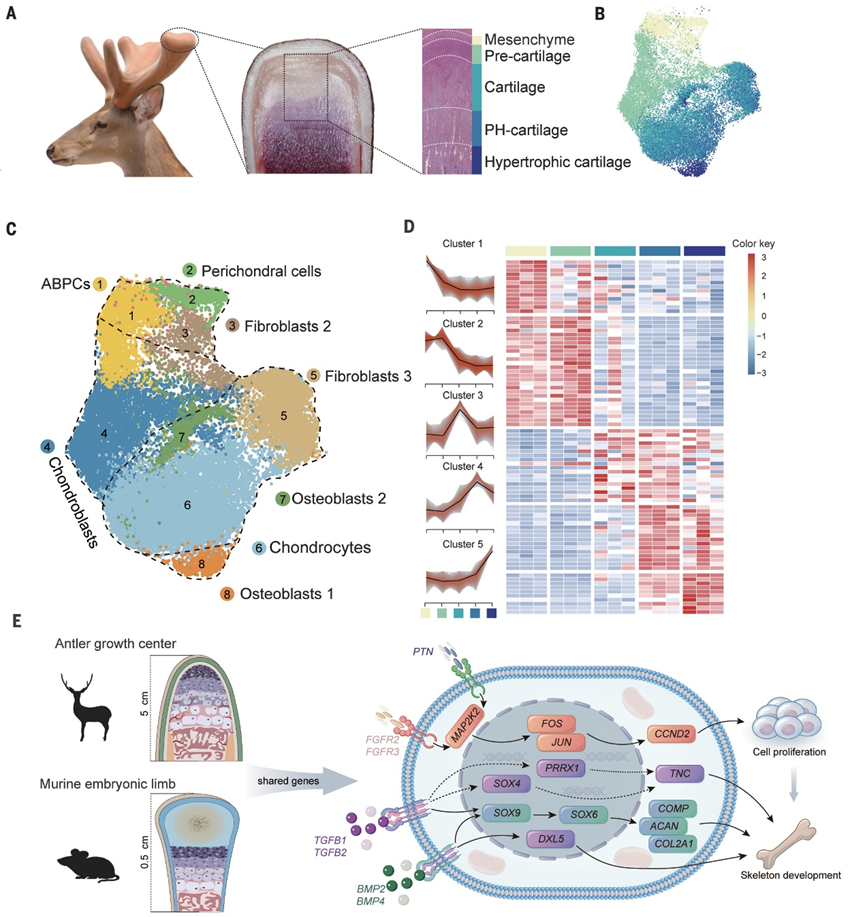
图4 鹿角快速生长的空间细胞和遗传异质性
小结
作者建立了鹿角再生的时空细胞图谱,为哺乳动物器官再生提供了有用的遗传和组织学资源。作者的研究结果表明鹿角再生与基于干细胞的再生过程是一致的。作者提供的证据表明,在鹿角再生过程中存在一种类似于两栖动物肢体再生的胚基结构,这表明胚基是脊椎动物组织再生中保守的生物学特征。作者进一步在鹿角胚细胞中鉴定出一种再生祖细胞,即ABPCs,具有令人印象深刻的自我更新、成骨-软骨分化和骨组织修复能力。这为理解鹿角再生提供了细胞基础,并扩展了已知哺乳动物干细胞系统的目录。跨物种比较表明,类似于ABPCs的细胞类型存在于小鼠再生趾尖(P3)中,但不存在于小鼠非再生趾尖(P2)、蝾螈肢体或斑马鱼尾鳍中。这表明,哺乳动物附件器官中仅有的两个已知再生能力案例存在相对保守的细胞和分子机制。作者的体外和体内实验结果表明鹿ABPCs可能在临床骨修复中有应用价值。除此之外,通过激活关键特征基因将正常的人间充质细胞或其他细胞诱导成ABPCs样细胞可能被用于骨骼损伤或肢体再生的再生医学。
参考文献:
Qin T, Zhang G, Zheng Y, et al. A population of stem cells with strong regenerative potential discovered in deer antlers. Science. 2023;379: 840-847.
https://www.science.org/doi/10.1126/science.add0488











