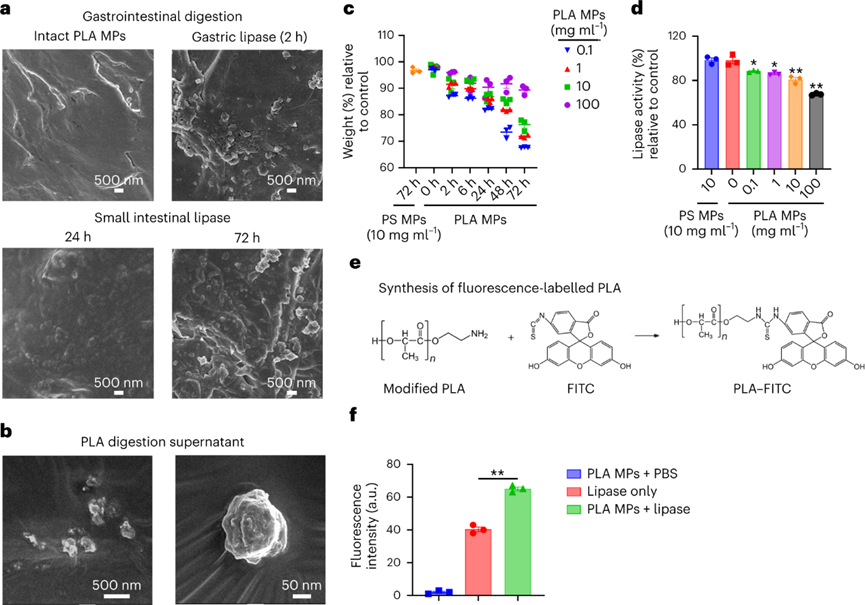
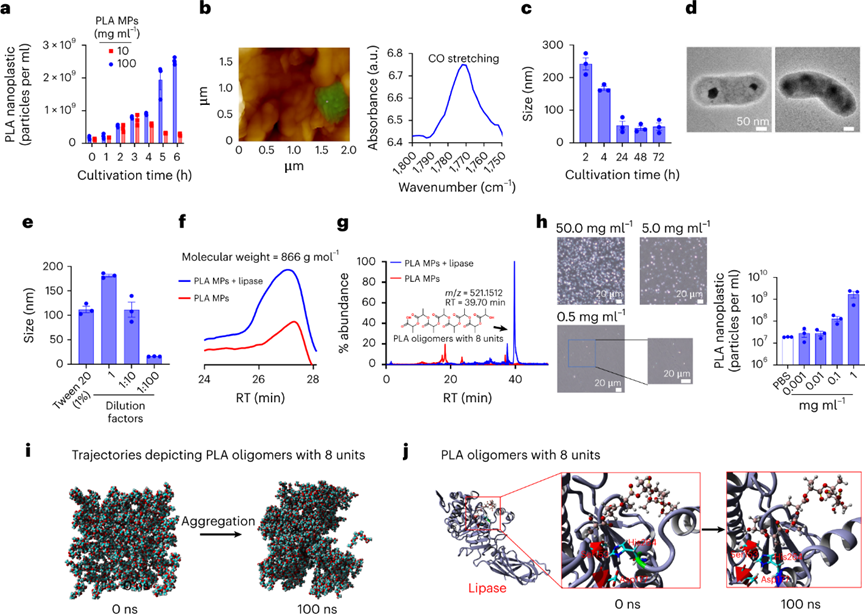
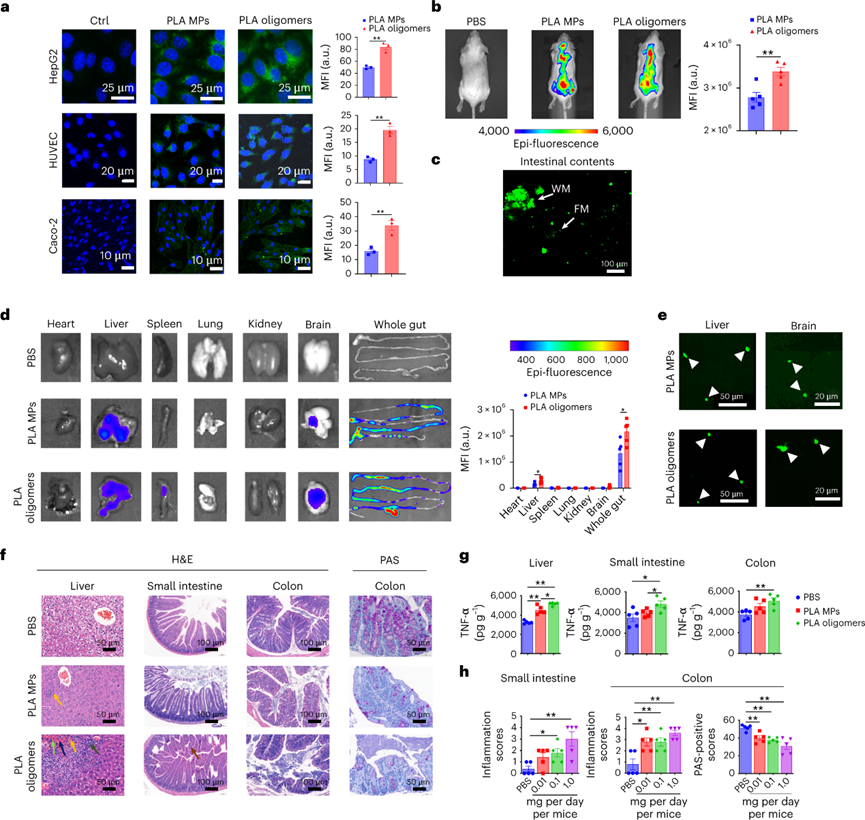
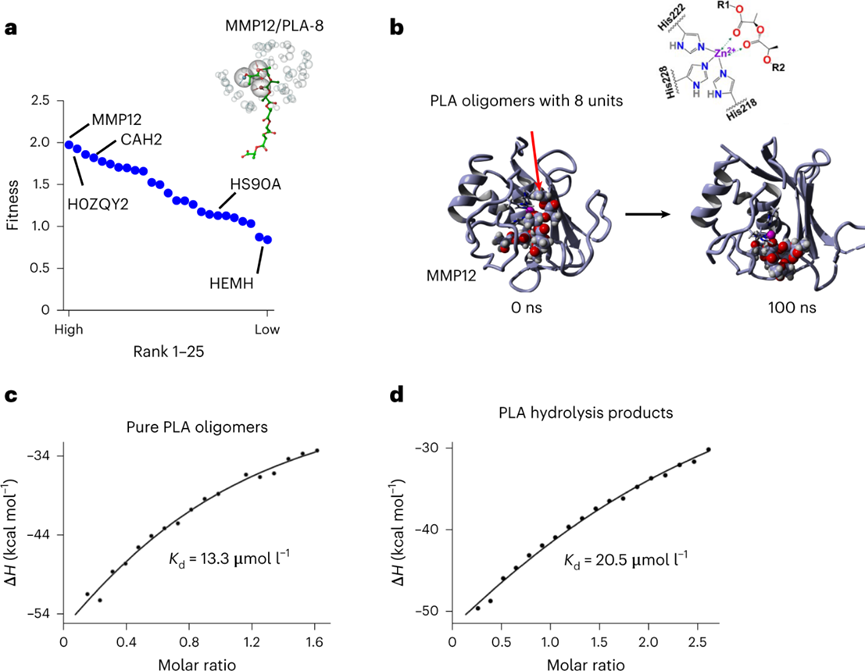
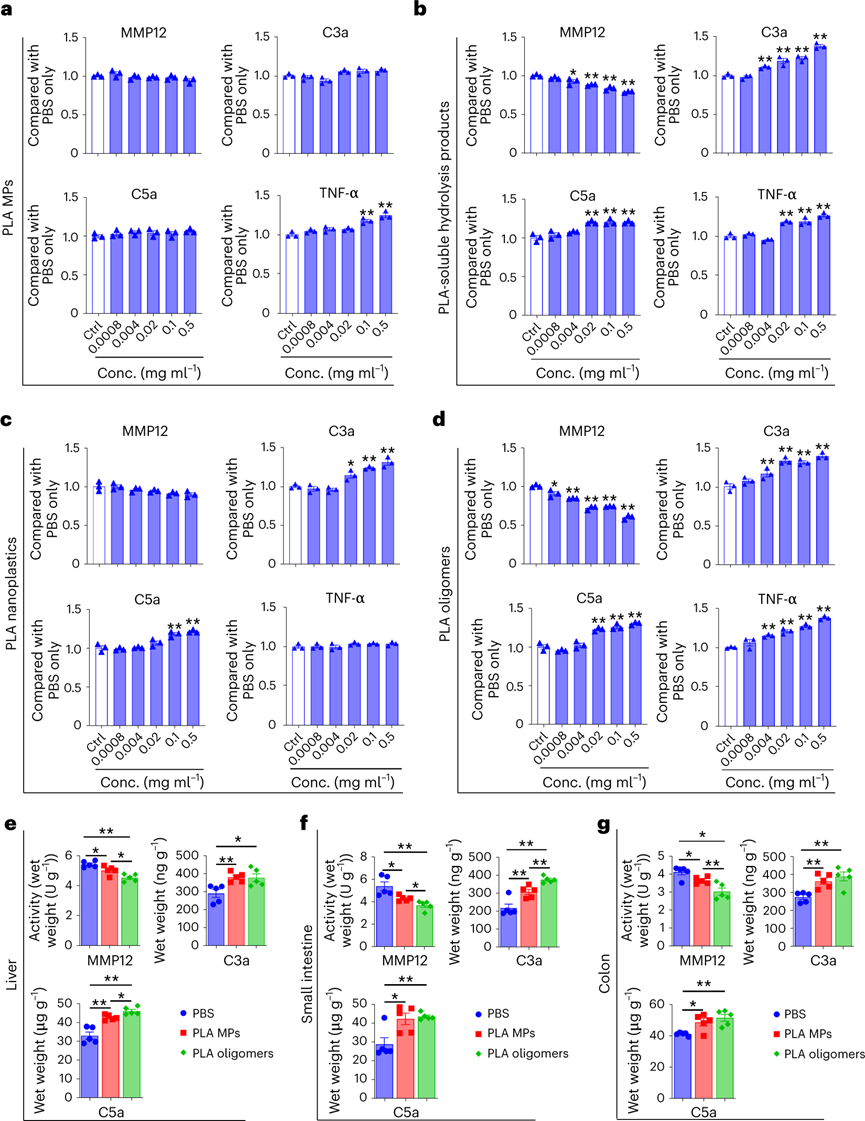
白色污染是一个老生常谈的环境问题,虽然世界各国出台了各式的法案进行处理,但是这些污染降解形成的微塑料(MP)在水生和陆地环境中无处不在。由于其对环境和人类健康的潜在风险,是世界上最紧迫的环境问题。MP在环境中转移,并通过食物链和直接吸入或摄入人体进行生物积累。尽管人类MP暴露的确切数量涉及很大的不确定性,但研究初步估计,通过口服摄入的每周MP消耗量范围为0.1至5.0克MP颗粒。对小鼠、牡蛎和贻贝的研究表明,接触与环境相关的MP会导致生殖受损、DNA损伤和神经毒性,而导致这些影响的机制仍然是未知的。为了减轻塑料污染,人类使用可生物降解塑料作为传统塑料的替代品。生物塑料聚乳酸(PLA)就广泛用于制造食品包装,一次性餐具和生物医学递药载体。但是在人类和小鼠模型研究中表明,基于PLA的植入会引发炎症。同时PLA塑料可能比传统塑料产生更多的MPs,所以PLA MPs越来越多地存在于土壤,沉积物和室内灰尘中。PLA MP摄入的毒理学值得进一步深入研究,学界仍然缺乏关于它们在肠道中的生物转化如何影响人类健康的认知。近日,复旦大学环境科学与工程系的陈建民教授、南洋理工大学土木与环境工程学院的方明亮教授、安徽医学大学黄以超教授等人报道了一项关于“环保”可降解塑料对人类胃肠道与健康风险影响的工作。作者证明了聚乳酸微塑料通过在胃肠道中竞争甘油三酯脂肪酶来水解,产物通过自组装形成低聚纳米塑料颗粒。在小鼠模型中,聚乳酸低聚物及其纳米颗粒在肝脏、肠道和大脑中生物积累。同时暴露于聚乳酸低聚物后会导致不良肠道炎症作用。虽然,可生物降解塑料被认为是解决环境塑料污染的解决方案,但生物塑料的胃肠道降解和毒性也必须有所认知。首先测试PLA MPs与不同的消化液反应。在人工胃和肠液中进行体外消化后,SEM图像显示PLA MPs的表面粗糙。进一步用胃脂肪酶处理PLA MPs,其表面表现出实质性的改变。将PLA MPs在含有小肠脂肪酶的PBS中生物降解3天。SEM分析表明,随着孵育时间的延长,表面磨损增加。在小肠脂肪酶中生物降解的PLA MPs质量在6小时后迅速减少了其初始质量的15%。脂肪酶处理后PLA MPs的分子和晶体结构没有实质性变化。因此,这表明MP可能分别被胃和肠液中的脂肪酶降解。脂肪酶在胃和肠液中水解PLA,可能是基于PLA的羧酯键和脂肪酶的丰度。进一步评估PLA和消化脂肪酶之间的相互作用,使用甘油三酯作为阳性对照。PLA结合消化脂肪酶,通过竞争性结合阻止甘油三酯降解。通过体外消化模型,研究纳米级塑料颗粒形成机制。PLA在胃脂肪酶消化2小时后在培养基上清液中形成了每毫升6.09 × 108个颗粒。这种小纳米塑料颗粒的形成呈现剂量依赖性,前3小时显示出最大的产量,这可能是由于生成的颗粒或相关低聚物解聚。酶解2 h后PLA纳米颗粒的平均尺寸为200 nm,酶解1 d后的平均尺寸为50 nm,在接下来的连续两天内趋于稳定。TEM图像显示纳米塑料具有多个中心核心,表明颗粒可能发生自我聚集。GPC分析显示,在消化的PLA MP中低分子量范围(~900 Da)中存在微小的峰,这可能是解聚低聚物。使用高分辨率质谱法对低聚物单元的进一步分析表明,八单元低聚物的丰度最高。研究了释放的PLA低聚物对脂肪酶酶活性的影响。分子动力学模拟表明,PLA低聚物通过与Ser153、His264和Asp177催化三联体的氢键占据了脂肪酶的活性位点。同样,PLA低聚物-脂肪酶相互作用的亲和力高度依赖于单元数,因为更多的单元形成更强的氢键。PLA的羧碳与Ser153的羟基氧之间的距离比甘油三酯的距离更近,表明亲核进攻容易发生。此外,由于没有氢键,甘油三酯对催化位点的结合亲和力较PLA低聚物的结合亲和力弱。PLA低聚物的过渡态具有0.11 eV的相对能垒,表明一旦Ser153脂肪酶亲核进攻羧基,后续的催化步骤可能会自发发生。为了研究释放的纳米塑料或低聚物是否可以在体外被肝细胞吸收,用荧光PLA纳米塑料和低聚物处理HepG2。两幅图像都显示出高信号强度,PLA低聚物发出更高的信号。对小鼠施用荧光PLA MP和低聚物一周,并追踪它们的组织生物分布和肠道内容物。根据目前的数据显示,人类每周可能摄入~0.1-5.0克MP,小鼠最初以每天1.0mg的速度给予PLA MP和低聚物。荧光结果显示,PLA广泛分布于小鼠体内。此外,摄入的PLA MPs以小片段(亚微米)的形式存在于肠道中。PLA纳米粒子和低聚物的荧光信号主要集中在肝脏、肠道和结肠。在肝脏和大脑切片中业观察到了不同程度的荧光斑点。并且低聚物处理小鼠中观察到肝脏和肠道中的更强信号。组织病理学显示,用PLA MPs刺激的小鼠表现出肝脏,小肠和结肠的炎症和浸润。与对照组相比,结肠PAS染色检测到肠道粘液减少。低聚物同样引起了这些不利作用且效率更高。肝脏,小肠和结肠中促炎细胞因子TNF-α浓度显着升高。进一步给予与人类摄入水平相近的PLA MP,其小鼠小肠和结肠均有炎症,减少小肠和结肠中的粘液产生。图 PLA纳米塑料/低聚物在体外和体内的生物分布和组织病理学为了确定诱导炎症的潜在机制,首先测试了肠道微环境的pH值,因为PLA的水解会释放酸性基团。但在给定剂量下,缓冲溶液的效力变化很小。进一步假设低聚物通过直接与某些促炎蛋白相互作用来调节炎症。虽然没有关于PLA低聚物-蛋白质相互作用的已发表数据,但使用药效团模型计算八聚体与16,646种蛋白质的结合亲和力。通过合并GPC结果和质谱数据进行筛选。结果显示,PLA(8个单位)-基质金属蛋白肽酶12(MMP12)的适应度得分最高。计算分析进一步表明,10个单元后,与低聚物单位长度对应的MMP12催化位点的亲和力趋于稳定。进一步发现,随着PLA单位的增加,PLA的羧氧与锌离子发生静电相互作用。当低聚物单元的数量达到11个时,这种静电力开始显着减弱。假设PLA低聚物和MMP12之间的疏水和氢键作用较弱,主要是羧基氧和锌离子之间静电作用。为了进一步验证这种相互作用,进行等温滴定量热法分析,结果表明MMP12与纯PLA低聚物以及与水解产物的结合亲和力(Kd)的分别为13.3和20.5μM。为了研究低聚物的免疫毒性,测量MMP12的生物活性以及低聚物处理的RAW 264.7产生的C3a,C5a和TNF-α浓度。用PLA MPs、PLA纳米塑料、PLA低聚物以及可溶性水解产物处理,均会使MMP12生物活性减弱,同时C3a,C5a和TNF-α浓度升高。这种炎症因子浓度的变化与刺激物的浓度呈现正相关。小鼠模型的体内表型数据进一步证实了用PLA MP和PLA低聚物刺激会引发MMP12生物活性的降低。同时肝脏,小肠和结肠中C3a和C5a的浓度增加。相比于PLA MP而言,低聚物引起了更剧烈的炎症作用,这进一步证实了低聚物的免疫调节作用。可生物降解塑料已被提议作为解决“可持续性”塑料问题的主要解决方案。然而,这些替代品是否对人类健康构成重大风险还远未得到了解。人类在日常生活中摄入大量可生物降解的塑料,胃肠道会直接改变它们的化学结构,从而改变它们的代谢、生物利用度和生物效应。虽然这些塑料在自然环境中很容易降解,但其与人类健康相关的肠道转化机制的了解还处于早期阶段。作者团队证明了,胃和肠道脂肪酶对PLA MP的降解都有相当大的影响。此外,PLA是甘油三酯特异性脂肪酶的底物,与人类健康具有重要相关性。纳米级塑料颗粒的释放速度快于预期,酶解仅3 h后就形成释放峰。人体肠道在消化过程中产生更小的纳米塑料(~50纳米)。这些纳米塑料的尺寸非常小,使它们更容易渗透到胃肠道,进入循环系统到达其他组织,并进一步赋予肠道健康风险。PLA低聚物对脂肪酶活性的直接抑制作用,有效地竞争甘油三酯与脂肪酶的特异性结合。与膳食脂肪相比,PLA的数量通常要少得多。因此,与脂质消化和吸收相关的人类健康影响需要进一步群体验证。在实际人类暴露剂量下的PLA MPs刺激小鼠的肠道和结肠中存在严重炎症。观察到的炎症很可能是由水解和自组装的低聚物引发,而不是由PLA的颗粒碎片直接引起。八聚体作为PLA水解中的主要低聚物,使用配体-蛋白质相互作用模型来筛选主要药物靶蛋白中的可能靶标。PLA低聚物对关键免疫调节剂MMP12的灭活也许可以解释PLA在免疫调节中的作用。MMP12作为关键介质,为炎症的消退奠定基础,因为它在控制组织紧致性和通透性方面起主要作用。此外,MMP12使补体C3失活以减少补体活化,并使化学引诱药过敏毒素C3a和C5a失活。目前的研究对于人类暴露于MP的评估并不包括短链MP聚合物或潜在有毒的低聚物。但已发表的研究表明,聚合物中的低聚物很可能是聚合物毒性的主要贡献者。聚丙烯奶瓶、硅胶橡胶婴儿奶嘴、尼龙袋、热饮杯和塑料茶包等等生活中的塑料制品可能已经自行降解,并释放了数万亿纳米塑料与更多有毒的低聚物,这可能使得学界低估了人类MPs的总暴露量。很少有毒理学研究报告PLA低聚物的健康影响,特别是在人类相关剂量下。因此,该工作从一个方向解释了PLA降解低聚物在肠道炎症形成的分子基础。总之,该工作的结果促进了对可生物降解塑料降解产物作为有毒污染物的认知。Mengjing Wang, Qianqian Li, Changzhi Shi, et al. Oligomer nanoparticle release from polylactic acid plastics catalysed by gut enzymes triggers acute inflammation. Nat Nanotechnol. 2023 Mar 2.https://www.nature.com/articles/s41565-023-01329-y