T细胞最初通过T细胞受体(TCR)与抗原呈递细胞(APC)表面的载肽主要组织相容性复合物(pMHC)的结合而获得适应性免疫。pMHC的参与可以诱导TCR复合物胞质域中基于酪氨酸的免疫受体激活基序(ITAMs)的磷酸化(一个称为TCR触发的过程),导致ZAP70募集以触发最终导致T细胞激活的信号通路级联。尽管在T细胞免疫中起着重要作用,但TCR–pMHC参与如何启动细胞内信号级联的分子机制仍存在争议。
TCR-pMHC相互作用的许多特征,如构象改变、结合亲和力和结合动力学,已经在TCR触发的背景下进行了研究,其轴向尺寸(垂直于两个膜的平面)被认为是关键决定因素之一。在 TCR-pMHC 连接中,多个辅助分子被募集以在 APC 和 T 细胞之间的界面处形成紧密接触区域。TCR-pMHC 复合体的小尺寸意味着细胞接触保持在 ~13nm 的短膜间距内。 这个距离将在空间上排除具有大胞外域的细胞表面分子,例如酪氨酸磷酸酶 CD45。动力学分离模型假定从接触区排除 CD45 对于促进下游信号传导的延长 ITAM 磷酸化至关重要。同时,可能会产生机械力,因为从紧密接触区分离或压缩的大分子将难以扩散或拉直。这种力可以促进连接的 TCR 复合物的构象变化,以加强 T 细胞活化。
人工纳米制造表面可以提供可测量的模型,但它们缺乏许多固有的膜相关分子和适应性形态,不可避免地导致代表真实 APC 的局限性。此外,迄今为止报道的策略仅侧重于延长膜间距,但很少有人试图探索相反操作引起的效果,在机制研究中留下了不可避免的空白。事实上,在真实的 APC-T 细胞相互作用系统中使用更宽的窗口来操纵接触区的尺寸,但对细胞状态的干扰最小化的能力将使我们能够更好地理解 T 细胞信号传导。
成果简介:
鉴于此,湖南大学谭蔚泓院士、邱丽萍等人设计了一系列具有不同尺寸的 DNA 纳米连接 (DNJ),以精确控制 APC-T 细胞界面处的膜间距。

构建和表征不同大小的 TDN
这些 DNJ 是通过两个膜锚定四面体 DNA 纳米结构 (TDN) 之间的 DNA 杂交形成的,这些结构是通过DNA自组装构建的,顶部顶点有 17 个核苷酸突出端,三个底部顶点有胆固醇标签。这些两亲性TDN可以通过胆固醇标签和磷脂双层之间的疏水相互作用锚定在细胞膜上。四面体的机械刚度和几何稳定性提供了一种可靠的具有确定尺寸的膜锚定纳米支架。
为了精确调整膜间距,研究人员设计了三个等边 TDN,即 TDN-7、TDN-13 和 TDN-37,每个边分别由 7、13 和 37 个碱基对组成。三种类型的 DNJ,称为 DNJ-7、DNJ-13和 DNJ-37,是通过组合两个相同大小的互补TDN构建的,它们的理论高度分别计算为 9.8、13.0 和 26.4nm。
作者使用凝胶电泳、原子力显微镜和动态光散射来确认三种不同 TDN 的形成和大小。然后,他们通过在细胞与含有胆固醇的 FAM 标记的 TDN 孵育后观察细胞膜上的强荧光信号,证明了胆固醇在 TDN 有效膜锚定中的重要性。作者还表明,具有三个间隔锚定位点的 TDN 为细胞表面工程提供了可靠的平台。他们使用浓度为200 nM的TDN持续 20 分钟,实现了高膜锚定效率和饱和度。作者还评估了这种膜修饰策略对两种主要免疫细胞的普遍性:树突状细胞和 CD8+ T 细胞。所有三种 TDN 都可以快速有效地锚定在两种免疫细胞的膜上,证明了这种膜锚定纳米平台用于研究DC-T 细胞相互作用的可靠性。
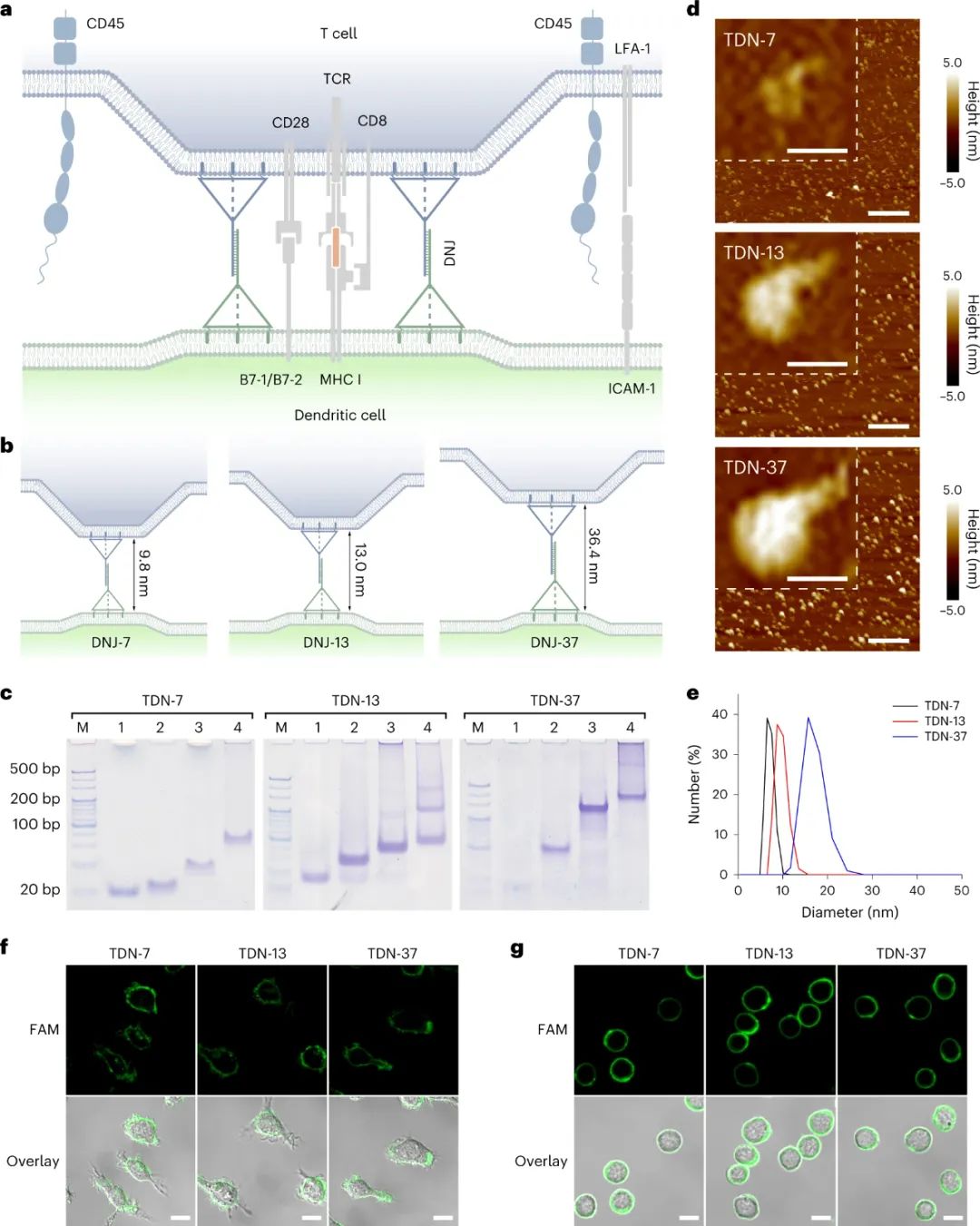
图|用于细胞表面工程的TDN的构建和表征
构建用于操纵膜间距的DNJ
研究证实,DNJ 可以通过互补 TDN 的杂交形成,并且它们可以控制细胞之间的膜间距。使用可变角度全内反射荧光显微镜 (VA-TIRFM) 和不同分子量的荧光素-异硫氰酸酯标记的葡聚糖测量 DNJ-7、DNJ-13 和DNJ-37 产生的膜间距。结果显示 DNJ 大小与膜间距离呈正相关,测量的距离与其预期值匹配良好。TEM成像证实了 DNJ 介导的细胞界面存在空间间隙。总体而言,该研究表明 DNJ 有可能用作控制细胞间相互作用的工具。
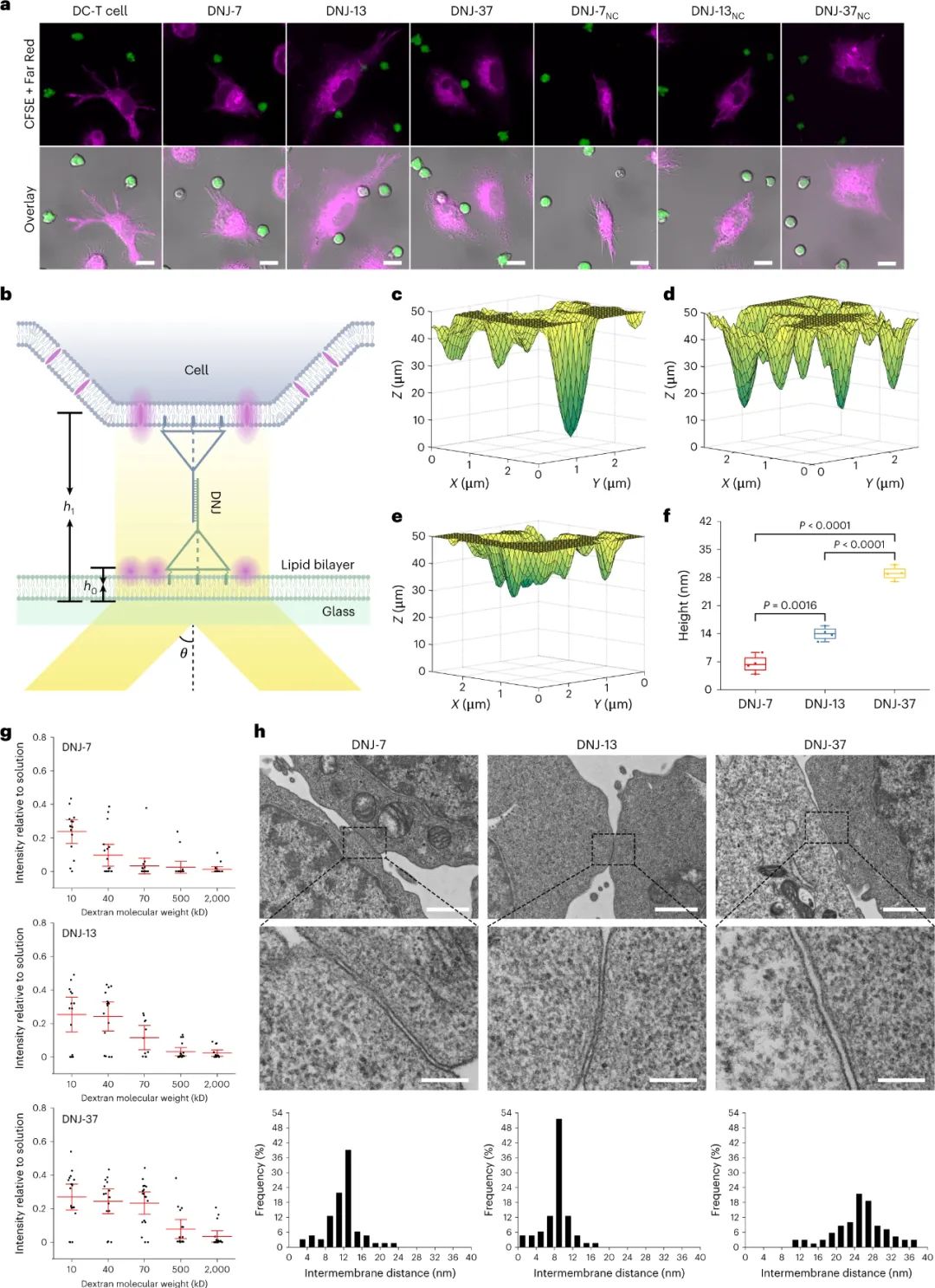
图|构建用于操纵膜间距的DNJ
使用DNJ调节T细胞活化
研究人员测试了四种卵清蛋白肽(N4、Y3、Q4 和 T4)作为与 DC 和 OT-I T 细胞的细胞相互作用系统的抗原信号。他们发现 Q4 诱导了恒定的 T 细胞刺激倾向,并被选为后续研究的抗原肽。接下来,他们测试了饱和表面密度的DNJs对T细胞活化的影响。他们发现,所有三个DNJs都增强了T细胞增殖,但DNJ-7引起了最高的增殖率,DNJ-13表现优于DNJ-37。研究人员还观察到,饱和表面密度的DNJs通过促进DC-T细胞粘附来促进T细胞刺激。
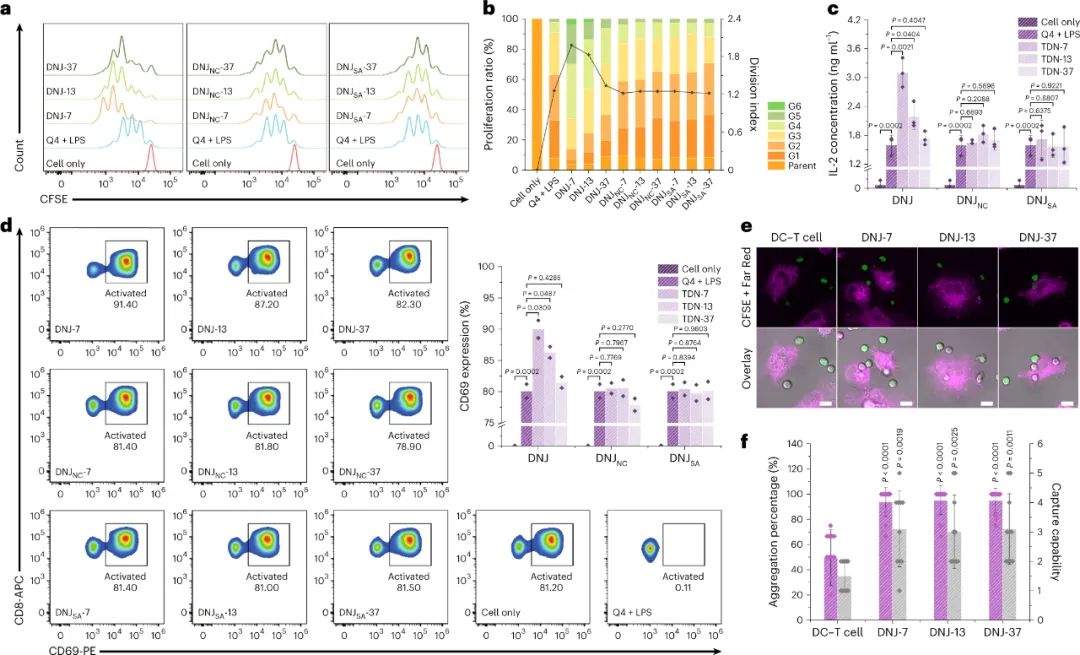
图|高密度DNJ对T细胞活化的影响
膜间距离介导的T细胞活化
随后研究人员使用 DNA 纳米技术研究了膜间距对 T 细胞活化的影响。通过滴定 DNJ对 DC 和 T 细胞的浓度,研究人员发现将 DNJ 浓度降低至≤10nM 可以消除细胞间粘附并为 T 细胞活化创造关键条件。他们还构建了一个人工 T 细胞激活系统,使用 SLB 包被的微珠和分裂 TDN 来控制具有时空精度的膜间距。实验表明,DNJ对T细胞激活的影响是通过调节间膜间距离实现的。
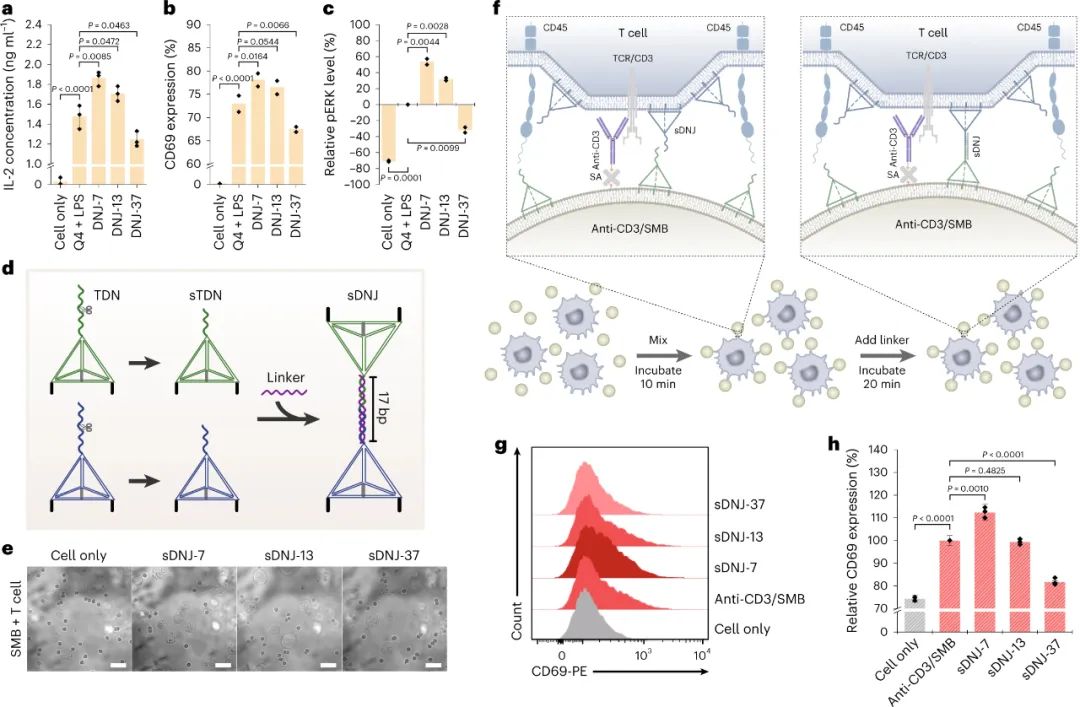
图|用DNJ介导的膜间距离调节T细胞活化
TCR信号传导的可能分子机制
研究人员通过在T细胞与树突状细胞之间接触区域添加不同大小的DNJs,研究了它们对T细胞信号传导的影响。实验结果表明,DNJ-7可以使接触区域的外围严格排斥CD45,并且还可以在不影响抗原结合的前提下将接触区域轴向压缩,从而增强T细胞信号传导。相比之下,DNJ-13可以稳定树突状细胞和T细胞之间的pMHC结合界面,从而实现更强的T细胞刺激。DNJ-37虽然能够拉伸接触区域,但不能有效地促进T细胞信号传导。这些结果表明,接触区域的尺寸和稳定性对调节T细胞信号传导至关重要。
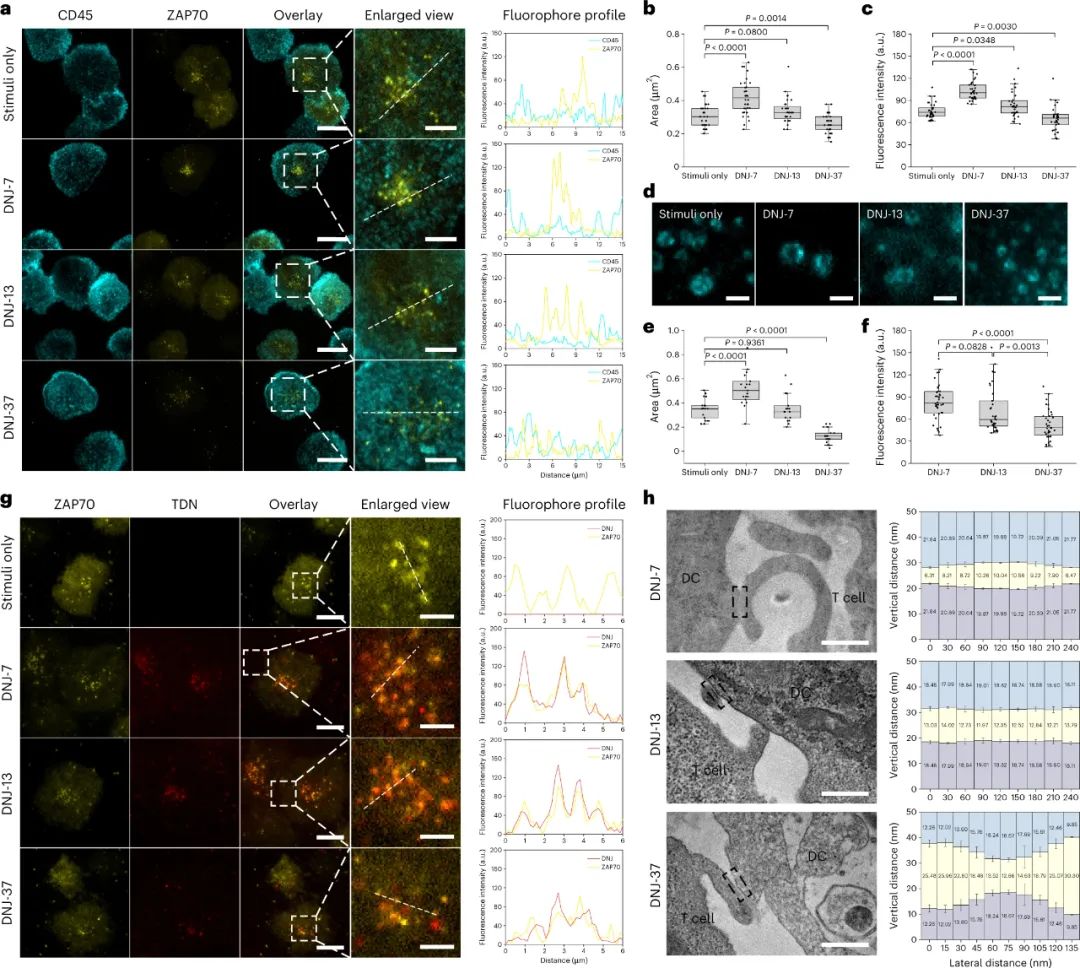
图|研究TCR信号传导的分子机制
小结:
通过使用胆固醇结合的 TDN 作为膜锚定支架,研究人员构建了不同大小的 DNJ,并在真实的 DC-T 细胞相互作用系统中操纵了 TCR-pMHC 维度周围的膜间距。与传统的基因工程策略不同,该系统不需要蛋白质修饰,并且这些 DNA 纳米结构可以高效快速地锚定在细胞膜上,对细胞环境的干扰最小。在临界低表面密度下,尺寸超过 TCR-pMHC 复合物尺寸的 DNJ-37 可以延长膜间距离,从而导致抑制 T 细胞触发,这可能是由于 CD45 分离阻碍所致。研究人员还使用小型 DNJ-7 压缩 DC-T 细胞界面,并实现了 T 细胞活化的改善,这可能是由于严格排除 CD45 和产生额外机械力的综合作用。总之,这些结果为我们提供了直接证据,证明紧密接触区的轴向尺寸在 T 细胞触发中起着重要作用。凭借缩短 DC-T 细胞界面的能力,表明可以将更广泛的研究窗口应用于 T 细胞免疫研究。
参考文献;
Du, Y., Lyu, Y., Lin, J. et al. Membrane-anchored DNA nanojunctions enable closer antigen-presenting cell–T-cell contact in elevated T-cell receptor triggering. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01333-2











