现代癌症治疗方法,如“靶向”药物或利用免疫系统的疗法,极大地推进了许多类型肿瘤的治疗选择。然而,化疗失败是治疗成功的一个关键限制因素。
近日,比利时布鲁塞尔自由大学Cédric Blanpain等人就为什么会出现这种治疗耐药性提供了一些原因。

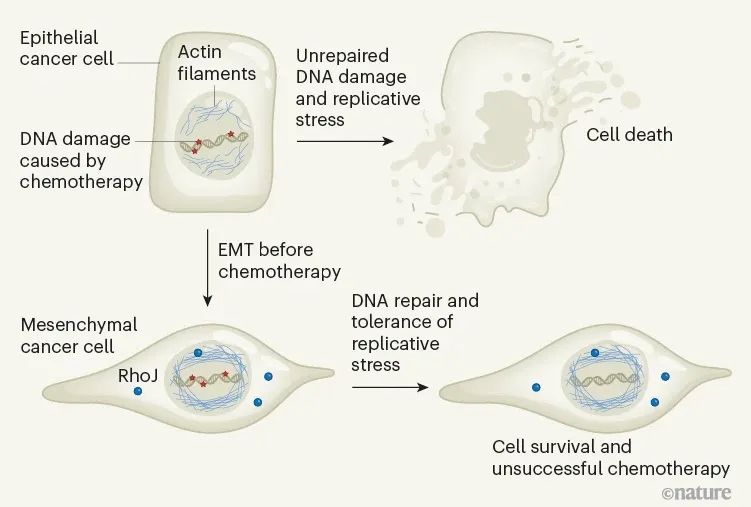
图|RhoJ蛋白和化疗失败
在由上皮细胞(排列在身体表面)引起的癌症中,治疗耐药性与一种称为上皮-间质转化(EMT)的过程密切相关。在EMT期间,上皮来源的癌症细胞逐渐失去其上皮特性,并获得另一种细胞类型的上皮特性,即间充质细胞。这些新获得的特性使癌症细胞能够侵入周围组织并扩散到身体的其他部位。
含有经历EMT的细胞的癌症与不良的临床预后相关,这通常由化学疗法抗性驱动。尽管已经确定了EMT支持癌症扩散的不同分子机制,但EMT在促进治疗抗性中的作用尚不清楚。
EMT对正常胚胎发育至关重要,并且在伤口愈合中起关键作用。但是上皮癌细胞可以利用其先天的能力进行EMT以变得可移动并逃离初始(原发)肿瘤部位。在EMT过程中,细胞发生广泛的形状变化,失去了沿细胞一个轴(顶端-基底极性)的特征的不对称性和细胞间接触。它们的代谢和转录特性也发生了惊人的变化。许多研究表明,这种由EMT驱动的重组可以促进对癌症药物的耐药性,例如通过上调耐药或细胞生存途径所需的基因。然而,许多这些研究的局限性在于它们是在体外进行的,并且通常不清楚所确定的细胞机制是否也会在体内驱动原发性肿瘤中EMT相关的治疗耐药性。
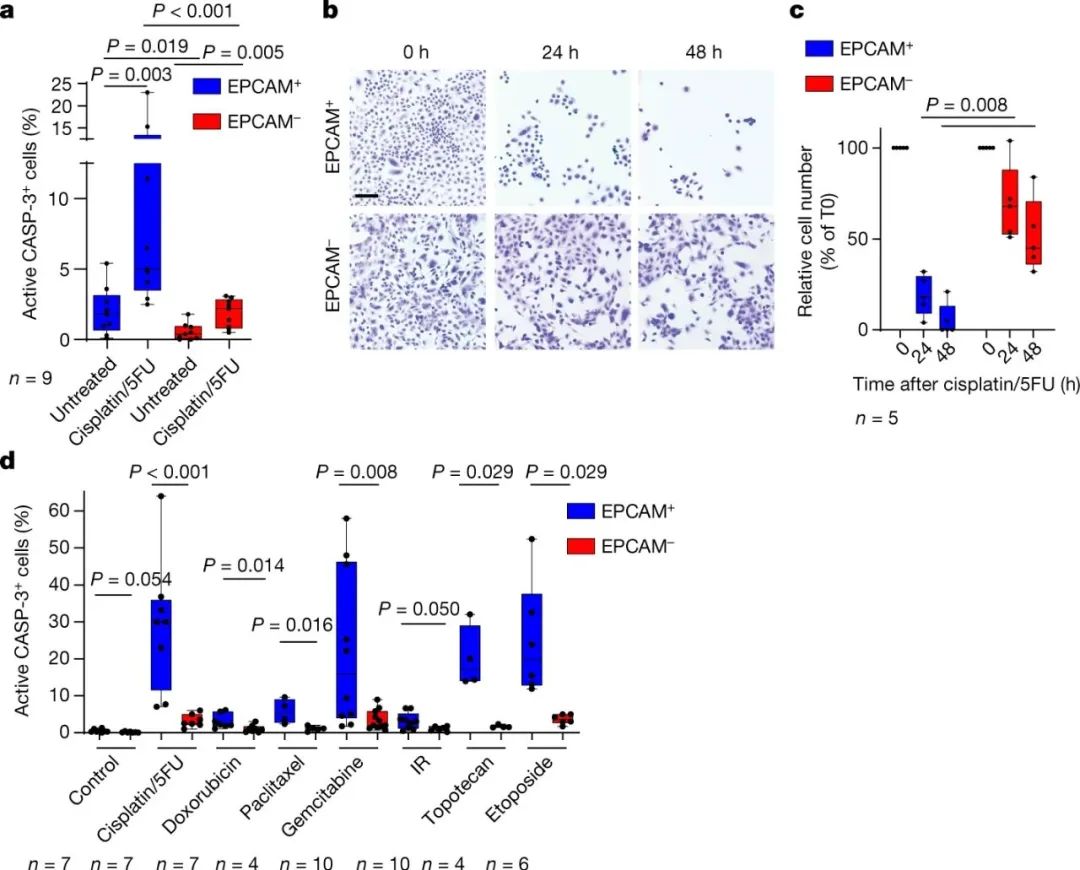
图|EMT与SCC对化疗的内在抗性有关
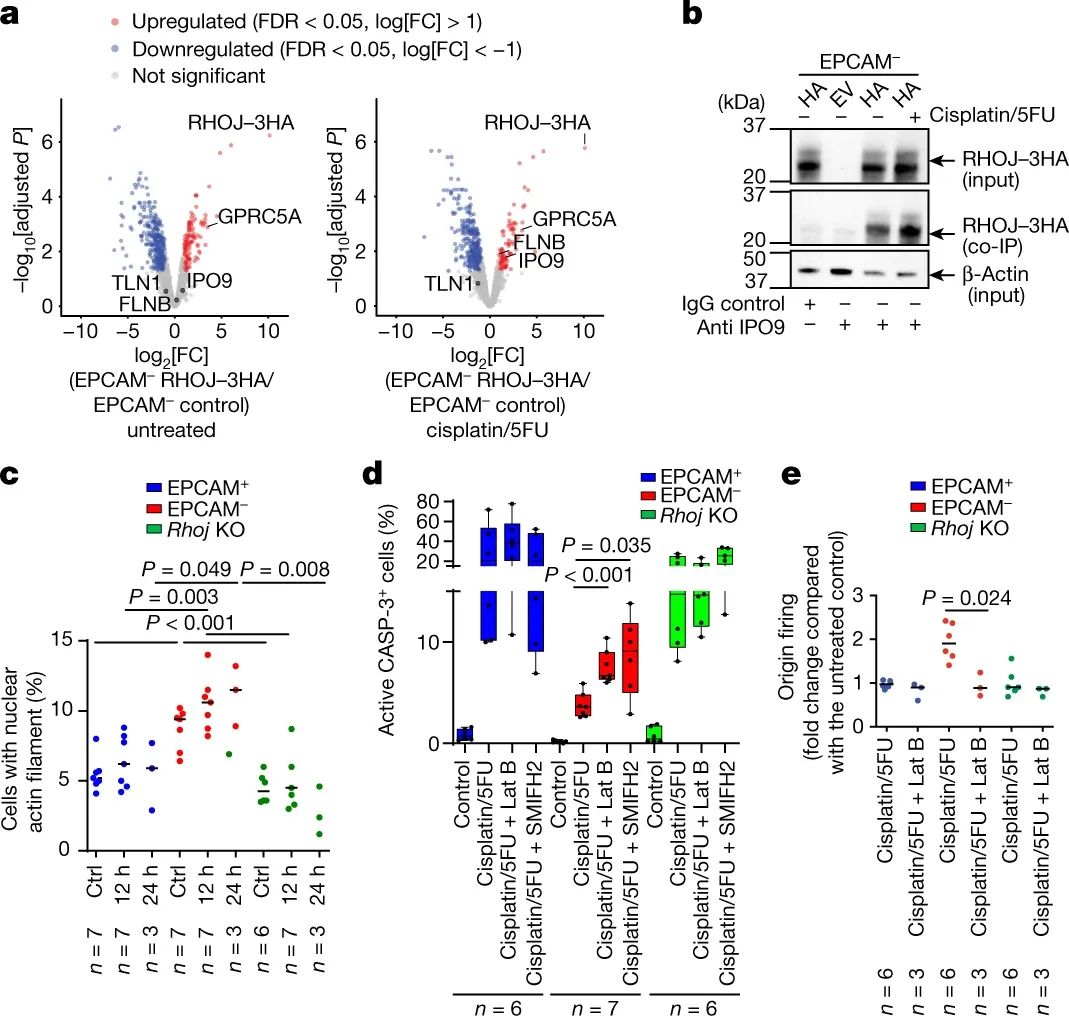
为了解决这个问题,该课题组研究了为什么原发性皮肤肿瘤中的EMT细胞在体内抵抗化疗。作者使用化疗药物顺铂和5-氟尿嘧啶的组合来治疗经过基因工程治疗的小鼠,这些小鼠会患上皮肤肿瘤。这种药物组合目前是治疗晚期皮肤癌症患者的标准化疗方法,它通过诱导DNA损伤来杀死癌症细胞。作者发现,32%的皮肤肿瘤对这种治疗没有反应,而这些耐药肿瘤中的大多数(70%)完全由经过EMT的细胞组成,这些细胞对药物诱导的细胞死亡具有内在耐药性。
研究人员发现了一种名为RhoJ的蛋白质是EMT相关化疗耐药的主要罪魁祸首。RhoJ属于称为Rho GTP酶的酶家族,其作为分子开关起作用。它们控制称为肌动蛋白丝的纤维子集的动态重组,肌动蛋白丝构成细胞内部结构(细胞骨架)的一部分。这些丝状蛋白质聚合物的重塑是与EMT相关的许多细胞形状变化的核心。尽管先前显示许多Rho GTP酶在癌症相关的EMT期间失调并且在癌症进展和扩散(转移)中起作用,但RhoJ的参与先前尚不清楚。作者表明,RhoJ在经历EMT的小鼠皮肤肿瘤细胞中特异性表达高于正常水平。RhoJ帮助EMT肿瘤细胞抵抗化疗药物造成的致命DNA损伤。
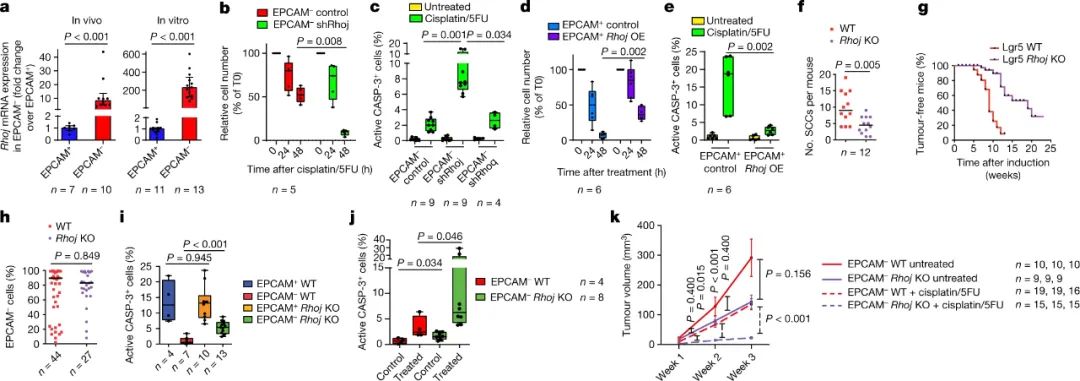
图|RHOJ介导对与EMT相关的化学疗法的抗性
研究人员进行了广泛的生物分子分析,以阐明RhoJ驱动化疗耐药的分子机制。其中,最引人注目的发现之一是RhoJ促进化疗后EMT肿瘤细胞中DNA损伤的修复和DNA复制的“休眠起源”的激活。休眠起源是复制基因组的细胞机器的备用起始位点。当DNA复制机器遇到障碍时,例如顺铂和5-氟尿嘧啶等药物诱导的障碍时,它们可确保及时复制DNA。
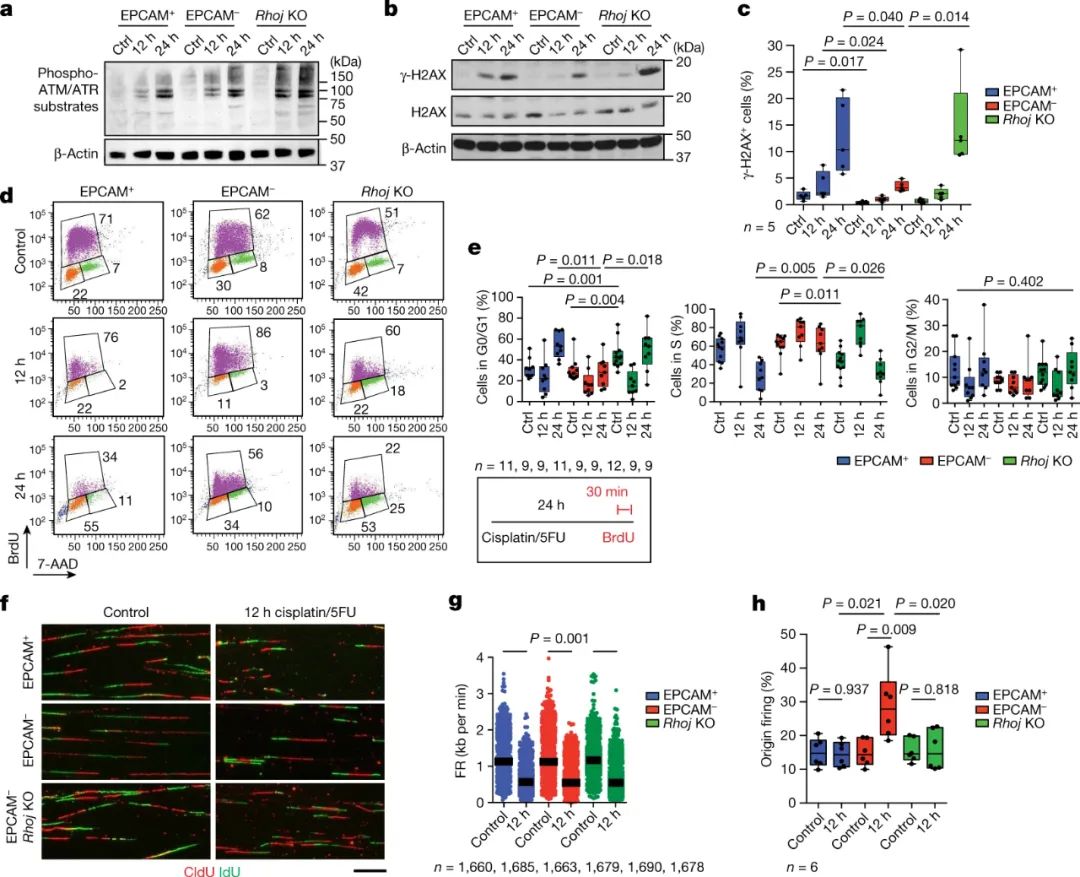
图|RHOJ促进EMT肿瘤细胞化疗后DNA修复和DNA复制新起源的激活
因此,用这些药物治疗导致缺乏RhoJ的EMT肿瘤细胞中的DNA损伤水平高于含有该酶的细胞中的DNA损伤水平,并且诱导DNA复制功能障碍(也称为复制应激)和相关问题的多种迹象。这些发现对于未来基于RhoJ的治疗方法是值得注意的,因为它们表明RhoJ通过使肿瘤细胞修复DNA损伤并耐受否则会杀死它们的复制问题来促进治疗抗性。
调节肌动蛋白丝动力学的信号蛋白RhoJ如何实现这种治疗抵抗?大量数据表明核肌动蛋白丝在指导DNA修复动力学中发挥作用。与此一致的是,研究人员表明,RhoJ介导的DNA修复和复制应激耐受确实取决于酶诱导核肌动蛋白丝形成的能力。
作者的发现将RhoJ依赖性肌动蛋白丝重塑与治疗抗性EMT肿瘤细胞中的基因组维持机制紧密联系起来。然而,这种肌动蛋白丝如何支持DNA修复和激活额外复制起点的精确分子细节仍有待阐明。可能的(而非互斥的)情况包括DNA损伤位点的肌动蛋白依赖性重定位和功能失调的DNA复制以修复细胞核中的感受态区域,特别是细胞核外周,以及肌动蛋白介导的复制和DNA修复因子在DNA上的负载。
该研究显著证明了体内癌症模型在剖析癌症治疗抵抗(尤其是EMT)背后的分子生物学方面的威力。然而,癌症模型的局限性可能是癌症的遗传多样性以及它们具有不同细胞起源的事实,这通常排除了对其生物学进行机械概括的可能性。
例如,RhoJ也在黑色素瘤皮肤癌症细胞中高度表达,在这种细胞中,它通过另一种机制促进对DNA损伤诱导剂的治疗抵抗:即,它禁用DNA损伤感知,从而避免转录因子蛋白p53诱导的细胞死亡。该研究使用的皮肤癌症模型缺乏p53,这可能解释了作者发现的不同RhoJ-相关治疗耐药机制。
这些发现突出了应对临床上遇到的一系列分子肿瘤亚型的挑战。未来的研究应该解决RhoJ依赖性DNA修复和复制应激耐受是否会导致其他EMT相关癌症对DNA损伤诱导化疗药物的耐药性。
鉴于细胞骨架重塑在癌症进展和转移中的重要作用,Rho GTPases(如RhoJ)构成了有希望的化疗靶点,尤其是对目前治疗耐药的癌症。尽管鉴定靶向Rho GTP酶或其下游蛋白的临床有效抑制剂已被证明具有挑战性,但一些化合物和先导药物显示出了前景。他们的发展应该继续成为基础和临床癌症研究的目标。
参考文献:
Debaugnies, M., Rodríguez-Acebes, S., Blondeau, J. et al. RHOJ controls EMT-associated resistance to chemotherapy. Nature (2023).
https://doi.org/10.1038/s41586-023-05838-7











