有效的宿主防御依赖于产生依赖于环境的免疫反应的能力。树突状细胞(DC)感知病原体和组织损伤,随后迁移到淋巴结,向幼稚T细胞呈递抗原。通过产生细胞因子,DC进一步指导其他免疫细胞需要哪种类型的免疫反应。例如,皮肤中DC衍生的白细胞介素-23(IL-23)促进了对白色念珠菌和金黄色葡萄球菌感染的有效防御,但它也会引起银屑病样皮肤炎症。
痛觉感受器是一种体感神经元,它支配屏障器官并检测有害刺激,包括机械损伤、反应性化学物质、炎症介质和病原体。痛觉感受器将痛觉性刺激作为疼痛或瘙痒感传递给大脑,并释放神经肽,从而影响免疫细胞。尽管已显示痛觉感受器在几种病理生理环境中对DC施加控制,但痛觉感受器–DC串扰的分子机制以及痛觉感受器参与DC免疫生物学的全部范围仍有待确定。
为了确定痛觉感受器和DC之间的交流框架,哈佛医学院Ulrich H. von Andrian等研究人员为这两种细胞类型建立了体外共培养系统,使得能够在不涉及其他细胞类型的情况下询问真正的痛觉感受器-DC相互作用。

研究人员探讨了痛觉感受器对激活和稳态DC的影响,并在分子水平上定义了依赖于物理细胞间接触或痛觉感受器衍生的可溶性介质的通讯途径。随后,研究人员调查了还原剂体外系统中的关键观察结果是否可以预测几种体内情况下的痛觉感受器-DC交流。
研究人员确定了痛觉感受器用于控制DC功能的三种分子不同的通信方式。
1)首先,通过趋化因子CCL2的产生,痛觉感受器可以吸引DC并调节其组织停留时间。
2)其次,通过神经肽降钙素基因相关肽(CGRP)的激活诱导释放,痛觉感受器在DC中诱导转录程序,其特征在于Il1b的表达以及对病原体抗性和前哨功能重要的多个其他基因,但是没有明显的DC激活。
3)第三,通过直接电耦合,刺激痛觉感受器触发DC中的Ca 2+通量和膜去极化,并增强DC对炎性刺激如Toll样受体(TLR)激动剂的反应。
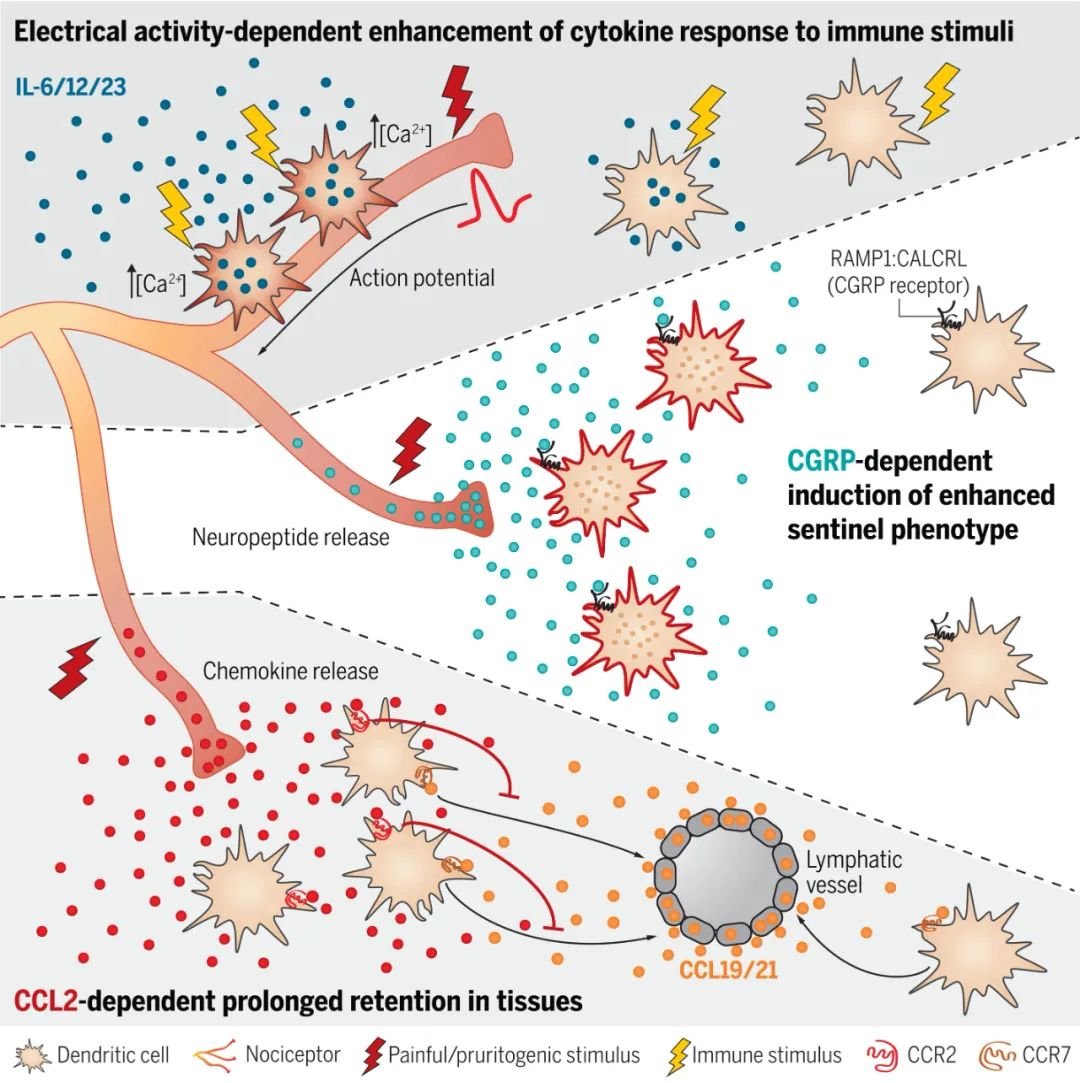
图|痛觉感受器使用三种不同的途径与树突细胞(DC)通讯
因此,在没有免疫刺激的情况下,真皮痛觉感受器的体内激活增强了DC的前哨表型,并放大了对TLR激动剂的DC依赖性组织炎症。此外,痛觉感受器中CCL2的条件消融损害了真皮DC放大皮肤局部炎症和启动针对皮肤衍生抗原的适应性免疫反应的能力。
这里描述的多种交流方式揭示了痛觉感受器和DC如何形成神经免疫单元,其将痛觉感受器的快速反应性和精细磨练的感知和响应有害刺激的能力与DC协调先天性和适应性免疫应答的能力相结合。独特功能的这种合并使痛觉感受器-DC单元可以充当高级预警系统。因此,屏障组织中的DC预先准备好预测即将到来的病原体相遇,在痛苦的病原体暴露后做出更有力的反应,并微调随后对外周抗原的适应性免疫反应的协调。
参考文献:
Multimodal control of dendritic cell functions by nociceptors. Science 2023.
https://www.science.org/doi/10.1126/science.abm5658











