特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。现状
将乙烯转化为乙醛的Wacker过程是基于过渡金属催化的最重要的工业过程之一,PdII催化氧化过程广泛应用于生物活性分子的合成(图1A)。大量的工作致力于逆转羟基烯烯化的区域选择性,并研究了将终端烯烃转化为醛的条件。然而,该反应通常提供两种区域异构酮的混合物,除非相邻的螯合基团可以指导羟酰化过程。Grigg等报道了亚甲基环丁烷在典型的Wacker条件下转化为环戊酮(图1B),但也描述了亚甲基环丁烷向环戊酮的环膨胀,且底物范围非常有限。
启发新思路
羰基在生物活性天然产物中的普遍存在及其合成的多功能性,开发一种允许将1,1-二取代烯烃转化为重新排列的酮的通用方法将具有广泛的用途。鉴于此,洛桑联邦理工学院祝介平教授等报告了一种不使用不稳定和危险试剂,将多种功能化的末端烯烃转化为重排的酮和将亚甲基环烷烃转化为环扩张的环烷烃的方法,包括大环烷烃的实现。从Wacker条件下的PdII/0催化循环转移到PdII/IV化学,利用向性重排的工作原理(图1C),按照Markovnikov规则对烯烃5进行羟基化反应,可得到相当稳定的新戊基σ-PdII配合物,在适当的氧化剂存在下,该配合物可原位氧化为PdIV物种。论文以《Oxidative rearrangement of 1,1-disubstituted alkenes to ketones》题发表在Science上。

反应的发展
使用7-亚甲基三氯乙烯(11a)作为测试底物,通过系统地改变Pd(II)源、氧化剂、温度、溶剂和配体来考察条件。在室温条件下,在MeCN/H2O (v/v=4:1)中,选择1-chloromethyl-4-fluoro-1,4-diazoniabicyclo[2.2.2]octane bis(tetrafluoroborate)和Pd(MeCN)4(BF4)2催化可使12a重排酮的产率达到75%。其他氟基氧化剂则效率很低,最多只能提供不到10%的产率。2-己辛烷-1,2-二醇和2-己基-2-羟基-三氟乙酸辛酯的分离清楚地表明反离子(X)在决定PdIV物种反应途径中的重要作用(图1C)。其他PdII盐,如Pd(OAc)2, Pd(OCOCF3)2和PdCl2比Pd(MeCN)4(BF4)2催化效率低。
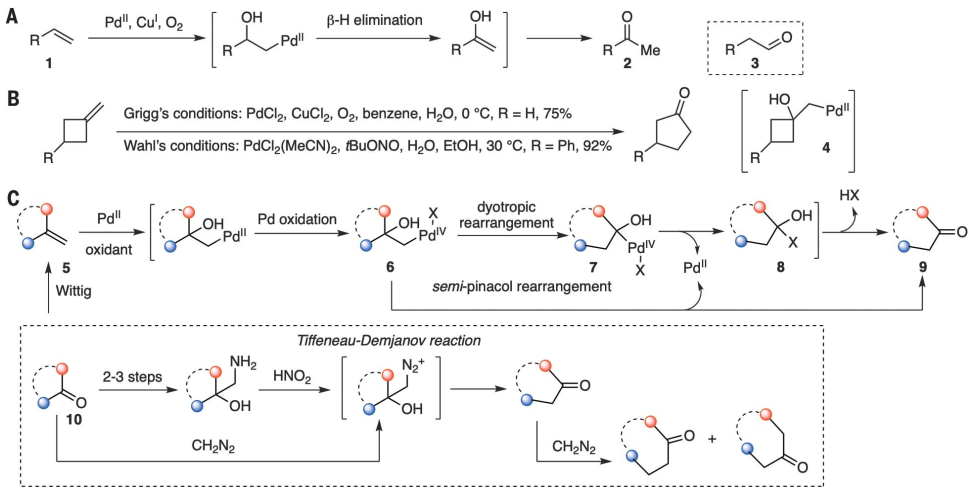
反应范围
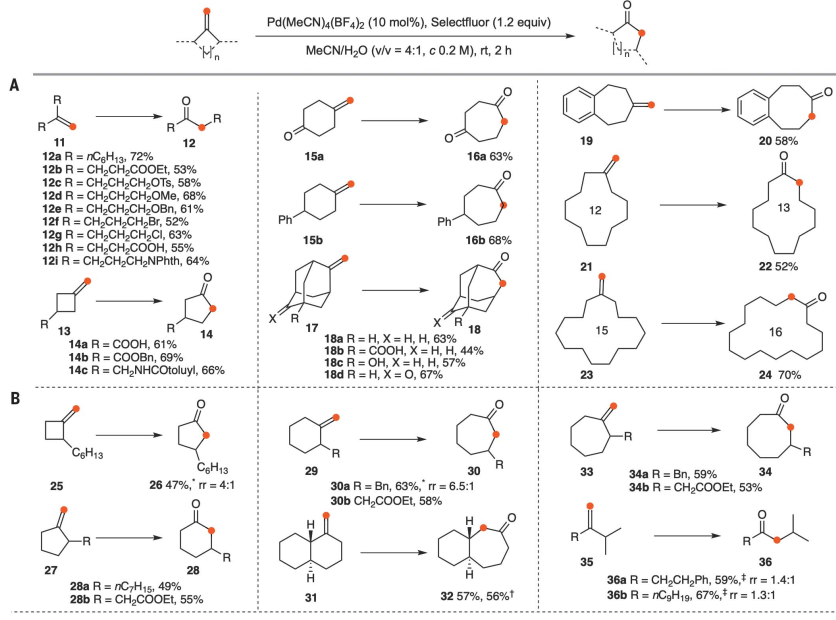
确定了最佳条件后,考察了具有不同官能团的对称1,1-二取代烯烃以测试反应范围(图2A),发现产率良好。除了应变的亚甲基环丁烷(13a-13c)的单碳环膨胀,如预期的那样得到了环戊酮14a-c,功能化的亚甲基环己烷(15a-b)的环膨胀同样进行得很好,得到了七元环庚酮16a-b。进一步研究了不对称1,1-二取代烯烃(图2B)。2-取代环烷烃-1-酮通常通过Tiffeneau-Damjanov反应和重氮甲烷加成法低选择性地转化为两个环放大酮的混合物,而线性不对称的末端烯烃以低选择性氧化重排为酮。线性不对称末端烯烃的低区域选择性促使研究常见有机官能团的定向效应。羧酸易于获取和转化,被认为是一个理想的候选人。当4-甲基戊烯-4-烯酸(37a)在标准条件下反应时,主要产物是羧基乙基迁移产生的5-氧己酸(38a, 72%)。在羧酸中引入取代基α提高了区域选择性(38b-c): 38c的分离率为90%。同样,环戊烷羧酸、环己烷羧酸和N-Ts哌啶-3-羧酸衍生物(39a-c)被重排成相应的δ-氧羧酸(40a-c),产率和区域选择性都很好。当C sp2的两个取代基都是仲烷基时,具有羧酸功能的取代基再次表现出更高的迁移能力,分别导致42和44的产率和选择性都很好。苯乙烯衍生物47a-b转化为两个区域异构酮48a-b的混合物,由于苯基本质上具有较高的迁移能力,因此具有较低的选择性。而苯乙烯衍生物49a-b则完全由于2-羧基苯基的优先迁移而转化为50a-b。苯基的高迁移性和羧基的定向作用在这种情况下协同作用,表明精选氟在普遍性方面仍然是一种优越的氧化剂。此外,在只有1.0 mol %的Pd(MeCN)4(BF4)2的存在下,以6 mmol规模进行39a的反应,可得到40a,收率89%,表明了该方案的实用性。
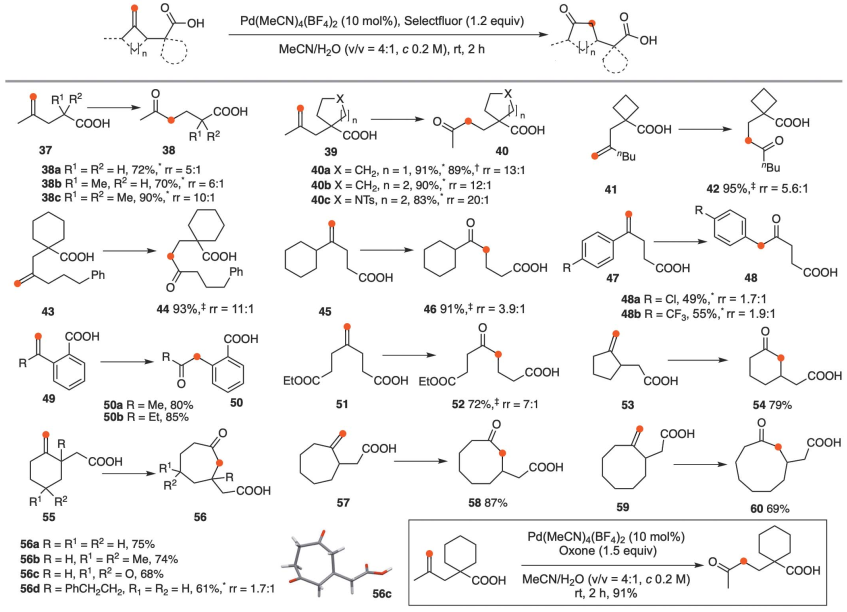
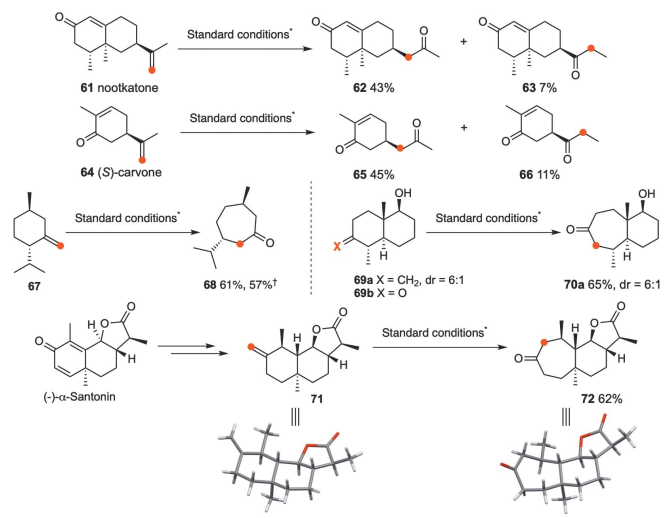
在标准条件下,诺卡酮(61)转化为62(43%)和63(7%)两个异构酮,(S)-香芹酮(64)转化为65(45%)和66(11%)(图4)。由L-menthone衍生的67和双环化合物69a分别产生68(61%)和70a(65%),这是由于叔烷基的选择性迁移。使用重氮甲烷法,酮69b中的羟基必须被保护以避免分解,并且在各种条件下形成了两个重排酮的混合物。最后,对α-三冬素衍生物71进行区域选择性环扩大,得到72,产率62%。从71和72结构可以看出,烷基基团在保持其绝对构型的同时发生了移位,说明了一个协同迁移过程。
机理研究
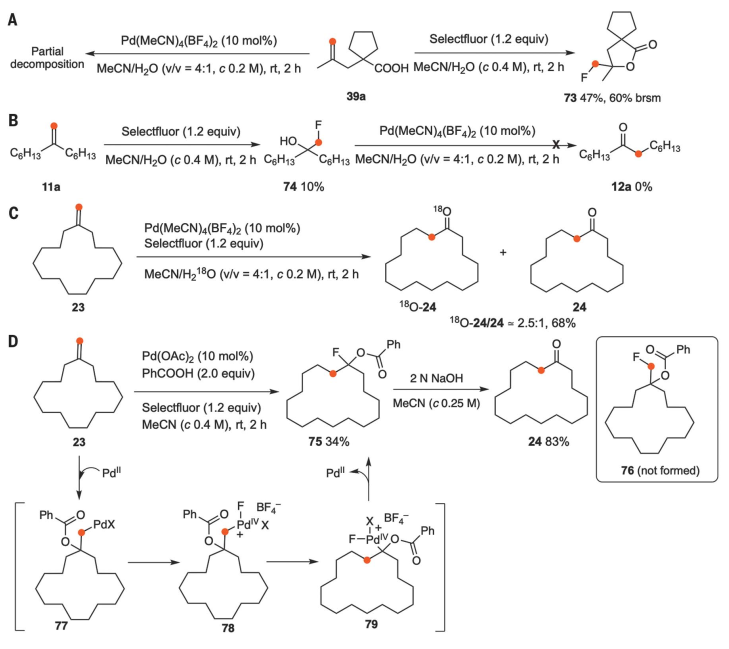
进行了对照实验为深入了解反应机理。在没有Selectfluor的情况下,在其他标准条件下,化合物39a被部分分解,而没有形成重新排列的酮40a。另一方面,在室温下,在没有Pd盐的情况下,用Selectfluor搅拌39a的MeCN/H2O溶液,可得到产率为47%的氟代化产物73(图5A)。7-(氟甲基)三叉戟-7-醇(74)是通过选择性氟介导的烯烃11a的分子间羟基氟化反应制备的,未能得到重排的酮(图5B)。结果表明:选择氟和PdII盐都需要进行本反应,氟化醇74不是重新排列的酮12a的中间产物。NMR谱表明Selectfluor与Pd(MeCN)4(BF4)2在室温下不发生反应,表明PdIV物种是在烷基alkylPdII中间体生成后形成的。用18O标记的H2O (97% 18O)取代H2O,亚甲基环十五烷以68%的收率转化为环十六烷,表明水是氧气的来源(图5C)。最后,在催化量Pd(OAc)2的存在下,搅拌23,苯甲酸和Selectfluor的乙腈溶液,得到环膨胀产物75(收率34%),皂化后转化为24。在这些条件下,未观察到由烯烃氟化反应产生的化合物76。表明,在1,1-二取代烯烃氧化转化为重排酮的过程中,向力重排可能是一个可能的反应途径。
小结
研究开发了PdII催化的1,1-二取代烯烃氧化转化为重排酮。该反应既适用于线型末端烯烃,也适用于亚甲基环烷烃,与烷基卤代烃、芳基卤代烃、烷基tosylate、羟基、羧酸、酯、内酯、酰胺、酮、α,β-不饱和酮等多种官能团兼容,为产品提供进一步的化学转化。https://www.science.org/doi/10.1126/science.adg3182Qiang Feng et al. Oxidative rearrangement of 1,1-disubstituted alkenesto ketones.Science, 379: 1363-1368.DOI:10.1126/science.adg3182












