尽管纳米技术和生物医学工程取得了显著进步,但目前只有少数可注射的医用纳米载体 (NC) 可用于癌症诊断和治疗。这主要是由于 NC 在正常器官中的脱靶积累和长期保留引起的潜在毒性问题。非肾脏可清除的粒径(>10nm)可能导致不受控制的分布曲线,这是传统NCs利用增强的渗透性和保留效果的主要先决条件。由于临床转化率有限,这种老式的NC设计面临着向肾脏可清除的超小纳米平台的范式转变,与非肾脏可清除的对应物相比,它有几个优点:(1)通过尿液排泄迅速消除分布在非靶向组织的NC,(2)肿瘤血管的高渗透性,以及(3)单核吞噬细胞系统的吸收高度减少。这些有利的特点使得大剂量给药的细胞毒性货物分子具有更高的肿瘤选择性,从而提高疗效,并将不良反应降至最低。
然而,肾脏可清除的NCs并不是没有缺点,阻碍了它们的临床转化。一个主要的缺点是微量注射的NCs造成的残留毒性,它可能面临不经意的慢性积累。尽管有短期的生物相容性,但长期或终身暴露于不可降解的外来材料,如二氧化硅、金属和合成聚合物纳米颗粒,使其临床使用受到阻碍。为了解决这个问题,报道了由可生物降解的有机材料(包括β-环糊精(CD)接枝的聚赖氨酸)组成的可肾脏清除的NCs,即H-Dots,显示了高效的肿瘤靶向药物输送和低背景组织保留。然而,这些NCs的肿瘤选择性主要是由于它们在正常组织中的停留时间大大减少,而不是增强了肿瘤的归宿能力。这表明,通过延长肾脏可清除的有机NCs的肿瘤保留时间,可以实现更高的肿瘤选择性。虽然靶向配体可以被引入到NC结构中,但这种所谓的主动靶向策略并不总能确保提高选择性,会意外地诱导调理作用和随之而来的脱靶积累,主要是通过单核吞噬细胞系统的摄取。因此,要想在临床上取得成功,需要对最佳的NC结构进行微妙的调整,平衡肾脏可清除NC的靶向效率和非靶向积累。
结直肠癌(CRC)是第三大最常见的诊断癌症,其死亡率位居第二。手术切除后的辅助化疗(ACT)是目前治疗II期和III期CRC的主要方法。然而,化疗药物的严重毒性往往限制了化疗的有效性,即使是使用小剂量的各种药物进行联合治疗。这种情况需要创新的方式来改善或取代现有的ACT治疗方案。
鉴于此,首尔大学Dae-Duk Kim、忠南大学Jae-Young Lee等人报道了肾脏可清除的 CD 纳米平台的开发,该平台可以促进肿瘤保留,而不会在 CRC 治疗中引起成像和治疗剂的任何脱靶积累。

首先,研究人员设计和合成了20种不同的环糊精衍生物(CD 1-20),通过改变环糊精和谷氨酸之间的连接部分(P2)、谷氨酸和苯硼酸(PBA)之间的连接部分(P3)以及连接至谷氨酸链接部分上的带电基团,设计了不同的衍生物结构。通过荧光素酰胺试验和1H NMR分析证实,这些带电基团成功地与环糊精衍生物结合成CD 16-20。接着,对这些环糊精衍生物进行了胶体稳定性筛选,最终选出了CD 16-20,并通过对其颗粒大小和电荷进行测量,CD 16-20 衍生物在体内的尺寸为5-6.6nm,同时它们的带电特性与修饰基团相对应,证明这些衍生物具有高的胶体稳定性和肾脏清除能力,适合作为靶向药物载体进行静脉注射。
研究人员探讨了不同CD衍生物与ACy7的包合物的生物分布情况。在小鼠实验中,与自由ACy7相比,这些载药复合物的靶向性更强,肝脏和肺部的积累减少,肾脏的选择性增强,同时增加了肿瘤的分布效率。其中,带有PBA基团的CD衍生物CD17/ACy7在肿瘤组织中的积累水平最高,是一种潜在的肿瘤靶向治疗药物。PBA- (ZW)-CD 被选为优化的肾脏可清除 CD 衍生物用于进一步研究。
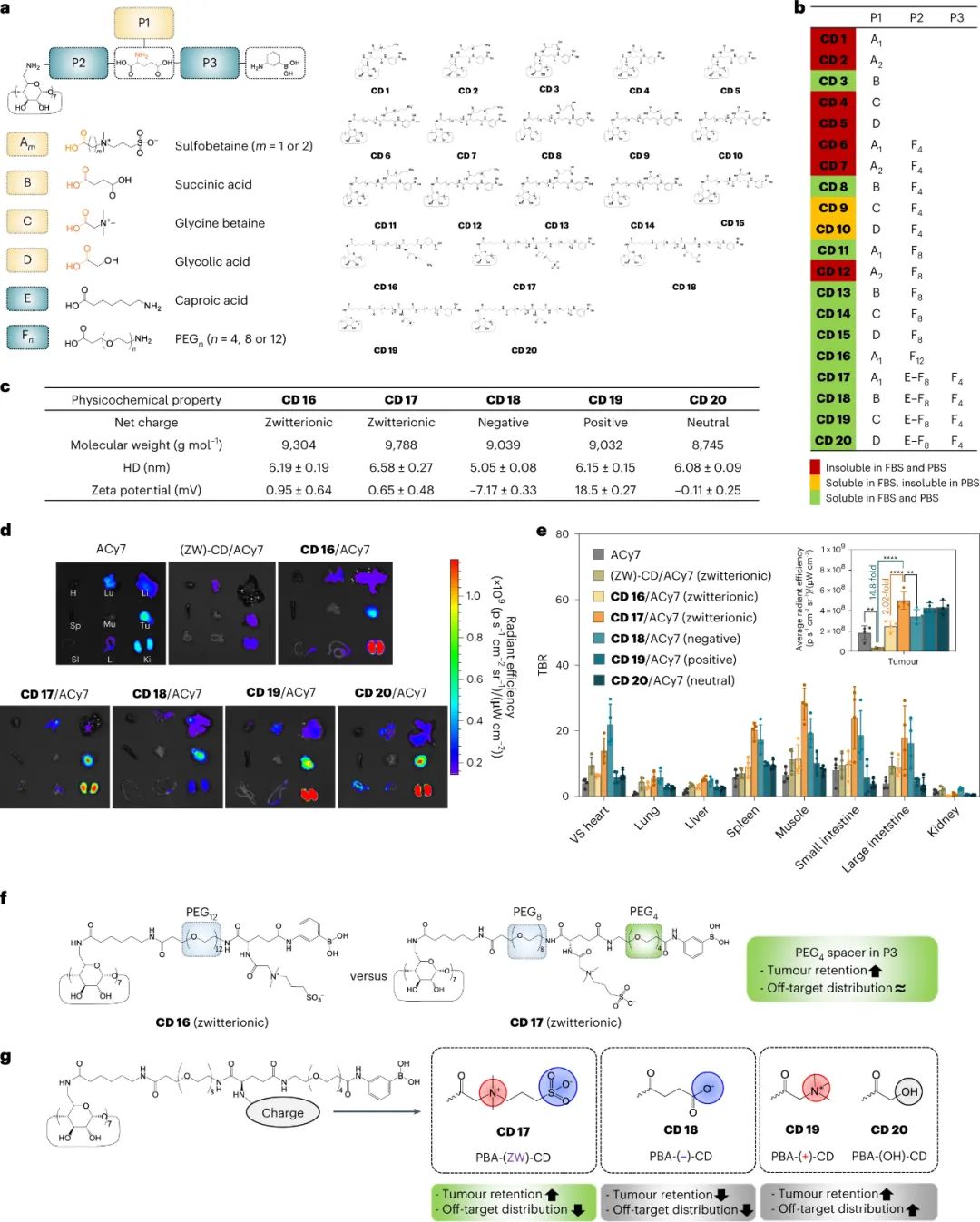
图|肾脏可清除的CD衍生物,可增强肿瘤滞留并减少脱靶积聚
然后,研究人员探讨了PBA-(ZW)-CD/ACy7的肿瘤靶向性和生物分布。实验结果表明,PBA-(ZW)-CD/ACy7可以通过PBA-唾液酸相互作用靶向肿瘤,并且PBA-(ZW)-CD分子中的磺酸盐基团可以减少其与正常组织的非特异性结合,从而提高了药物的靶向性。实验还表明,PBA-(ZW)-CD/ACy7在小鼠模型中可以被快速分布到全身,经肾脏排泄后选择性地积聚在肿瘤组织中,从而可以用于肿瘤手术的辅助成像,提供准确的肿瘤切除范围。此外,PBA-(ZW)-CD/ACy7的药代动力学研究表明,PBA-(ZW)-CD分子还可以促进药物分子的肾脏排泄,减少其在正常组织中的滞留。
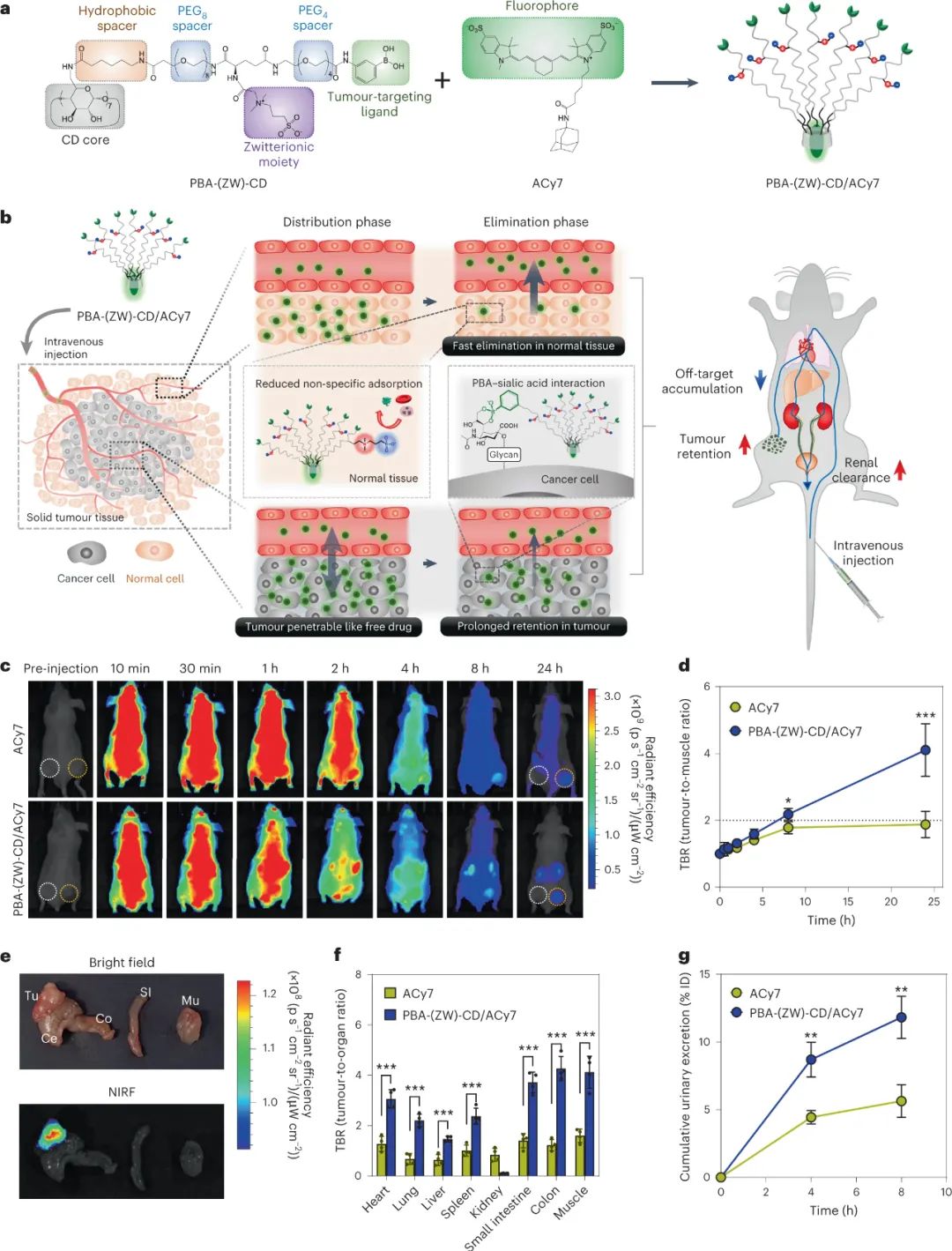
图|PBA-(ZW)-CD/ACy7的肿瘤靶向性、药代动力学和尿液排泄
研究人员使用PBA-(ZW)-CD制备了包含两种化疗药物多柔比星(DOX)和乌利司他(UXT)的复合物,以评估其在结直肠癌治疗中的潜力。实验发现,PBA-(ZW)-CD/DOX的平均水合直径(HD)在pH 7.4下为13.04±3.85 nm,而在pH 5.5下下降至7.09±0.26 nm。PBA-(ZW)-CD/UXT在pH 5.5和pH 7.4下的平均HD分布相似,均为6.30±0.11 nm和6.30±0.09 nm。PBA-(ZW)-CD/药物显示出pH依赖性释放特性,这可能转化为对肿瘤组织的选择性药物暴露。另外,包合物的ζ电位在酸性pH下增加,这归因于客体药物的电离,而在pH 7.4下保持带电性和双性离子性。
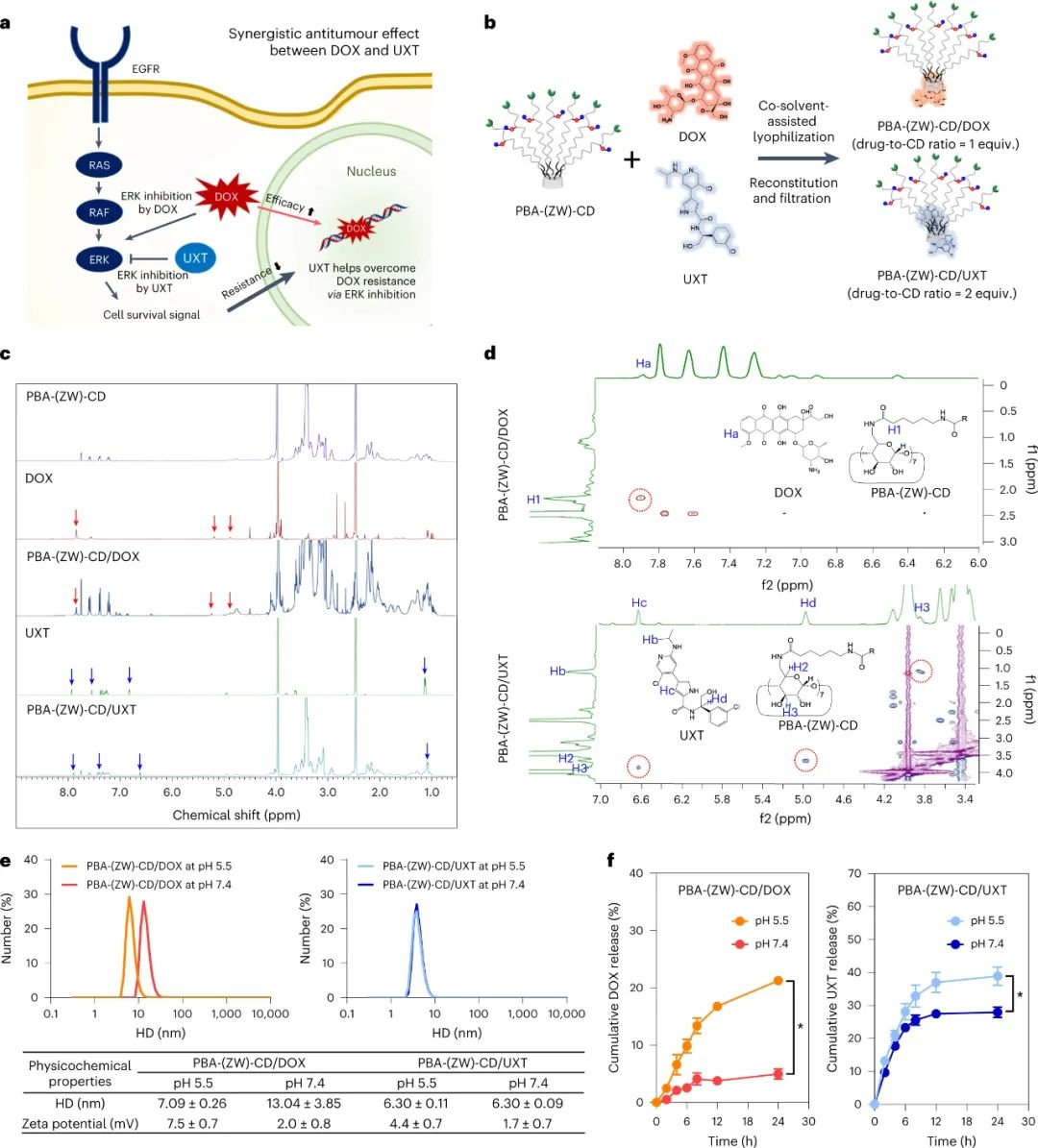
图|PBA-(ZW)-CD/药物包合物的制备和表征
随后,研究人员研究了PBA-(ZW)-CD/药物复合物的生物分布,并将其与自由药物进行了比较。结果表明,与自由药物相比,PBA-(ZW)-CD/DOX处理组的DOX在非靶组织中的暴露显著降低。此外,PBA-(ZW)-CD可以增强肿瘤组织对DOX和UXT的保留能力,同时降低药物在正常组织中的分布。PBA-(ZW)-CD/药物复合物可以像游离药物溶液一样容易地穿透肿瘤微环境,促进药物在整个肿瘤组织中的均匀输送。
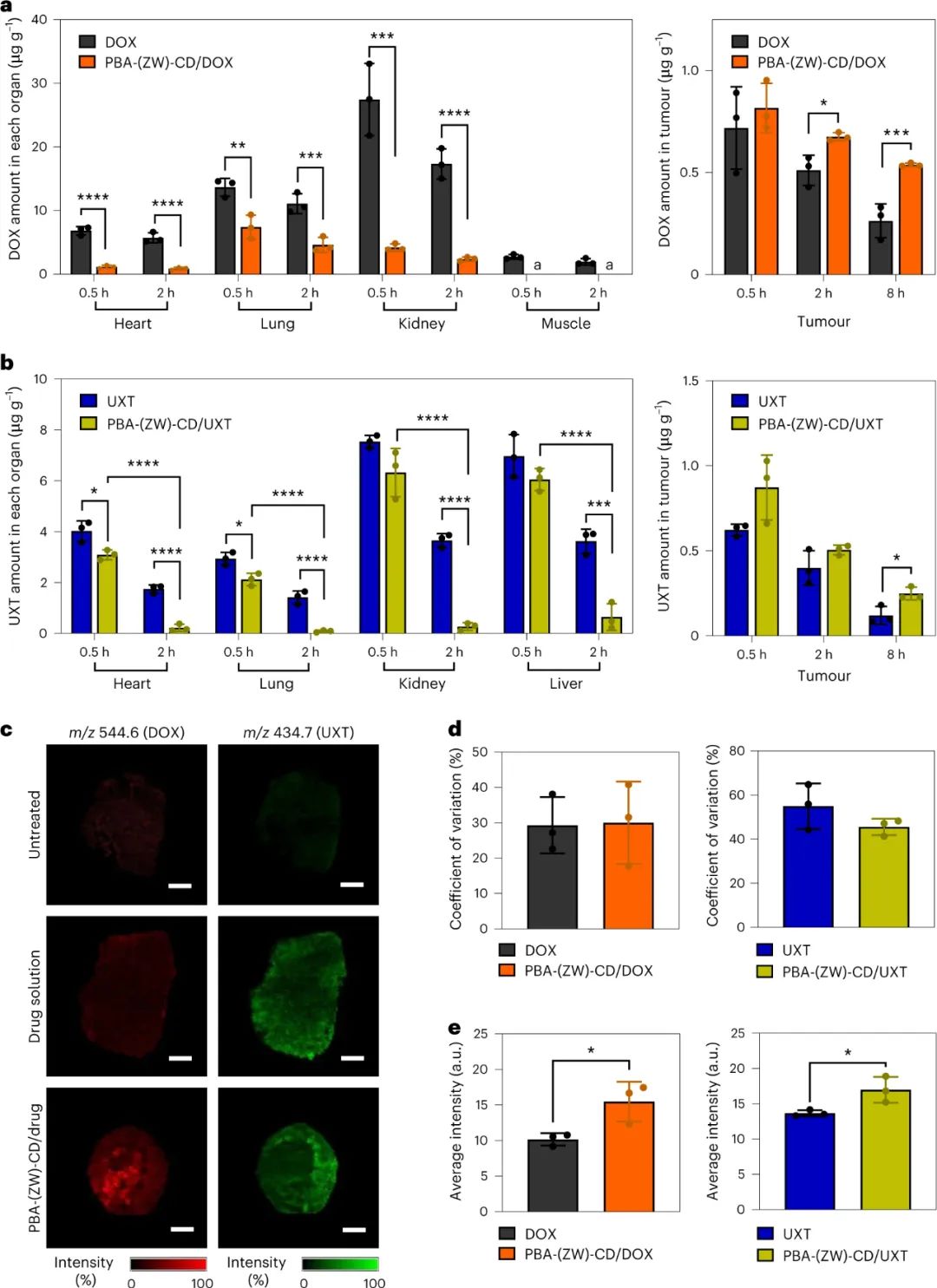
图|PBA-(ZW)-CD/药物包合物的生物分布
最后,研究人员利用PBA-(ZW)-CD/drug配合物来增强化疗药物DOX和UXT的治疗效果。实验结果显示,与单独使用药物相比,PBA-(ZW)-CD/drug复合物显著提高了抗肿瘤效果,同时减少了DOX对正常器官和免疫细胞的毒性,因为PBA-(ZW)-CD改善了DOX的分布。联合疗法的实验结果表明,PBA-(ZW)-CD/drug复合物对抑制肿瘤生长的效果明显优于单独使用药物,并且未发现明显的系统毒性。在一个模拟大肠癌的小鼠模型中,联合疗法的抗肿瘤效果也得到了验证,同时减少了腹膜转移的发生。实验结果还表明,PBA-(ZW)-CD可以降低化疗药物的毒性,减轻患者的不良反应,具有潜在的临床应用价值。
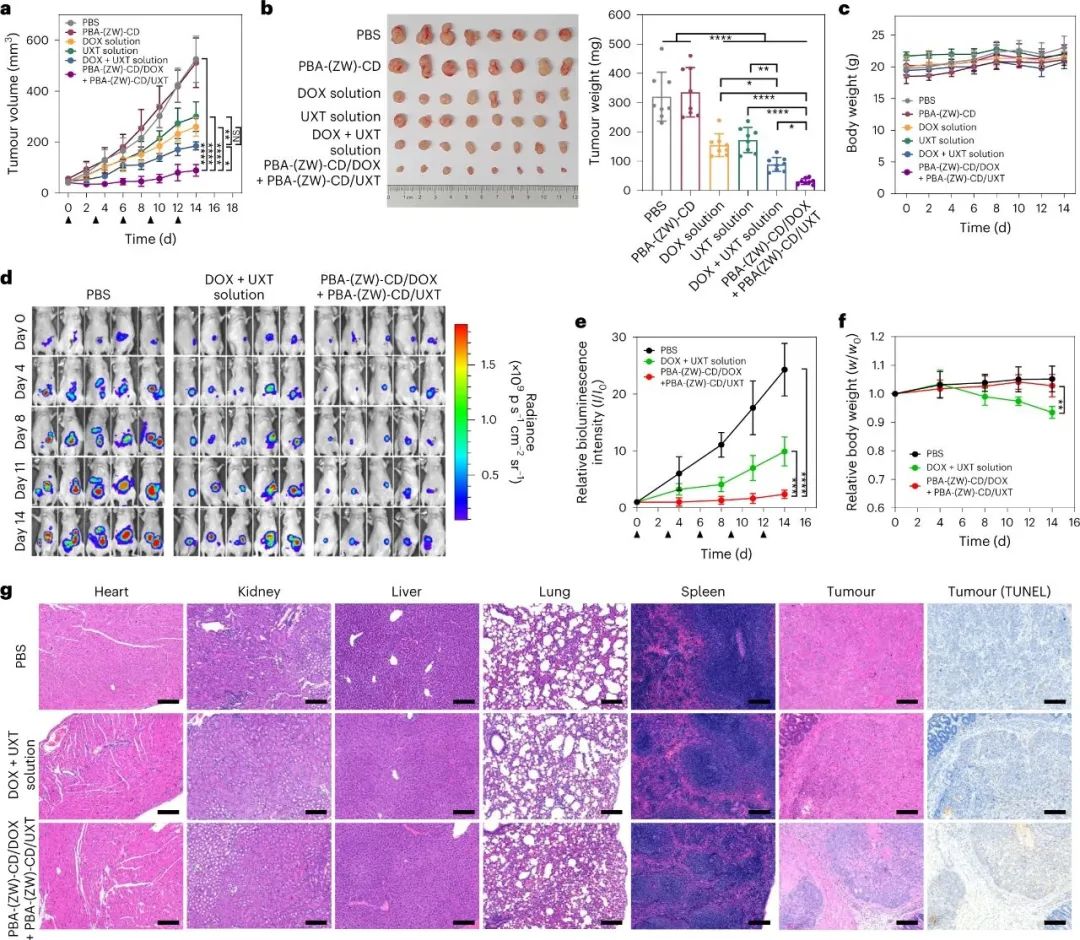
图|CRC模型中的PBA-(ZW)-CD/药物辅助联合治疗
综上所述,研究人员提出了一种精心设计的肾脏可清除两性离子 CD,即 PBA-(ZW)-CD,用于CRC 选择性成像和药物输送。总而言之,PBA-(ZW)-CD 可作为一种有前途的 CRC 靶向纳米平台,具有很高的临床转化潜力。
参考文献:
Baek, MJ., Nguyen, DT., Kim, D. et al. Tailoring renal-clearable zwitterionic cyclodextrin for colorectal cancer-selective drug delivery. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01381-8











