慢性炎症以免疫细胞和组织细胞相互作用为特征,不可逆转地损害身体组织,是心血管疾病、糖尿病和癌症等一系列疾病的关键危险因素之一。治疗慢性炎症性疾病的一个主要挑战是开发合适的治疗方法,以特定部位的方式安全、具体地直接解决炎症。常用的抗炎药(如糖皮质激素)具有多效性,非特异性影响多种途径并因此伴有毒性、耐药性和各种严重不良反应的问题。此外,全身免疫调节会导致高血压、骨质疏松症、肥胖、白内障和糖尿病等疾病。通过细胞因子阻断、细胞耗竭或细胞表面受体阻断起作用的生物免疫抑制药物可提高特异性,并可有效调节免疫应答以阻止某些(但不是所有)患者的疾病进展。然而,这种治疗也会导致癌症、充血性心力衰竭和神经系统事件的恶化以及其他病理状态。至关重要的是,这些疗法中都需要终身持续使用,解决慢性炎症和恢复组织稳态的临床选择仍有待开发。
近日,美国佛罗里达大学生物医学工程系的Benjamin G. Keselowsky与Gregory A. Hudalla教授合作发表了一项利用半乳糖凝集素锚定药物实现长久有效免疫调节的相关工作。作者团队通过将免疫抑制酶吲哚胺2,3-双加氧酶1(IDO)和半乳糖凝集素-3(Gal3)结合构建了一种融合蛋白,旨在实现患处局部的免疫抑制,进而规避全身性免疫抑制剂对患者造成额外的伤害。这一理念与抗体的作用机制相似,旨在将抑制剂结合在细胞外基质上以实现局部组织保留。Gal3将IDO锚定在组织上,限制了IDO-Gal3的非特异性扩散。在内毒素诱导炎症、牛皮癣、牙周病和骨关节炎的啮齿动物模型中,融合蛋白可在发炎组织和关节中驻留约1周,并且在非特异性免疫抑制剂缺失的情况下,使疾病进展和炎症疼痛有所改善。

IDO-Gal3改善皮肤炎症:
IDO-Gal3催化Trp转化为犬尿氨酸,并以与正常组织Gal3相当的亲和力结合锚定乳糖。皮下注射IDO-Gal3比单独注射IDO更好地预防了由局部脂多糖(LPS)激发引起的炎症。组织学分析表明,用IDO-Gal3预处理减轻了LPS攻击后的炎症细胞浸润。IDO-Gal3预处理阻断了促炎细胞因子IL-6、IFN-γ和IL-12p35的转录,而单纯IDO预处理后的表达高于载体对照。局部注射IDO-Gal3也解决了小鼠银屑病模型中的炎症。局部每日应用咪喹莫特超过14 d诱导的炎症,在第5天达到峰值。在第3天皮下注射IDO-Gal3,临床评分在第8天显著下降。尽管每天持续给予咪喹莫特,但临床评分在这段时间内仍然很低。
考虑到内源性细胞IDO基因表达(Ido1)作为正反馈以进一步提高表达的能力。在LPS和银屑病模型中,用IDO-Gal3治疗后对内源性Ido1转录物进行了定量。虽然LPS和咪喹莫特激发均诱导内源性Ido1表达,作为对炎症的预期反应。但IDO-Gal3处理的组织没有,其水平与基线相当。这些数据表明,IDO-Gal3的外源性供应阻断了局部组织中炎症信号传导和内源性Ido1表达的相关诱导。总之,皮下注射IDO-Gal3在预防和治疗方面都改善了皮肤炎症,在两种通过不同特异性受体(LPS的CD14/TLR4和咪喹莫特的TLR7)作用的不同炎症损伤中得到了验证。
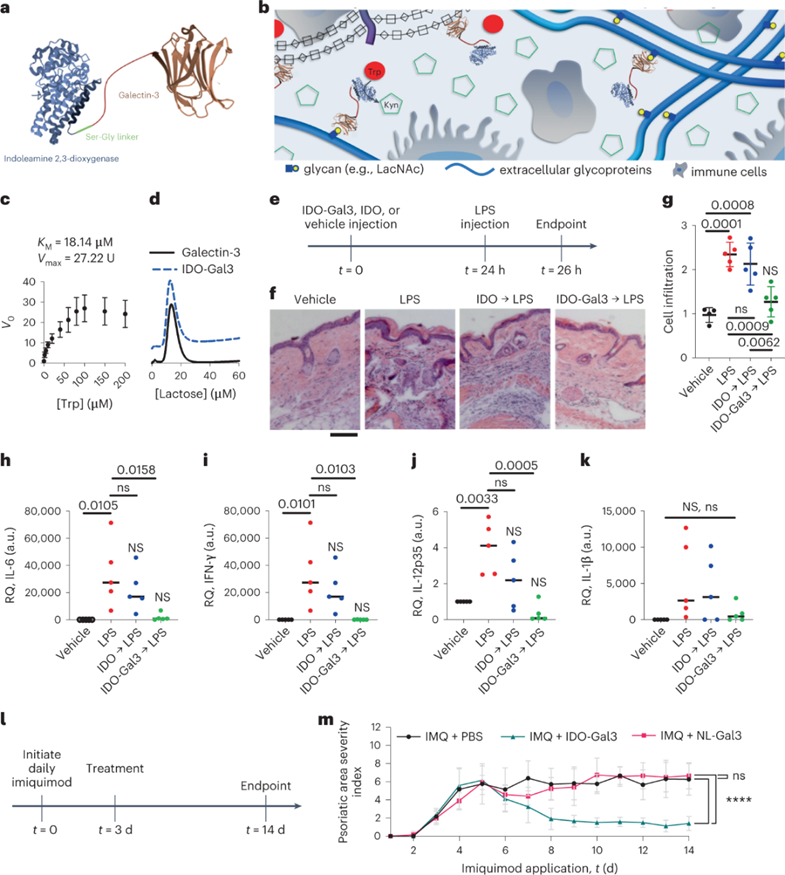
图 IDO-Gal3抑制炎症
IDO-Gal3抑制牙周病的进展:
牙周病是一类由局部粘膜炎症和破骨细胞活化引起的,难以解决的慢性炎症性疾病,导致粘膜和骨组织破坏。在多微生物牙周病小鼠模型中用预防和治疗给药方案进行评估。NL-Gal3的体内成像显示牙龈滞留长达120h,而未固定在36h后即无法测量。通过微型计算机断层扫描(micro-CT)分析来量化牙周病的主要转归,即下颌骨缺失。预防性给药时,下颌下注射可防止骨丢失。IDO-Gal3也抑制牙龈炎症IL-6和IL-1β以及趋化因子MCP1的表达。通过IDO-Gal3治疗,IL-10的产生得到了维持,其中水平更接近未感染小鼠的水平,这表明回归到了稳态控制。与预防性给药相比,IDO-Gal3的治疗性给药可观察到更显著的骨丢失和炎症抑制,其中炎性细胞因子IL-12p70、IP-10、KC-17、MIP-2和IL-33受到的影响最大。这些数据共同表明,IDO-Gal3满足了治疗牙周病的临床治疗要求:在不增强细菌积聚的情况下局部调节炎症,以及即使在疾病进展开始后也能防止下颌骨持续丢失。
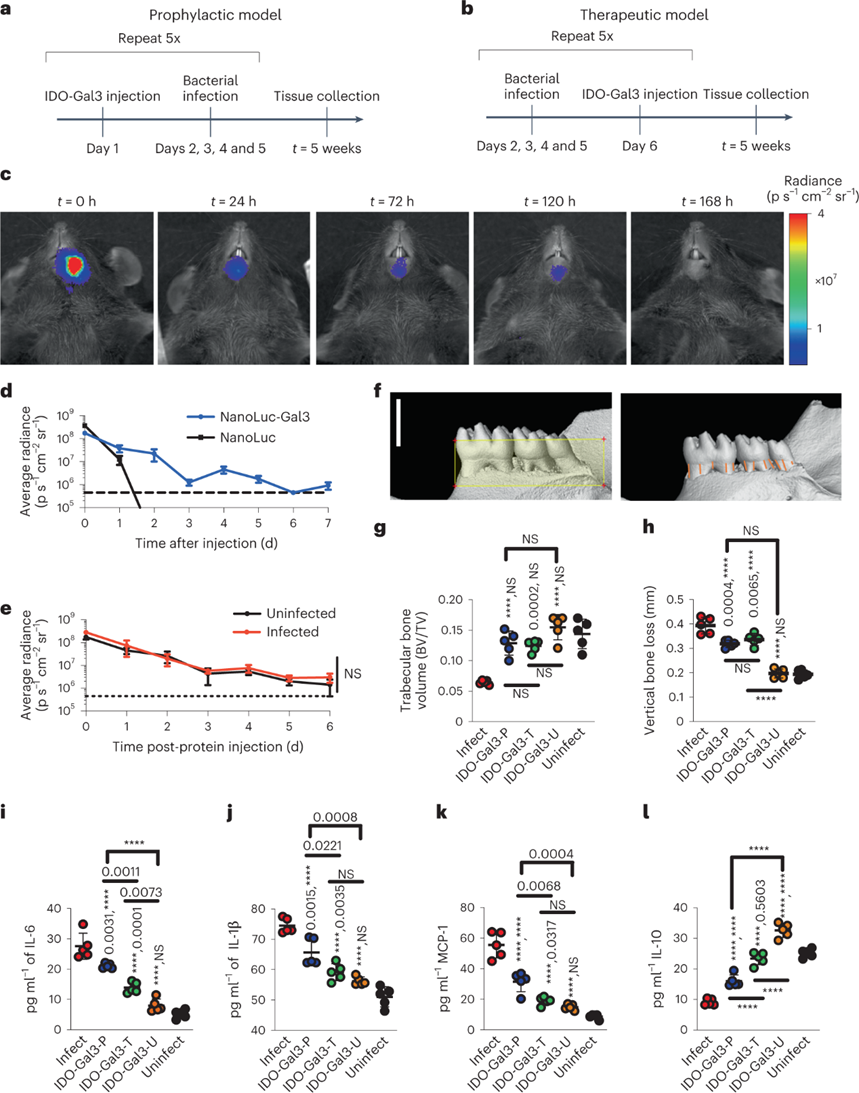
图 IDO-Gal3预防和抑制牙周疾病进展
IDO-Gal3预防创伤后骨关节炎:
创伤后炎性骨关节炎(PTOA)是骨关节炎的一种,通常发生在韧带或半月板撕裂后,或关节反复过载后。使用循环机械过载PTOA小鼠模型来测试IDO-Gal3减少负荷诱导的炎性关节损伤的能力。关节内注射IDO-Gal3可局部保留,抑制炎症,避免关节组织破坏。对衰老小鼠的膝盖施加循环机械负荷,机械损伤和随后的炎症导致滑膜炎症和软骨降解。24小时成像和注射后第7天结果表明,标记的IDO-Gal3在关节中的保留显著高于未固定的IDO。每周关节内给予IDO-Gal3阻断了炎性细胞因子IL-6和IL-12p40在联合关节组织和引流淋巴结中的基因表达。相反,MMP13和TNF-α的表达在任何一个位置都没有被调节。至关重要的是,IDO-Gal3降低了负荷诱导的组织学变化。总之,Gal3的结合提供了IDO局部关节滞留能力,有效降低了炎症基因表达和机械过载诱导的关节结构变化。
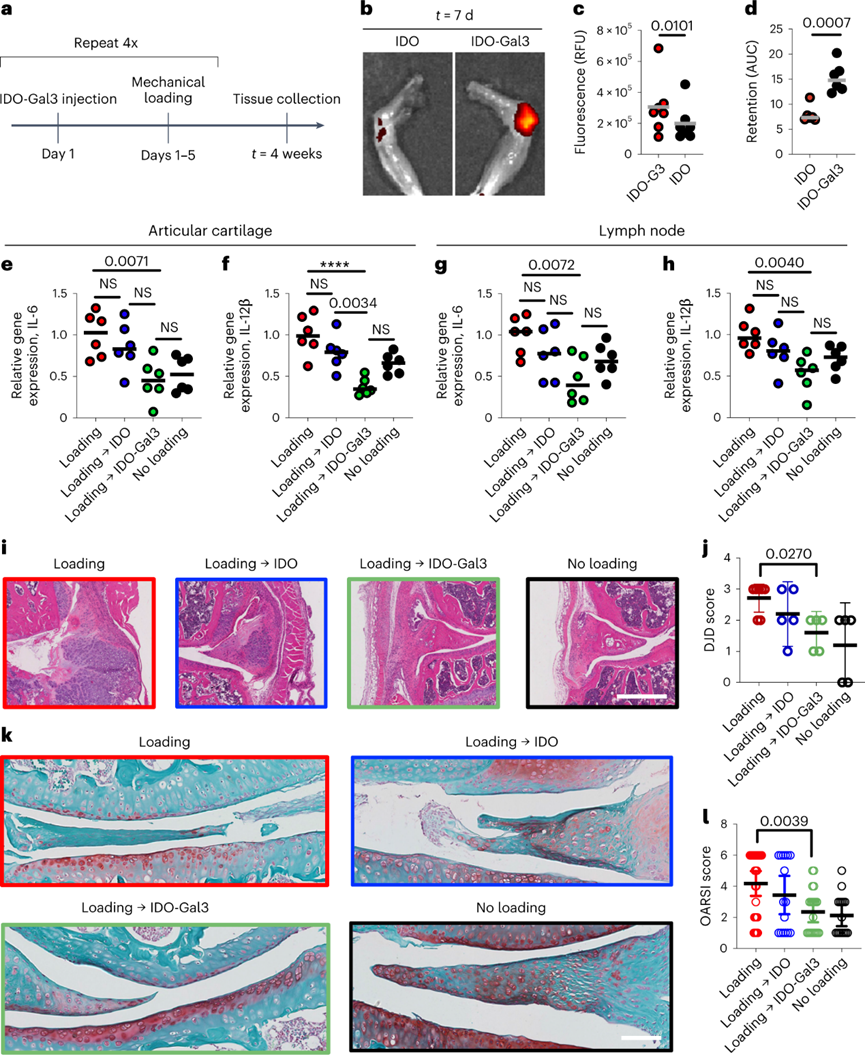
图 IDO-Gal3防止负荷诱导的骨关节炎引起的炎症基因表达上调和关节结构变化
IDO-Gal3降低已建立PTOA模型中的炎症:
骨关节炎的疼痛和残疾与无法修复性关节损伤中的慢性炎症有关。为了研究单剂量IDO-Gal3治疗已建立的OA,使用了手术诱导的PTOA大鼠模型。关节内注射IDO-Gal3可局部保留,抑制关节炎症,减轻OA相关疼痛,改善大鼠步态。在OA和对侧健康关节中给药,NL-Gal3多天内是可测量的,而在1天后单独的NL无法测量。NL-Gal3的联合停留时间(95%衰变)在OA关节中为2d,而在健康关节中为1.3d。术后8周注射IDO-Gal3阻断了局部炎症细胞因子的产生,并进一步逆转了OA相关的触觉敏感性和代偿步态。IDO-Gal3治疗将OA关节中炎症细胞因子IL-6降低到健康关节中的水平。此外,炎症趋化因子MCP1的局部水平也遵循同样的趋势。在第3周使用von Frey实验对触觉敏感性进行量化。IDO-Gal3治疗在注射后第8天逆转了肢体超敏反应,持续到第23天。啮齿动物的步态通过同时进行高速视频拍摄记录进行评估。IDO-Gal3处理的大鼠在注射后第16天使用更快的行走速度,并倾向于在注射后的第23天行走更快。值得注意的是,IDO-Gal3和生理盐水治疗在注射后第9、16和24天有显著差异。总之,这些数据表明,已建立的OA炎症水平得到了有效的改善,同时OA症状也得到了改善。
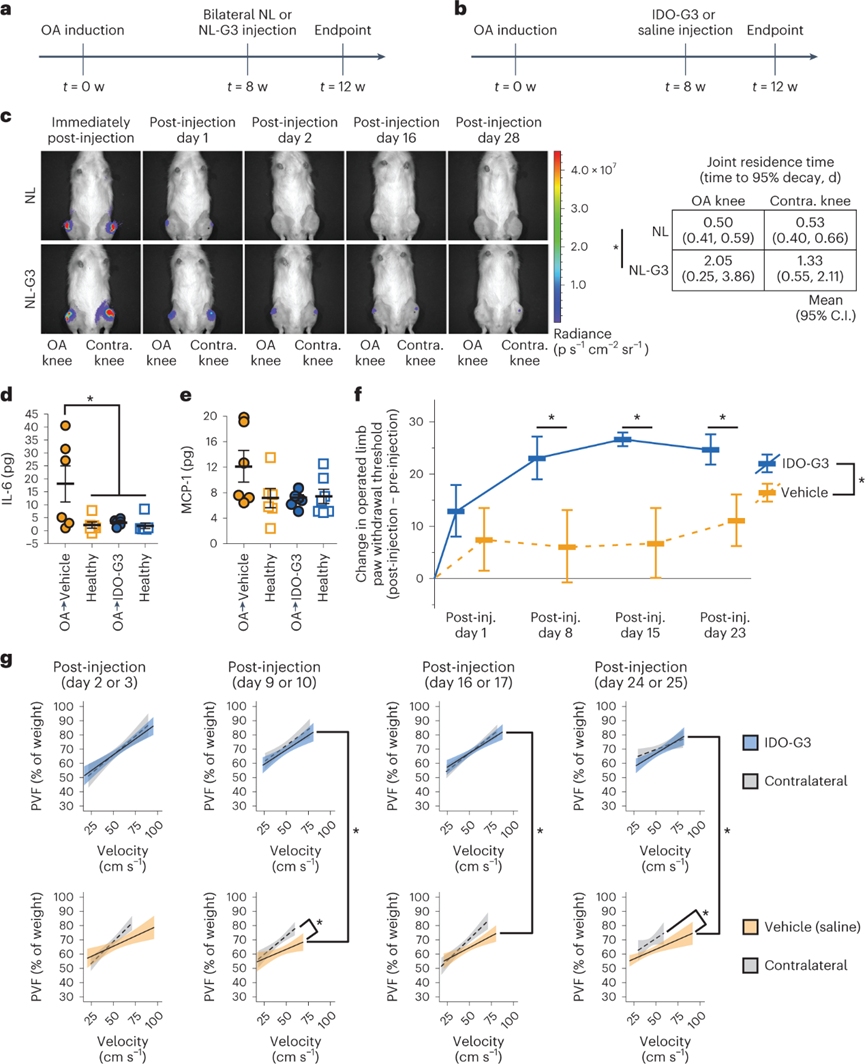
图 IDO-Gal3在骨关节炎建立后减少炎症,降低触觉超敏反应并改善步态
小结:
作者团队开发了一种组织锚定酶IDO-Gal3,这种组织锚定酶代表了一类新的抗炎蛋白治疗药物,作为一种新思路对改善治疗效果和减少各种局部炎症疾病的全身副作用具有广泛的潜在意义。胞浆免疫调节剂IDO被认为是一种具有外源功能和局部可递送的蛋白质,可直接控制必需氨基酸的代谢,在这里作为系统可用的前药。与Gal3融合通过与聚糖结合延长了酶的定位和保留,而这种聚糖在哺乳动物组织中普遍表达。跨物种的聚糖同一性使得翻译无需重新设计人类特定靶标。在多物种和多组织环境中,施用IDO-Gal3可实现四种不同的炎症环境中有力控制炎症。治疗恢复了稳态,保持了组织的完整性和功能,缓解了炎症相关的疼痛。在所研究的每个炎症模型中,IDO-Gal3的给药均匀阻断了IL-6,以及许多其他细胞因子和趋化因子,并且没有诱导全身免疫抑制。
参考文献:
Evelyn Bracho-Sanchez, Fernanda G Rocha, Sean K Bedingfield, et al. Suppression of local inflammation via galectin-anchored indoleamine 2,3-dioxygenase. Nat Biomed Eng. 2023 May 1.
https://www.nature.com/articles/s41551-023-01025-1











