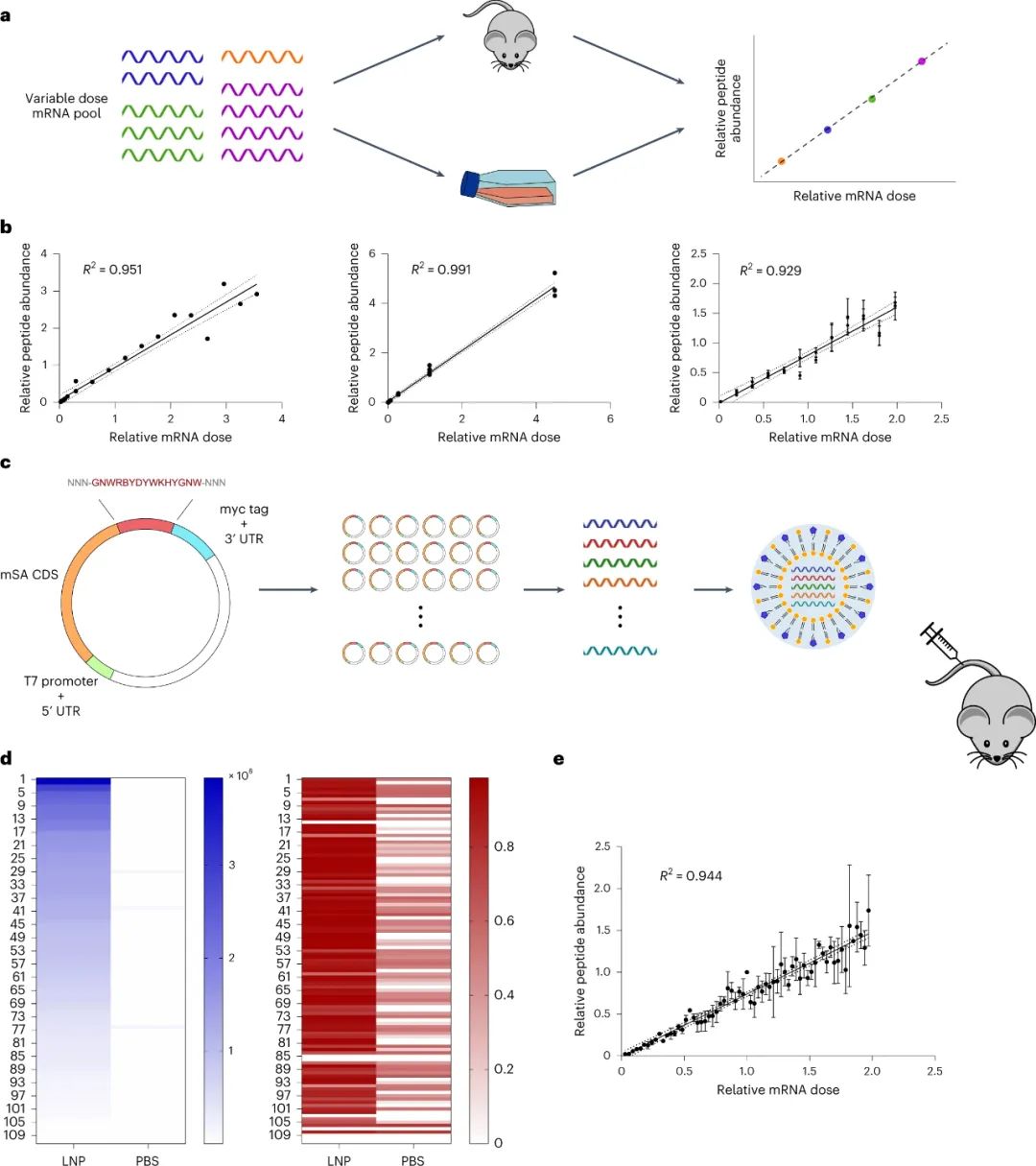
RNA疗法通过直接控制体内特定细胞内的蛋白质生成,在治疗多种疾病方面具有巨大潜力。特别是,由于 mRNA 表达的瞬时性和合成纳米颗粒 (NP) 重复给药的可能性,使用脂质纳米颗粒 (LNP) 非病毒递送 mRNA 是一种用于递送治疗性蛋白质的有吸引力的方法。此外,mRNA LNPs已经应用于蛋白质替代疗法、疫苗接种和基因编辑以及预防COVID-19的临床前模型。尽管取得了这些进展,但仍然需要安全、特异和有效的传递载体。递送脂质开发的一个挑战是体外研究预测体内生物分布和疗效的能力差,以及传统体内研究的低通量性质。虽然这些问题已经通过应用批量分析和DNA和或RNA条形码等方法得到了部分解决,但这些方法都有各自的缺点,限制了它们作为临床前研究的筛选方法。此外,虽然DNA和或RNA条形码可以提供有关同一动物内几十个NPs的单独生物分布的大量信息,但以前的研究表明,LNPs转运到一个特定的组织并不一定导致在该组织内的表达,而且,往往某种LNP积累量很低的组织的功能传递率会比积累量高得多的组织高得多。最近,已经报道了一种利用LNPs与Cre mRNA和DNA条形码共同组成的转基因Ai14小鼠体内筛选NPs功能mRNA传递的方法,称为'FIND'。简而言之,在这个系统中,成功转染的细胞将构成性地表达tdTomato,而与tdTomato信号共同定位的DNA条形码可以被量化,作为功能传递程度的间接测量。虽然这比原来的DNA条形码检测有了很大的改进,但它仍然有几个重要的局限性。例如,只要目标细胞被单一类型的NP成功转染,被内化或保留在目标细胞表面的NP就会在FIND筛选中产生阳性结果。这可能会导致误导性的结果,特别是考虑到研究表明每个细胞在多个内体中吸收多个NPs。为了避免这种 "旁观者"效应,理想的功能传递的多重检测将直接测量每个NP所影响的蛋白质生产量。此外,含有mRNA条形码和DNA条形码的LNPs已被证明会导致明显不同的生物分布,这可能导致额外的偏差。最后,FIND 依赖于转基因 Ai14 小鼠模型的使用,排除了其在大型动物模型和 Cre-Lox 报告系统不可用的特定疾病模型中用作筛选系统。鉴于此,麻省理工学院Daniel G. Anderson等人开发了一种基于肽条形码的筛选系统,通过将不同的肽条形码编码 mRNA 包装到每种不同类型的 LNP 中,可以同时评估同一动物体内的多个 LNP。然后可以将条形码 LNP 合并并以单次剂量施用给同一动物,一旦在目标组织或细胞类型中发生成功递送的 mRNA 的翻译,就可以用液相色谱法和串联质谱法(LC-MS/MS)对每个肽条形码序列的表达进行定量。因此,每个独特的 LNP 配方都会产生自己独特的测量结果,即在分析的组织或细胞类型中直接量化受其影响的蛋白质生产。因为这种方法不依赖于任何报告转基因的存在,所以它本质上是独立于模型的,理论上可以用于任何临床前模型。
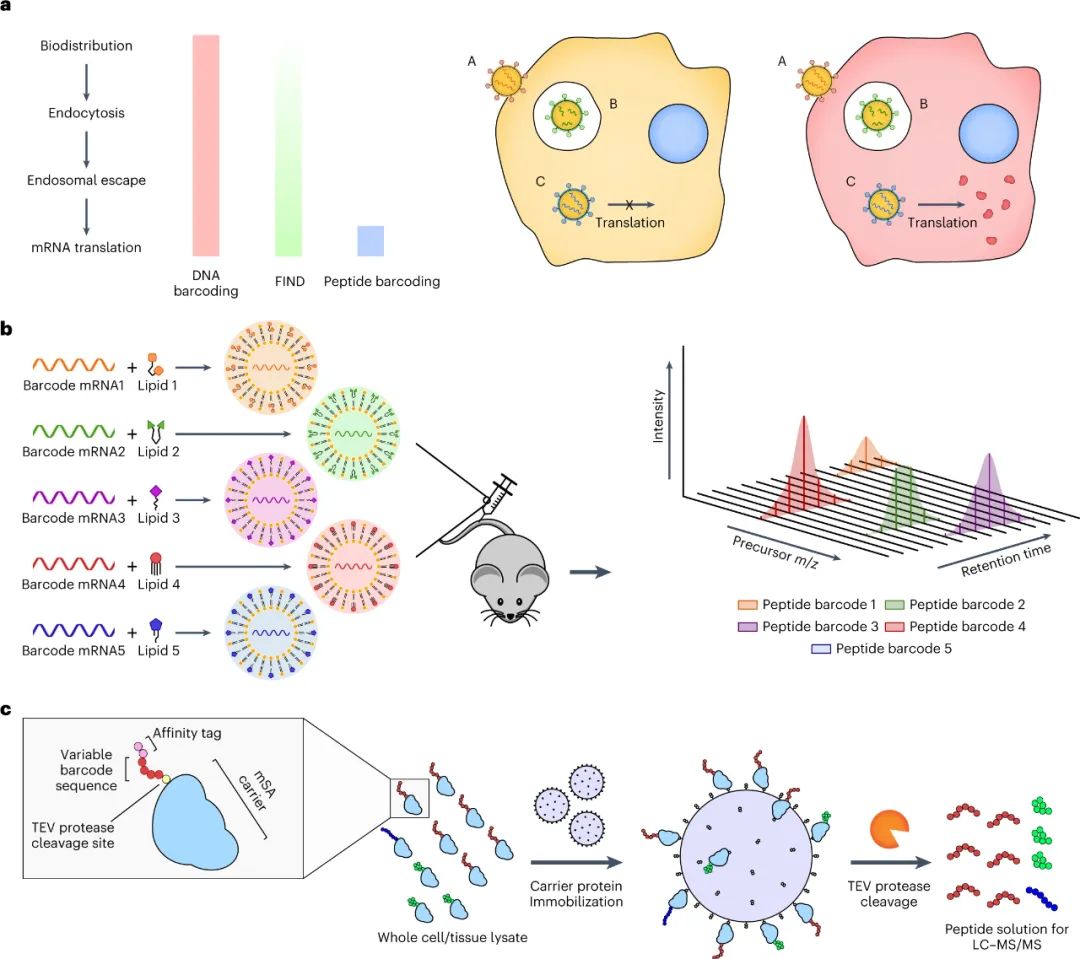
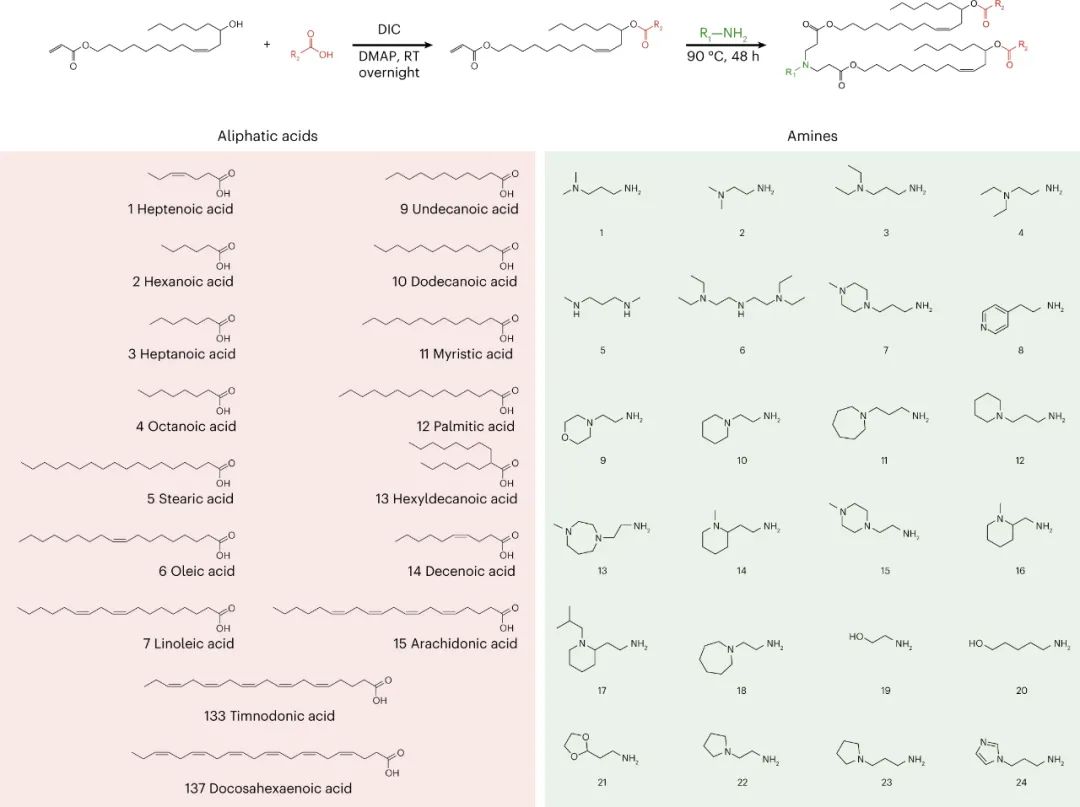
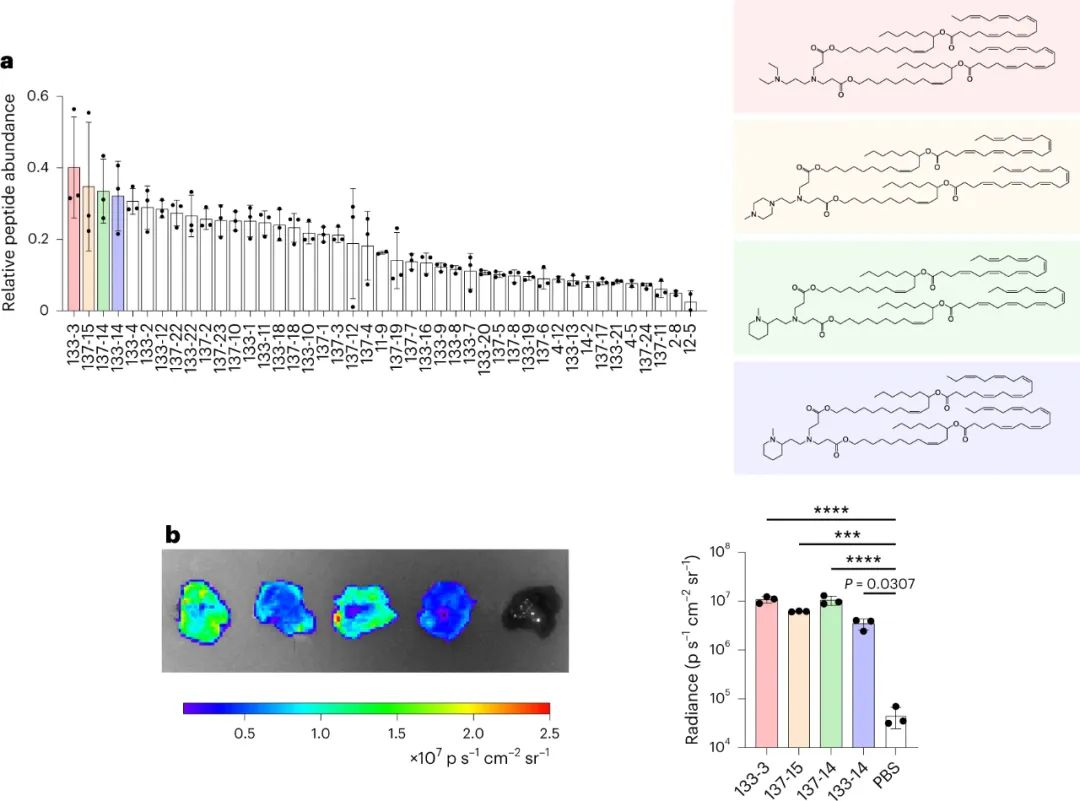
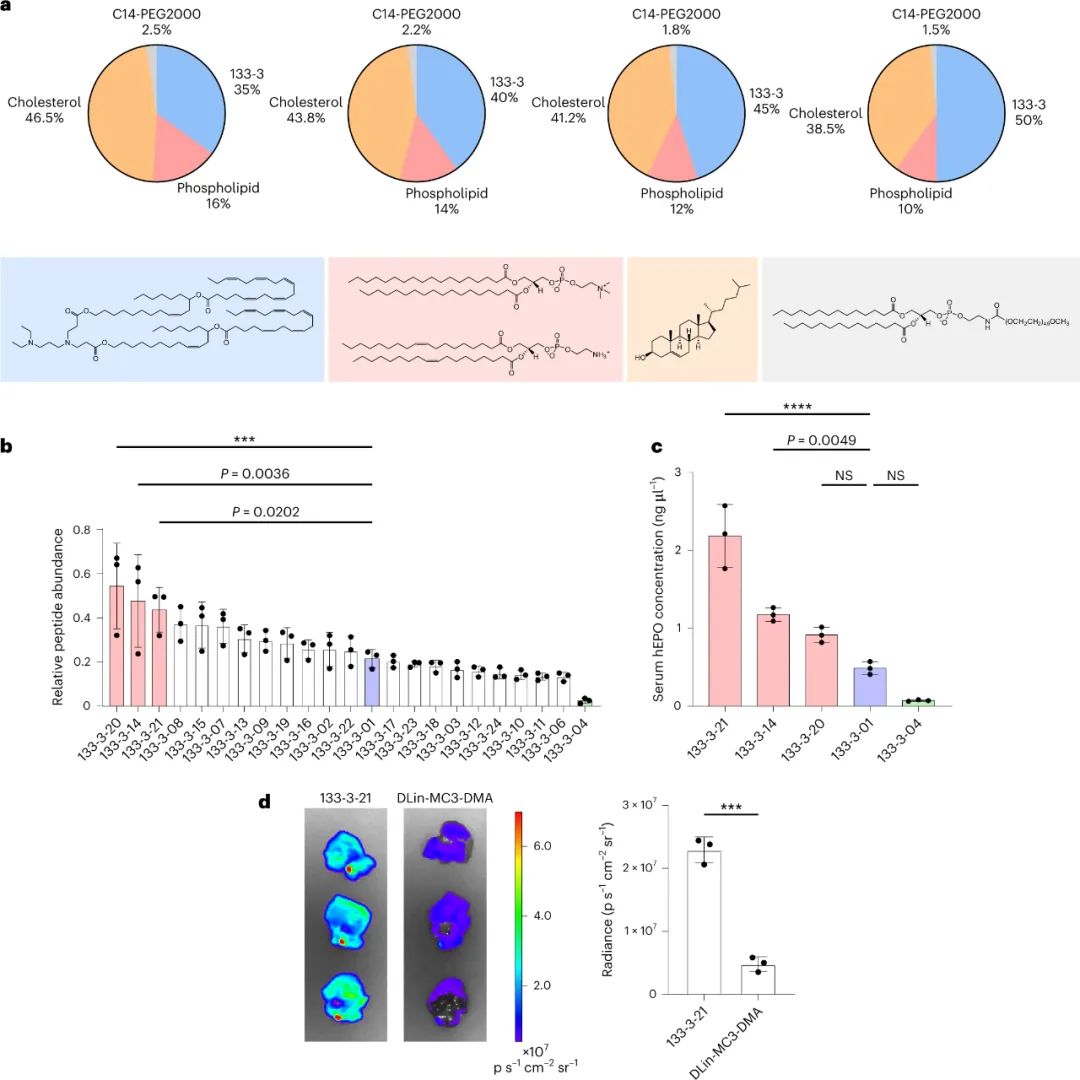
该研究团队开发了一种筛选功能性mRNA递送的理想系统,该系统具有模型无关性,可应用于任何疾病的临床前模型。该方法使用多种蛋白质产生的测量方法,每种方法之间是正交的,因此可以在同一实验中测试多种组合,具有高灵敏度和广泛的动态范围。为了实现每个纳米颗粒(NP)内的正交功能输出,最简单的方法是使每个NP影响产生独特的蛋白质。通过使用包含肽条形码编码的mRNA制备的NP,将肽条形码与携带蛋白质融合在一起。当这些NP功能性地递送到靶细胞的细胞质中时,这些肽条形码将可以通过LC-MS/MS和ELISA进行检测和定量。为了减少靶细胞中非条形码蛋白的背景噪音,研究人员使用了一种单体链链铁蛋白(mSA)作为携带蛋白,每个肽条形码都与一个生物素化支架结合。研究人员首先在生物素化珠子上固定带条形码的mSA,然后通过烟草花叶病毒(TEV)蛋白酶将携带蛋白的C端末端剪切,释放肽条形码到溶液中。最后,将肽条形码混合物从生物素化珠子中分离出来,并在液相色谱质谱上进行定量分析。研究人员证明,该方法能够准确测量不同mRNA的功能性递送到细胞的数量。研究人员还对该方法进行了优化,扩展了肽条形码mRNA库的大小和增加了筛选的吞吐量。然后,研究人员试图证明肽条形码可用于开发和优化 LNP 配方。为此,研究人员使用图 3 所示的组合反应和组分合成了一个包含384种独特的可电离脂质的文库,所有这些都具有相同的一般支化尾部结构,其中包含几个可生物降解的酯键。然后,研究人员将每种离子化脂质分别与1,2-二油酰-sn-甘油-3-磷酸酯(DOPE)、胆固醇和C14-PEG2000混合制成一个单独的LNP,然后测试每种LNP通过肝脏蛋白产生的mRNA递送效果。使用肽条形码技术,仅使用8只小鼠(每只小鼠48个独特的LNP,不包括重复实验)就对整个文库进行了筛选。为了避免可能的假阳性,他们设置了一个最小的肽点积阈值为0.8。在评估了384种LNP后,有43种结果的肽点积大于此阈值,其中大多数(43个中的37个)是来自于替莫糖酸(133-)或二十二碳六烯酸(137-)。然后,他们使用萤火虫荧光素(FLuc)试验验证了肽条形码分析中确定的前四名结果,并发现当单独评估时,所有四种 LNP 都会在肝脏中产生高水平的 FLuc 蛋白。图3| 384种具有可生物降解的酯键和广泛的尾部分支的可电离脂质的合成研究人员对领先化合物RM133-3进行了配方的优化,探索如何进一步提高其性能。他们通过改变磷脂质的身份(DOPE与DSPC),可离子脂肪酸与mRNA重量比(10、15和20)以及制剂中脂质组分的摩尔比例来生成24个不同的肽条形码LNP库,并发现其中三个配方表现显著高于原始RM133-3配方。同时,研究人员发现,含有DOPE的配方明显优于含有DSPC的配方。最终,他们使用FLuc实验验证了表现最佳的LNP,发现RM133-3-21的效力约为目前临床使用的基准可离子脂肪酸DLin-MC3-DMA的4.5倍。综上所述,该研究讨论了基于 LC-MS/MS 的测定法的开发,该测定法用于测量同一动物体内多个纳米颗粒 (NP) 载体对 mRNA 的体内功能传递。该方法使用 NPs 的肽条形码,它是灵敏的,可以在低至 0.001 mg kg−1的剂量下检测肝蛋白表达。然而,肽条形码方法不能用于筛选导致目标蛋白敲降的有效载荷的功能传递。与混合不同可电离脂质种类相关的非线性效应也可能发生,这可能导致 NP 功效等级排序的差异。该文章提出了几个需要进一步探索的领域,这些领域可能会提高该检测的灵敏度、准确性和通量。Rhym, L.H., Manan, R.S., Koller, A. et al. Peptide-encoding mRNA barcodes for the high-throughput in vivo screening of libraries of lipid nanoparticles for mRNA delivery. Nat. Biomed. Eng (2023).https://doi.org/10.1038/s41551-023-01030-4