特别说明:本文由学研汇技术 中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。研究背景
B-enzocyclobutenes(BCBs)代表了一类重要的刚性四元碳环,存在于天然产物中,在材料科学和机械化学中显示出作为治疗性分子支架、多功能合成子和功能基序的巨大潜力。基于BCB的刚性和三维药效团导致了伊伐布雷定的发现,伊伐布雷定是FDA批准的用于治疗心力衰竭和心脏相关性胸痛的药物。此外,与构象灵活的母体化合物和苯并环戊烷类似物相比,具有精神活性的2C-B的BCB类似物对受体具有更好的亲和力。
关键问题
1、尚未实现控制BCBs合成的环加成反应区域选择性目前,烯烃与苯炔的[2+2]环加成反应是BCBs最常见的合成路线之一。然而,控制该环加成反应的区域选择性是一个尚未解决的问题。现有的BCB合成方法在范围和效率方面存在局限性,使用这些反应合成具有药用价值的杂环BCB具有挑战性,需要寻找替代的、更具选择性的途径来制备富含C(sp3)特性的各种刚性碳环。
新思路
有鉴于此,斯克里普斯研究所Jin-Quan Yu等人报道了一种钯催化的羧酸中两个相邻亚甲基单元的双C-H活化,在双齿酰胺-吡啶酮配体的作用下,通过仅涉及(两个C-H键和两个芳基卤键)的s键的形式[2+2]环加成反应,实现了BCBs的区域可控合成。广泛的环状和非环状脂肪酸以及二卤代杂环芳烃是相容的,产生了多种功能化的BCBs和杂-BCBs,存在于药物分子和生物活性天然产物中。

受到β,-C-H氘化的启发,作者探究了开发与邻二卤代芳烃的顺序双重C-H偶联过程来构建 BCB 支架,通过实验证实了反应的可行性并提高了分离效率。作者评估了[2+2]环化反应的底物范围,表明多种环状脂肪酸可提供顺式BCB产品作为单一产品,较大的环状脂肪酸产生反式 BCB产物作为主要异构体。作者发现六元螯合酰胺-吡啶酮配体是线性底物最有效的配体,提供多种反式 BCB,还展示了许多苯并环丁酸产品的合成加工。作者证明不同位置的取代基与该催化系统相容,氟、氯和溴等卤素是相容的,能够以良好的收率提供所需的BCB。作者发现吡咯、噻吩和呋喃等杂环化合物具有良好的耐受性,两个C-H键和两个芳基卤化物键的顺序激活具有出乎意料的排他性区域选择性。1、成功地实现了Pd催化的BCB合成,实现了专一区域控制作者通过酰胺-吡啶酮配体实现的脂肪酸与二卤代芳烃的环化反应,成功地实现了Pd催化的BCB合成,其中通过芳基碘和溴之间的差异实现了专一的区域控制。直接使用丰富且结构多样的非环酸和环酸作为底物,无需预先官能团化,极大地扩展了获得各种BCB的途径,包括杂环BCB支架。
技术细节
在对二羧酸的亚甲基C-H内酯化反应的机理研究中,观察到 7-乙氧基-7-氧代庚酸的β,-C-H氘化。这一观察结果促使作者研究是否可以开发与邻二卤代芳烃的顺序双重C-H偶联过程来构建 BCB 支架。使用1a(1-丙基-1-环戊烷羧酸)和2a(二卤代芳烃偶联1-溴-4-氯-2-碘苯)以及Ag2CO3作为卤化物清除剂,用一系列吡啶-吡啶酮配体测试这种转化的可行性,结果表明所需的3a(BCB)确实形成为单一异构体。吡啶-吡啶酮配体的初步结果表明需要更有效的配体,作者专注于开发支架吡啶臂的替代品,合成了一类同时带有吡啶酮和缺电子酰胺的双齿配体全氟苯胺,通过广泛的结构调整,将配体L7确定为最佳配体,以90%的分离产率提供3a。
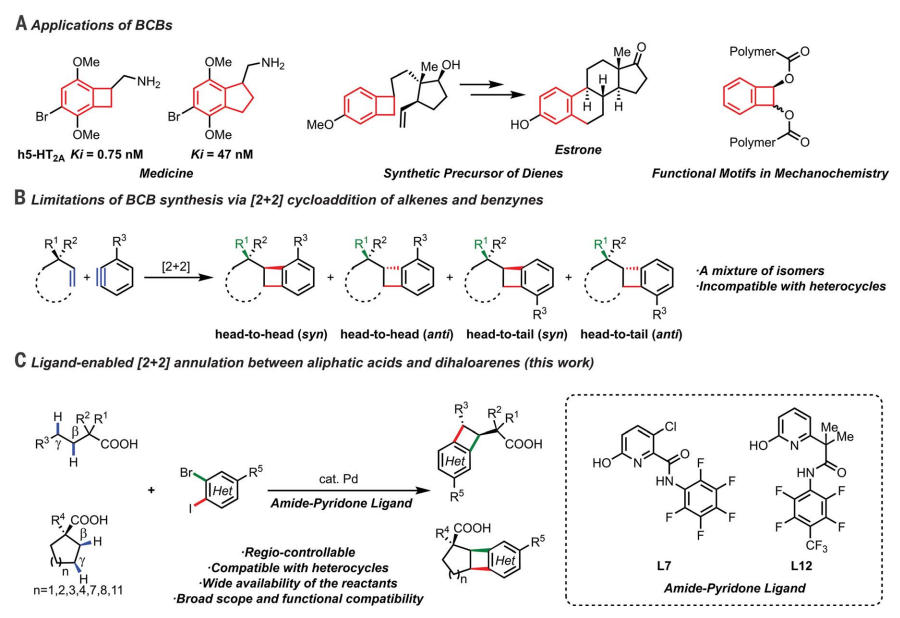
作者评估了[2+2]环化反应的底物范围。包括五元环(1a-1l)、六元环 (1m-1t)、七元环(1u-1v)和八元环(1w)在内的多种环状脂肪酸相容,可提供顺式BCB产品作为单一产品区域异构体(3a-3w)。较大的环状脂肪酸产生反式 BCB 产物作为主要异构体。当收率相对较低时,回收剩余的未反应的脂肪酸反应物。配体L7允许将Pd负载量从10降低到5或1%,同时保持二卤代芳烃2a和酸之间[2+2]环化反应的合成有用收率。
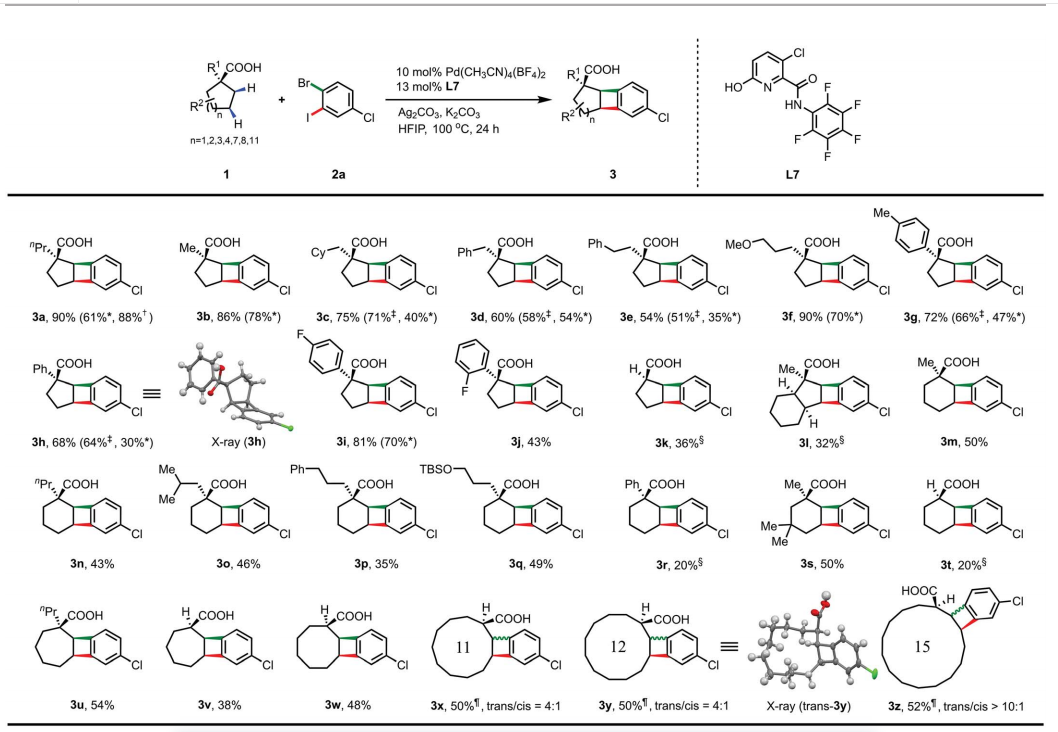
无环脂肪酸4a在L7中仅产生低产率 (2%)。六元螯合酰胺-吡啶酮配体L12 成为这些线性底物最有效的配体,提供多种反式 BCB。甲氧基、氯、膦酸酯和取代的芳基等多种官能团是相容的。作者还展示了许多苯并环丁酸产品的合成加工。在180°C下加热作为邻醌二甲烷前体的5a与 N-甲基马来酰亚胺在二氯苯中的溶液,以60%的收率提供Diels-Alder 加合物。5a可以很容易地转化为具有重要药用价值的胺。苯并环丁基酰胺是一种获得专利的作物保护生物活性分子,可以通过脂肪酸4a和N-二卤代芳基酰胺的[2+2]环化反应快速合成。
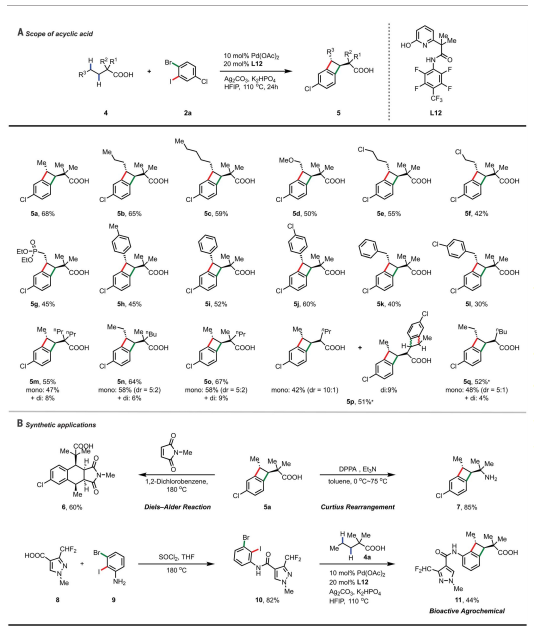
溴碘芳烃的广泛范围进一步扩大了BCBs的多样性。不同位置的取代基与该催化系统相容。氟、氯和溴等卤素是相容的,能够以良好的收率提供所需的BCB。还对带有给电子(12k-12l)和吸电子(12m-12t)基团的芳烃进行了测试,为产品提供了良好的产率。广泛用于C-H活化的酰胺(12s-12t)和羧酸(12u)基团作为导向基团,也适用于该方案。芳基三氟甲磺酸酯是 Pd 交叉偶联化学中的高反应性位点,也是可以耐受的(12m)。此外,二溴芳烃和二碘芳烃适用于标准条件,以中等至良好的收率生成所需的 BCB。正如预期的那样,1b与 2,3-二溴甲苯 (2cBr) 的反应提供了两种区域异构体的混合物,表明具有两个不同活性位点的溴碘芳烃对于控制区域选择性至关重要。

作者发现吡咯、噻吩和呋喃等杂环化合物具有良好的耐受性,能够以优异的收率提供所需的产品。具有生物活性结构的二卤芳烃如塞来昔布、孕烯醇酮、半乳糖和薄荷醇也相容。该方案还可以应用于生物活性分子的后期修饰。两个C-H键和两个芳基卤化物键的顺序激活具有出乎意料的排他性区域选择性。
展望
总之,作者通过钯催化的羧酸中两个相邻亚甲基单元的双C-H活化,实现了BCBs的区域可控合成。除了实现两个相邻亚甲基C-H键的区域选择性功能化之外,具有独特区域选择性的多种 BCB 的模块化合成适用于制药、材料科学、机械化学以及天然产物合成。反应机理的进一步研究正在进行中。JI-MIN YANG, et al. Regio-controllable [2+2] benzannulation with two adjacent C(sp3)–H bonds. Science, 2023, 380(6645): 639-644.DOI: 10.1126/science.adg5282https://www.science.org/doi/10.1126/science.adg5282










