细胞球体(例如类器官),弥补了体外系统和体内动物模型之间的不连续性,是比模拟人类器官的二维细胞层更好的体内微环境模型。目前生成球状体的程序,如不粘性基质,是繁琐的、耗时的、昂贵的或不好控制的。这些方法都没有模仿细胞外基质(ECM)生物发生的特征,例如调节前体分泌和随后组装到基质中,以形成细胞间连接。此外,ECM蛋白含有多种翻译后修饰的酶促反应,以动态调节细胞粘附和迁移,如在ECM蛋白的确定位点中,磷酸化的频率很高。
到目前为止,合成材料要模拟ECM蛋白的动态和瞬时的磷酸化一直是个挑战。由非共价相互作用形成的肽组合的固有动态结构可能提供一个解决方案,肽组合形成水凝胶基质以模仿细胞培养和组织工程的ECM的事实证明了这一点。然而,大多数水凝胶是在原位制作的,以包围细胞,这与组织不同,细胞围绕着原位制作的ECM。之前研究已经表明,酶反应性D-磷酸肽组合诱导HS-5细胞球状体,但详细机制仍不清楚。此外,尽管多肽纳米纤维的功能多种多样,但它们的原子结构在很大程度上仍然是未知的。
鉴于此,布兰迪斯大学徐兵、弗吉尼亚大学Edward H. Egelman、Fengbin Wang等人报告了酶反应性 D-磷酸肽的转胞吞作用(即胞吞作用和胞吐作用)产生细胞间 D-肽纳米纤维作为水凝胶基质,使细胞球体形成。
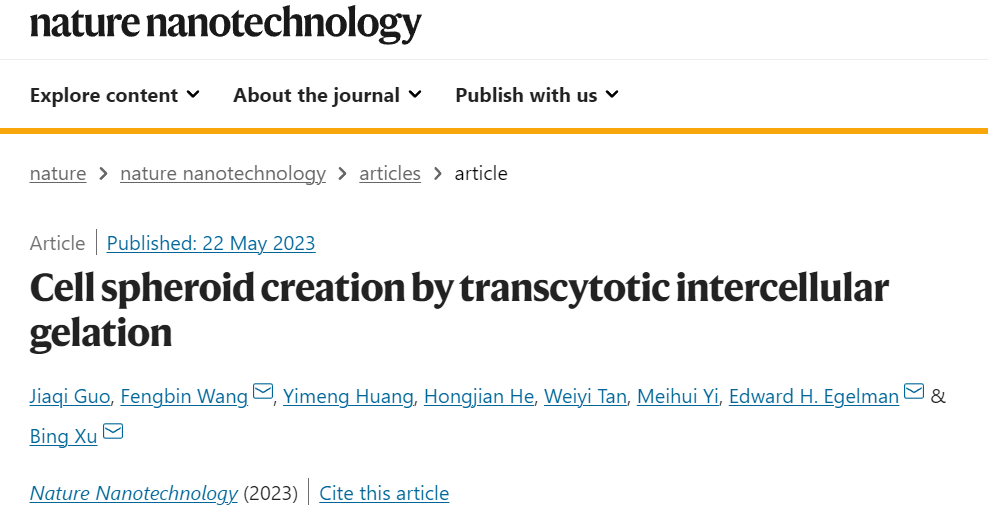
图|自组装 D 肽纳米纤维形成细胞间水凝胶
D-磷酸肽含有荧光的硝基苯甲二唑(NBD)和自组装的D-苯丙氨酸-D-苯丙氨酸(ff)。NBD报告了肽在细胞试验中的组装形成。由于丝氨酸和酪氨酸经常富集在整体膜蛋白的细胞外域,如用于细胞间粘附的闭锁素,研究人员在ff的C端连接了D-丝氨酸(s)和D-磷酸酪氨酸(py)。磷酸酪氨酸使D-肽具有磷酸酶的反应性。这种设计导致了关键分子,NBD-ffspy(1)。且还研究了具有类似设计的NBD-ffspy类似物。
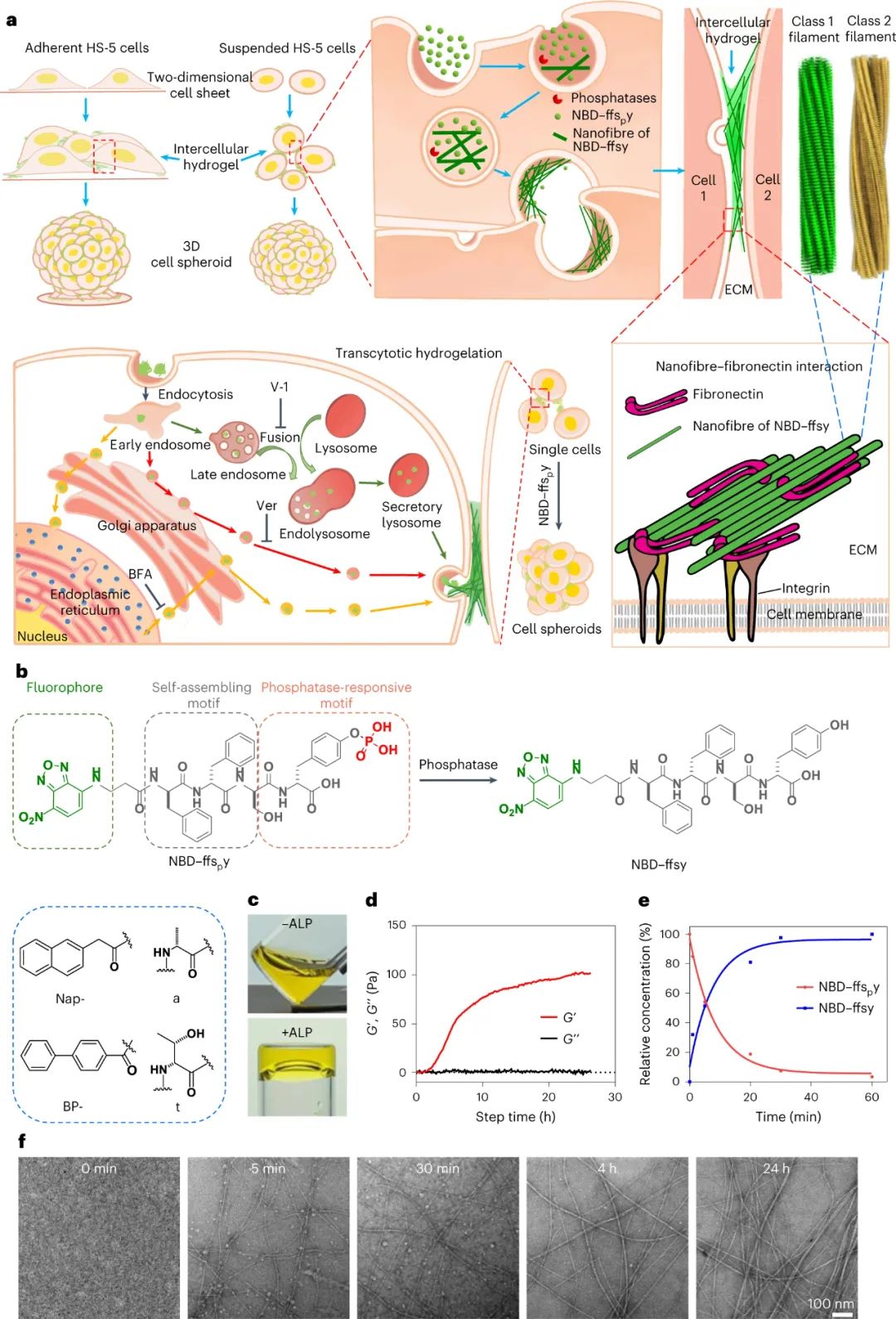
用碱性磷酸酶 (ALP) 处理 NBD–ffspy(高于其临界胶束浓度)会产生水凝胶。应变扫描显示 ALP 指导的快速水凝胶化大约 1.5 h,并确认 NBD-ffsy 组件充当凝胶基质,与 ALP 快速将 NBD-ffspy 转换为 NBD-ffsy 一致。引入 ALP 后,NBD–ffspy自组装成纳米纤维,并最终在 24 小时后形成缠结网络。随着时间的推移,束直径逐渐增加并变得更加分散,这表明 NBD-ffsy 组件是多态的。使用低温电子显微镜 (cryo-EM),研究人员确定了负责细胞间凝胶化的 D 肽纳米纤维的原子结构。
图|NBD-ffsy和BP–ffsy在体外自组装成交叉β丝
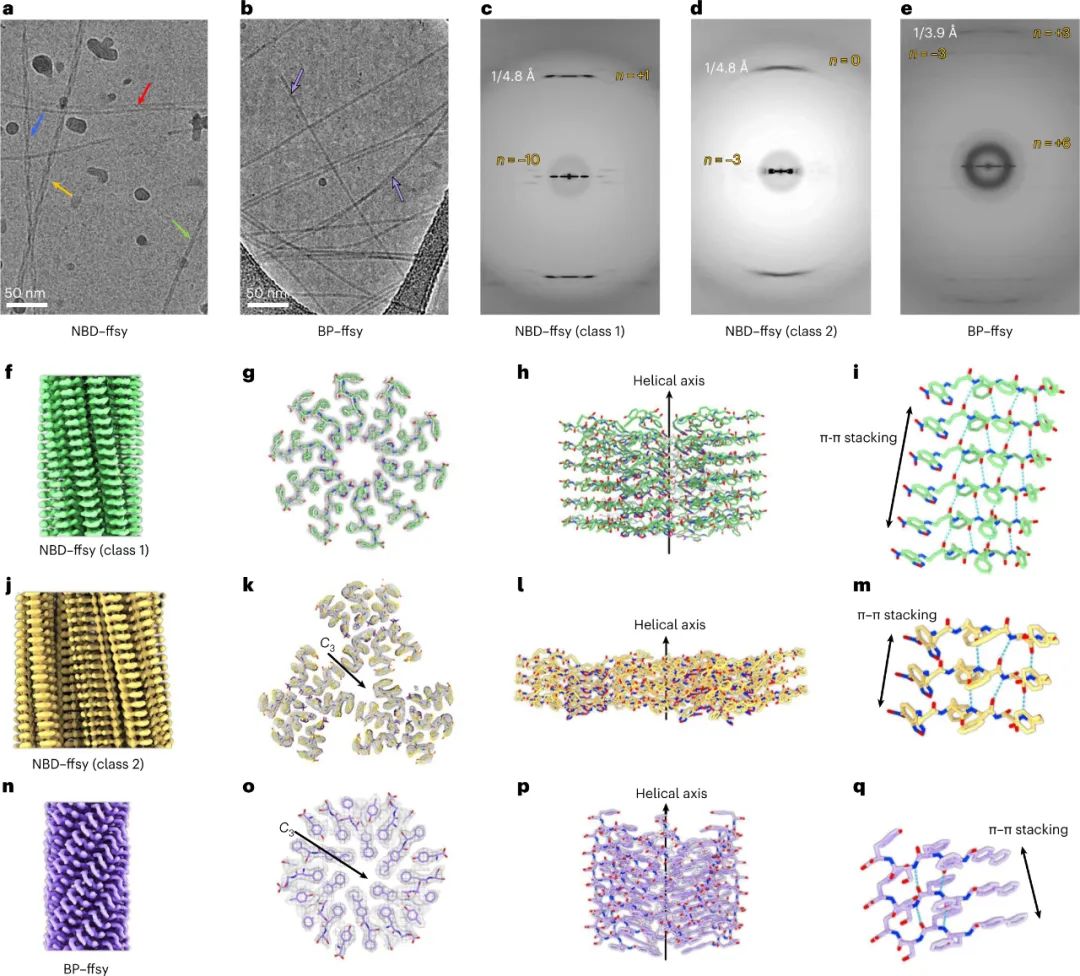
HS-5细胞可以作为检测 D 肽组装体形态发生效应的可靠检测方法,因为它们在正常培养条件下保持为单层单个细胞,并且在过度汇合时几乎不会形成细胞团块。在无毒浓度下,NBD–ffspy 会在粘附和悬浮的 HS-5 细胞中产生球体,球体内组装体的细胞外分布。特别是,NBD–ffspy在 12 小时内迅速诱导悬浮细胞聚集。球体大小与浓度呈正相关,与聚-D-赖氨酸培养皿涂层呈负相关,表明 NBD-ffspy 促进细胞-细胞粘附超过细胞-基质粘附。
图|来自粘附和悬浮HS-5细胞的球体由与纤连蛋白共定位的细胞间水凝胶组成
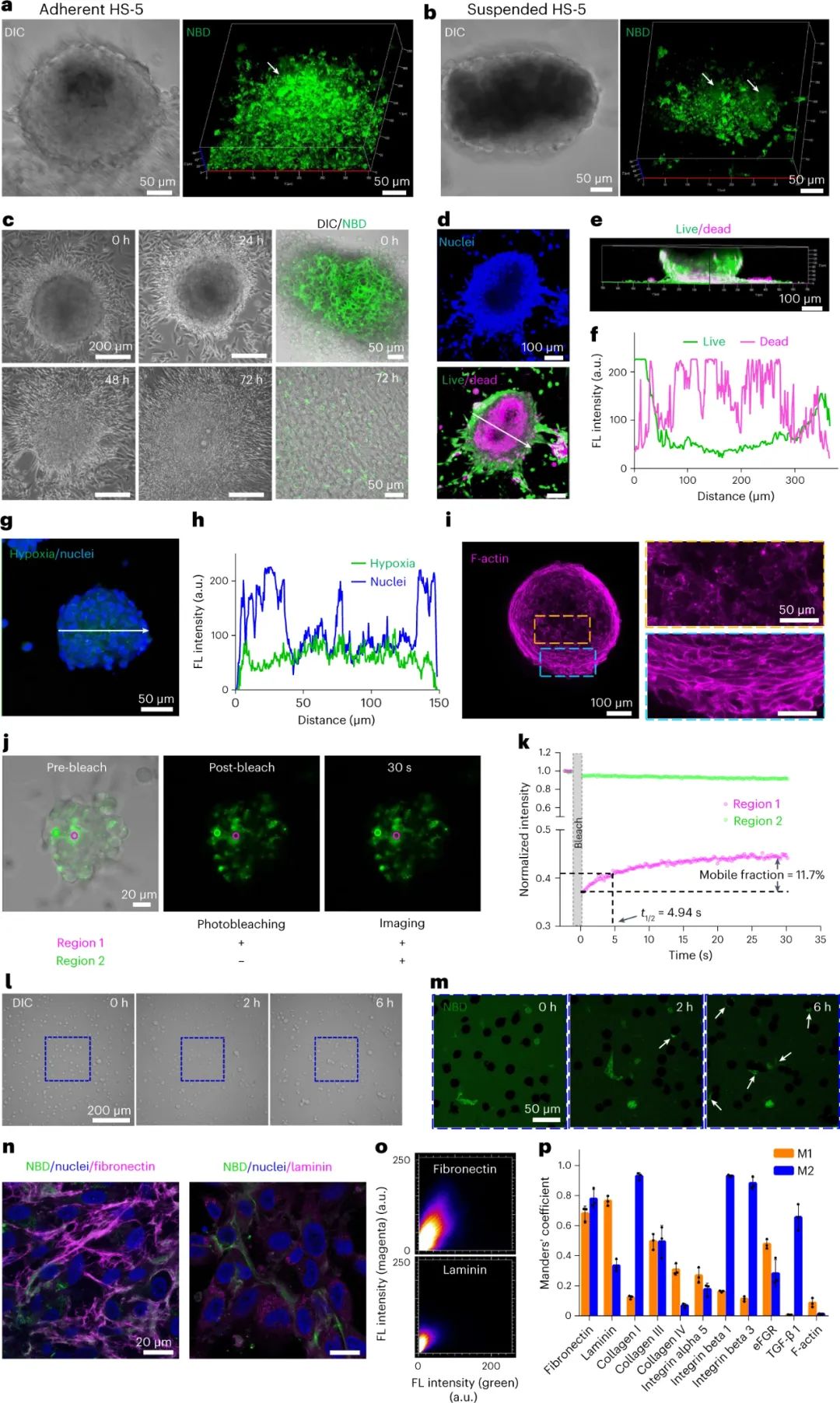
受涉及可溶性蛋白质二聚体分泌和随后自组装成不溶性基质的细胞纤连蛋白合成的启发,研究人员研究了转胞吞作用在球状体形成中的作用。首先使用不同途径的内吞作用抑制剂,发现氯丙嗪是一种网格蛋白介导的内吞作用抑制剂,可显着降低 NBD-ffspy 的细胞摄取。由于氯丙嗪对 HS-5 细胞的毒性,研究人员转而使用他莫昔芬诱导的动力蛋白三重敲除 (TKO) 小鼠成纤维细胞来减少内吞作用。在验证成功敲除 (~90%) 后,共聚焦图像显示每个细胞的囊泡数量减少,同时球体尺寸减小,表明内吞作用在球体形成中的关键作用。
此外,研究人员使用三种类型的胞吐抑制剂来抑制分泌:(1)维拉帕米(Ver)用于抑制钙依赖性胞吐;(2) brefeldin A (BFA) 用于抑制常规内体运输;(3) vacuolin-1 (V-1) 和蔗糖用于诱导空泡形成,V-1 可防止非常规内溶酶体分泌。以无毒浓度处理 HS-5 细胞,所有三种抑制剂都会破坏粘附和悬浮 HS-5 细胞中的球状体形成。这证明了这种胞吐机制在产生球状体中的必要性。这些结果支持这样一个事实,即 NBD-ffspy 通过 D 肽丝的转胞吞作用进入细胞间隙来诱导球状体。
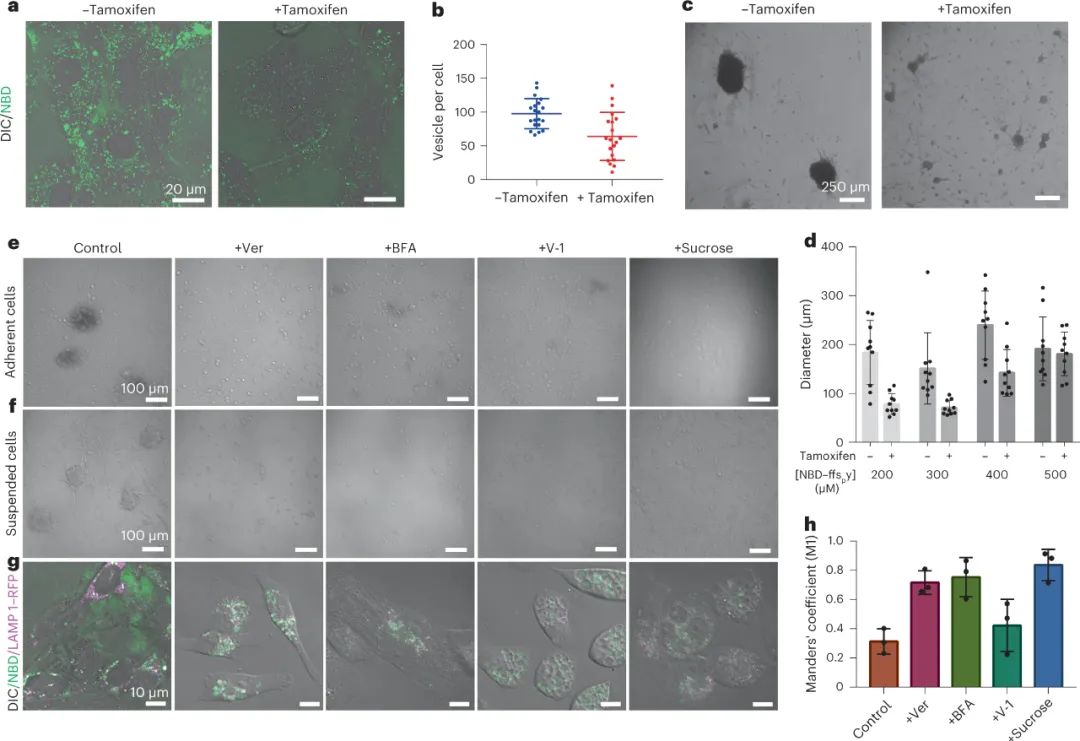
图|细胞内吞和胞吐对球体的形成至关重要
此外,研究人员还研究了D-肽纳米纤维对纤连蛋白(rFN)纤维形成的促进作用。使用活细胞成像技术观察了HS-5细胞与荧光标记的rFN和NBD-ffspy的共培养。结果显示,HS-5细胞能迅速将来自血浆的rFN加工成纤维结构,而NBD-ffspy经历了从点状到纤维状的转变,并与rFN逐渐共定位。共定位时间为24-72小时,rFN的大小随着与NBD-ffspy的共定位增加,表明NBD-ffspy促进了纤连蛋白的重构。共聚焦图像显示NBD-ffsy与 rFN 明显原纤维形成的共定位,支持 NBD-ffsy 纳米纤维的 ECM 重塑效应。
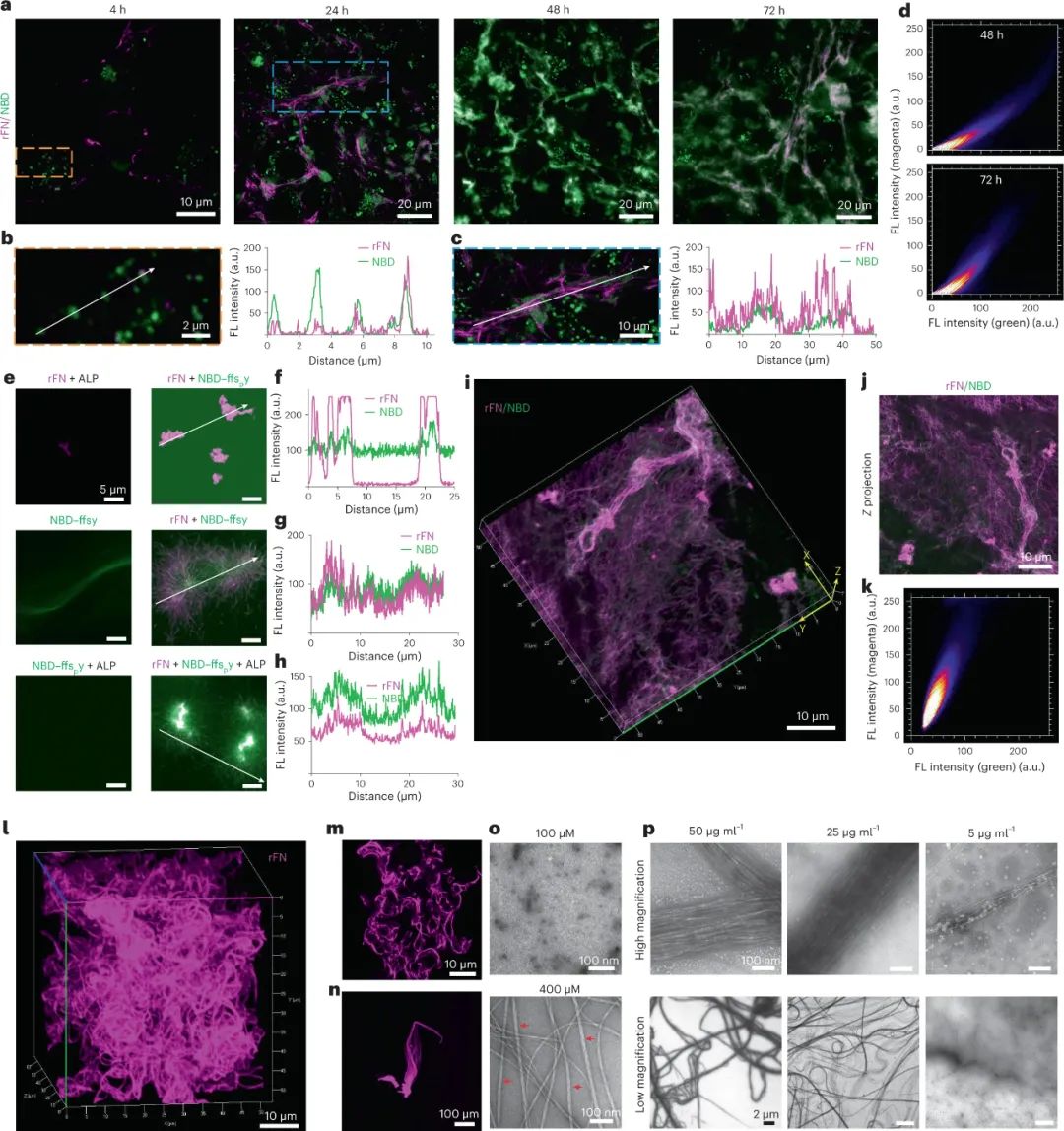
图|D肽纳米纤维促进纤连蛋白的原纤维生成
简而言之,研究人员研究了在 HS-5 细胞的细胞间隙内形成的 D 肽纳米纤维的结构和机制,这些纳米纤维在粘附和悬浮条件下迅速形成球状体。研究结果表明,自组装基序、磷酸盐和纳米颗粒到纳米纤维的转化对于球状体的形成是必不可少的。具有磷酸酪氨酸残基的 NBD–ffspy 经历转细胞去磷酸化作用,产生与纤连蛋白共定位的细胞间组装体。这些肽组装促进了纤连蛋白的原纤维形成,并作为可逆的细胞间纳米连接将细胞粘合在一起。通过形成一种适应性超分子水凝胶,在纳米和微米尺度上重塑内源性蛋白质并控制反应-扩散,这项工作说明了整合低温电子显微镜、酶促变形(纳米颗粒到纳米纤维)和细胞生物学(胞吞作用和胞吐作用)来模仿ECM生物生成的潜力。基于干细胞分化中的表型转换,这项工作中采用的方法应该有助于指导细胞分化,这是一项正在进行的研究的主题。
参考文献:
Guo, J., Wang, F., Huang, Y. et al. Cell spheroid creation by transcytotic intercellular gelation. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01401-7











