承重组织表现出精细调节的机械特性,以独特地适应其生物功能。为了模仿这些组织,基于蛋白质的水凝胶已被广泛探索。蛋白质水凝胶一般较软,杨氏模量低于100kPa。目前的蛋白质水凝胶技术在实现模仿软承重组织(例如肌肉)的机械性能方面取得了相当大的成功。相比之下,软骨的杨氏模量为兆帕量级(0.2MPa 至数兆帕),硬度更高,并且可承受拉伸和压缩载荷。软骨可承受高达100MPa的载荷,并能承受数百万次的加载-卸载循环而不产生太大疲劳,并且卸载后能迅速恢复变形。关节软骨通过胶原纤维和蛋白聚糖的纠缠网络实现了这种独特的机械特征组合。由于高刚度、高韧性和快速恢复往往是相互矛盾的特性,因此利用现有技术来设计坚硬且坚韧的蛋白质水凝胶来模拟软骨样僵硬组织的机械特性具有挑战性。
为了设计高硬度和坚韧的蛋白质水凝胶,更高的交联密度和有效的微观能量耗散机制至关重要。肌肉利用力诱导的肌动蛋白球状结构域的展开-重折叠来有效地耗散肌肉过度拉伸时的能量,并在放松时快速恢复。这种机制已成功用于设计软蛋白水凝胶来模拟肌肉的被动弹性。因此,如果能够开发出一种有效的方法来显著提高刚度而不脆化这种软蛋白生物材料,那么就应该能够将软蛋白水凝胶转化为具有模仿关节软骨力学性能的材料。
鉴于此,加拿大不列颠哥伦比亚大学李宏斌教授等人提出了一种利用链缠结来设计坚硬而坚韧的蛋白质水凝胶的策略。

增加交联密度是增强水凝胶刚度和强度的常用方法,但它常常导致脆化,使水凝胶在机械应力下容易断裂。为了应对这一挑战,研究人员利用链缠结(聚合物链形成一个网络,当它们无法相互穿过时就会缠结)来使基于蛋白质的水凝胶变硬而不影响韧性。由于纠缠链在网络中是“可移动的”,并允许机械能在许多链中长时间耗散,链纠缠将使聚合物网络变硬,但不会使其变脆,这是一个尚未被充分认识到的独特特征。
在肌肉中,肌联蛋白被组织成平行束。在由球状结构域串联重复组成的多蛋白工程化的软蛋白水凝胶中,由于其长度短(大约 10 nm-40 nm),也不存在链缠结。于此,研究人员使用由从头设计的铁氧还蛋白样蛋白(ferredoxin-like protein, FL)的八个串联重复组成的多蛋白(polyprotein,(FL)8)来探索将链缠结引入软蛋白水凝胶的可行性,以在不损害其韧性的情况下显著增加其硬度。
本研究中使用的球状蛋白长度较短,无法形成链缠结。然而,FL 机械不稳定,在约 5pN 时很容易展开。当这些蛋白质展开时,它们的长度会增加到聚合物的典型水平;未折叠的(FL)8长约260nm,相当于Mw≈170 kDa的聚苯乙烯的长度。在未折叠蛋白质的浓缩溶液中,多肽链重叠并缠结,导致高粘度。
为了捕获这种链缠结,研究人员将未折叠的蛋白质与其浓缩溶液进行交联,即变性交联(denatured crosslinking,DC)方法。使用三(联吡啶)钌(II)([Ru(bpy)3]2+)介导的光交联策略构建未折叠(FL)8的水凝胶,它将两个相邻的酪氨酸残基交联成二酪氨酸。首先,使用 7 M 盐酸胍 (GdHCl) 将天然(FL)8的浓缩溶液(200mg /ml) 变性,制备未折叠的(FL)8浓缩溶液,然后将其光交联以获得变性的DC水凝胶(D-DC水凝胶)。
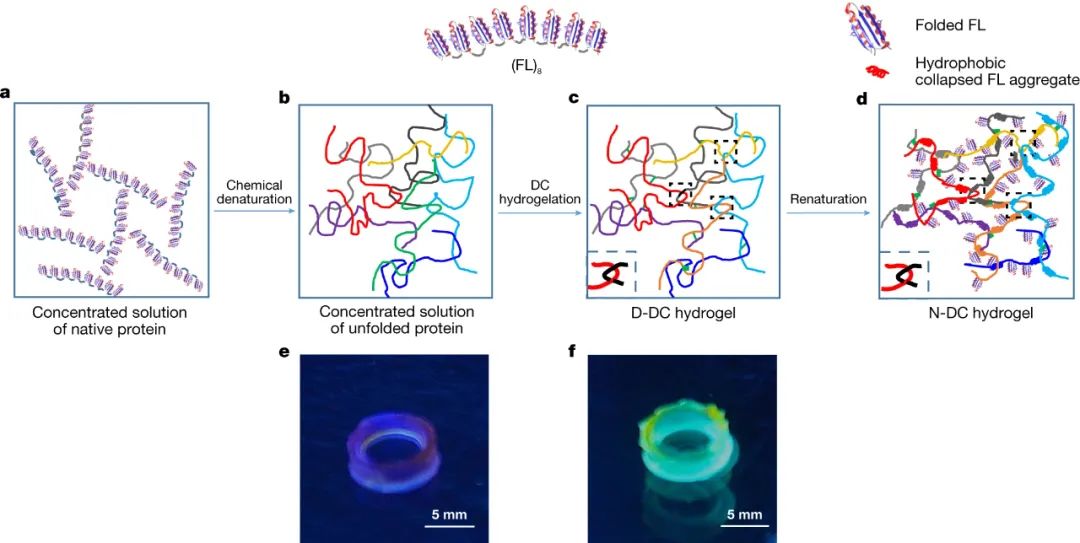
图|N-DC(FL)8水凝胶的链缠结网络结构示意图
所得的蛋白质水凝胶具有令人印象深刻的机械性能,包括高刚度、高韧性和快速恢复,与关节软骨非常相似。该工作开辟了一种设计坚硬且坚韧的蛋白质生物材料的新方法,这可能对组织工程和药物输送等生物医学应用产生重要影响。
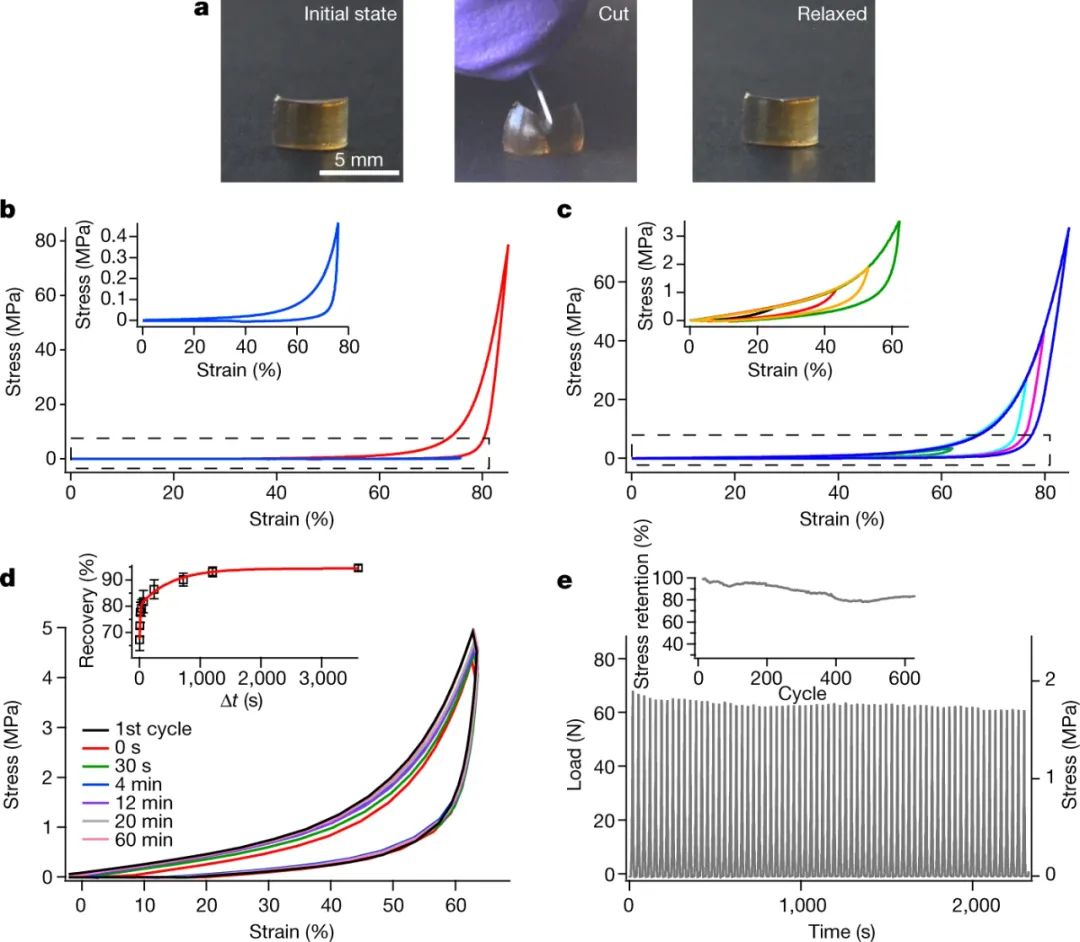
图|N-DC 水凝胶具有优异的压缩力学性能
研究人员使用链缠结来强化聚合物材料的方法也可以为开发具有密切模仿关节软骨机械性能的支架铺平道路。虽然该研究并没有专门关注软骨再生,但水凝胶的机械性能可能使其对此类应用具有吸引力。研究结果表明,蛋白质水凝胶的高硬度和韧性可以为软骨和骨软骨的再生提供生物力学相容的环境
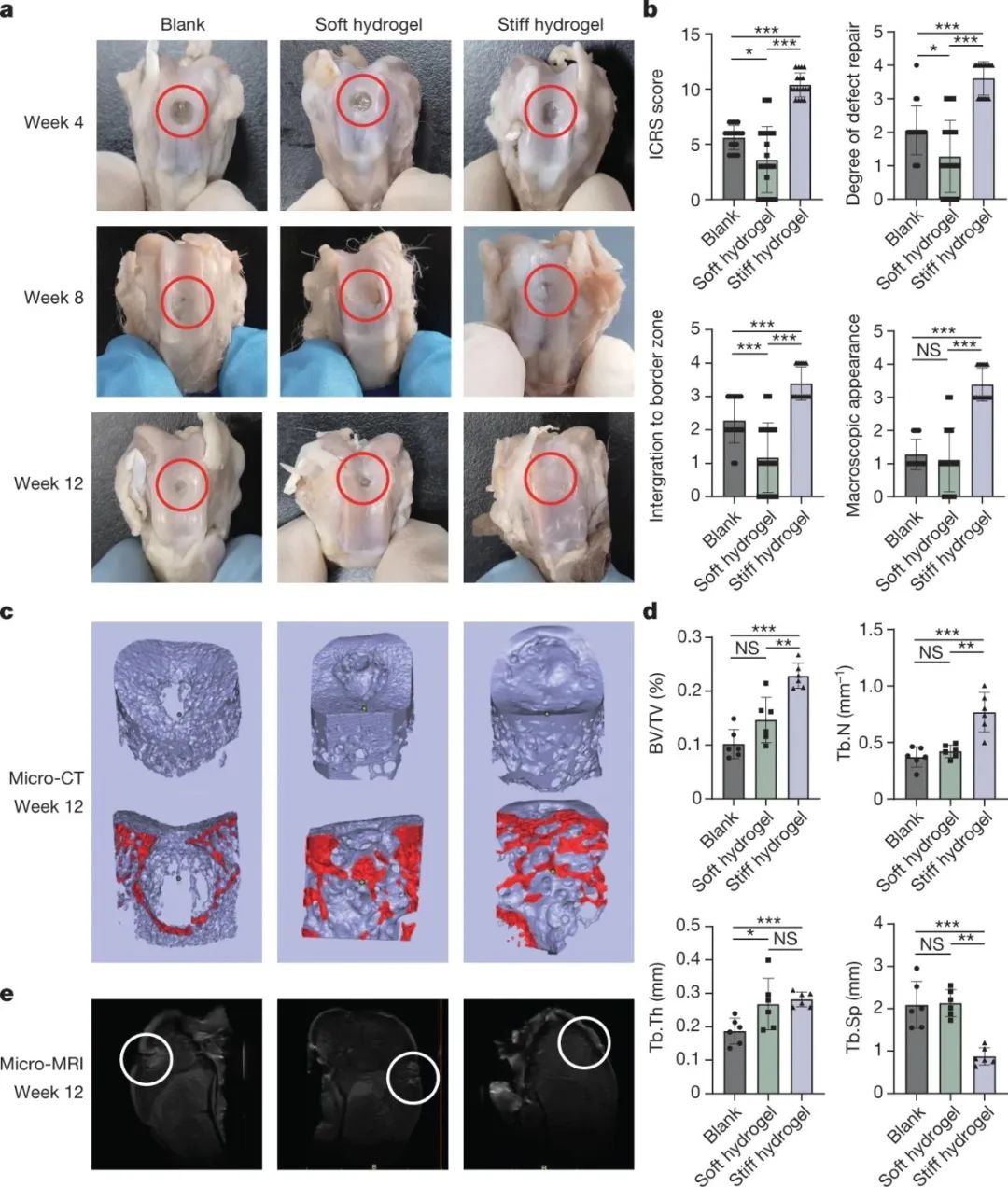
图|硬水凝胶组对软骨下骨和软骨具有良好的修复效果
综上所述,研究人员展示了一种 N-DC 水凝胶方法来设计坚硬且坚韧的蛋白质水凝胶。这种方法的关键是将链缠结引入折叠球状蛋白的网络中,以解决刚度和韧性之间的不相容性。一方面,链缠结增强了水凝胶的刚度而不会使网络脆化。另一方面,球状蛋白的强制展开可以实现有效的能量耗散,而重新折叠则需要快速恢复。这些效应协同作用,可以将高刚度、高韧性、快速恢复和高抗压强度整合到蛋白质水凝胶中。结果证明了使用相同的弹性蛋白通过 NC 和 DC 水凝胶化策略来设计软和硬蛋白质生物材料的可行性,从而显着扩大了蛋白质水凝胶可以实现的机械性能范围。
考虑到这种方法的普遍性、潜在蛋白质构建模块的丰富性、可以实现的机械性能范围以及坚硬和坚韧的蛋白质水凝胶在生物医学工程中的潜在应用,该研究为进一步的系统探索开辟了一个令人兴奋的领域。
参考文献:
Fu, L., Li, L., Bian, Q. et al. Cartilage-like protein hydrogels engineered via entanglement. Nature 618, 740–747 (2023).
https://doi.org/10.1038/s41586-023-06037-0











