特别说明:本文由学研汇技术 中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。

文章链接:https://doi.org/10.1038/s41586-023-06347-31. FGs从根本上影响有机分子的性质和功能,使引入、去除或相互转化FGs的转化在有机化学及其相关领域具有高度重要性。除主要改变FGs多样性的常规FG相互转化反应外,针对在远程C-H位点引入FGs的新转化,如C-H官能化和迁移官能化反应,已经引起了重大关注。2. 但在化学连接和断开的网络中,一类独特的FG操纵转化仍然很少被探索,即在不给分子引入任何伴随变化的情况下,将FG直接重新定位到未活化的甚至传统上不可接近的C-H位点(图第1a段)。这种类型的直接FG易位反应与上述反应类型形成对比和/或互补,表现出分子编辑性质和100%的理想原子经济性。此外,探索具有挑战性的C–H化学空间也可能成为可能。3. 迄今为止,除了烯烃和炔烃的链内异构化外,这种类型的直接FG易位反应几乎没有先例报道。在使用底物特异性变位酶的生物催化中可以发现分散的例子,通过芳基型中间体的Pd催化的芳族酯“跳舞”,或其他,但所有这些都具有有限的普遍性。4. 引入、去除或操纵官能团 (FG) 的化学转化在合成化学中普遍存在。与将一种官能团交换为另一种官能团的传统 FG 互变反应不同,仅改变 FG 位置的种转化的研究要少得多。
1. 本文通过光催化、可逆C-H 采样,作者报告了常见腈中氰基 (CN) 基团的 FG 易位反应,允许CN 和未活化的 C-H 键之间的直接位置交换。该反应显示出 1,4-CN易位的高保真度,这通常与传统 CH官能化中固有的位点选择性相反。2. 本文还报告了循环系统的直接跨环 CN 易位,提供了访问有价值的结构的途径,而通过其他方法获得这些结构是不平凡的。利用 CN 的合成多功能性和关键的 CN 易位步骤,作者展示了生物活性分子构建模块的简洁合成。3. 此外,C-H 氰化和 CN 易位的结合允许获得非常规的 C-H衍生物。总体而言,所报告的反应代表了一种无需位点选择性 C-H 裂解步骤即可实现位点选择性 C-H 转化反应的方法。关于反应设计,作者首先假设与CN进行分子内自由基加成,然后是生成的亚氨基自由基的β断裂可用于迁移CN(图2a,步骤B和C)。随着催化“循环”几乎闭合,需要解决有关位点选择性的关键挑战。在相似且未激活的C-H 键之间进行位点选择性HAA具有挑战性。然而,作者提出通过采用可逆的 C-H 采样策略,更好地控制易位反应的整体位点选择性可能是可行的。该策略将涉及一系列相似C-H键的可逆和非特异性裂解,然后对后续步骤首选的C-H位点进行选择性功能化(图2b)。在这里,这将需要通过合作HAA/HAD催化,在不同 C-H 位点之间的选择性较低的HAT步骤(即步骤A和E)中建立净可逆性,并将这种可逆性与相结合对位点更加敏感的自由基加成步骤,以区分生成的碳自由基(步骤B)。此外,CN α位上的自由基稳定取代基对于促进易位很重要。可逆的C-H采样策略提出了一种非常规的范例,可以实现位点选择性的C-H转化反应,而无需位点选择性的C-H裂解步骤,这提供了一个潜在有用的框架,用于功能化包含多种类型的更多样化的底物类似的C-H键。尽管如此,还是选择2-甲基-2-戊基丙二腈(1)作为模型底物来验证作者的假设(图2c)。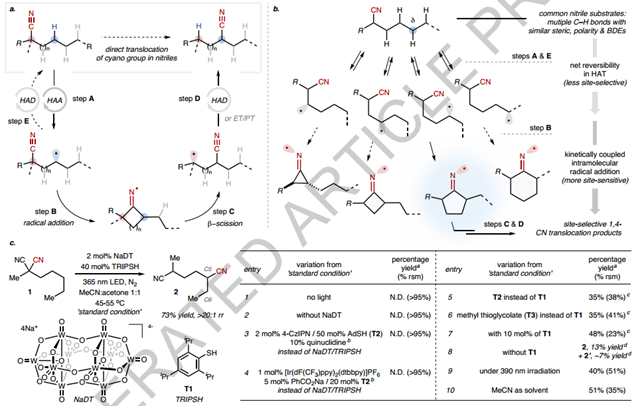 接下来检查底物范围(图3)。首先,作者确认的高区域选择性是普遍存在的(在所有情况下>20:1)并且不受烷基长度的影响(例如,在13、15、17和19中)。对于示例,即使对于含有8个类似 -CH2- 单元的底物19,排他性C4选择性也保持不变,尽管观察到较低的转化率。在某些情况下,1,4-易位的保真度被发现超越了传统基于 HAT 的 C-H 功能化中的典型位点偏好。值得注意的例子包括底物 96 29(1° C-H 超过 2°),31 (受阻 2° C–H 超过 3o )、33(2°C–H 超过醚α C-H)和 35(2°C-H 超过苄基)。多种丙二腈可以转化为具有不同功能化模式的有价值的 1,4-二腈(例如22和97)。“单”-腈底物在稍微修改的条件下是相容的,只要它们拥有个自由基稳定的α-取代基,例如α-氰基酯 (37)、酮 (51)、芳烃 (39-41, 53) 和杂芳烃 ( 47)。还测试了种α-氰化二酯 (55) 和氨基酯 (49, 101-104),从而产生了精确引入远程 CN 基团的新型衍生物。CNs 易位至三级 (99)、二级甚至未激活的一级(30) C-H 位点都是可行的各种。官能团--包括烷基氯(11)、芳基溴(26)和硼酸酯(10)、叔醇(12)、次膦酸酯(50)、噻吩(108)和酮(52)--都是可以耐受的。与机制假说一致,由于 C-H 形成步骤不受控制,大多数线性底物的非对映选择性低于2:1。然而,其非对映体比例在自由基加成步骤中确定的产物可能表现出高非对映选择性。值得注意的是,在几乎所有检查的腈中,无论是通过1电子过程还是2电子过程,CN 基团都重新定位到本质上不是最容易接近的 C-H 位点的位置,无论是通过1或2电子过程,强调了这种方法在访问难以操纵的C(sp3 )-H 键数据方面的潜力。最后,100个含有烯丙基的 C-H 键是不相容的,导致了复杂的反应混合物。
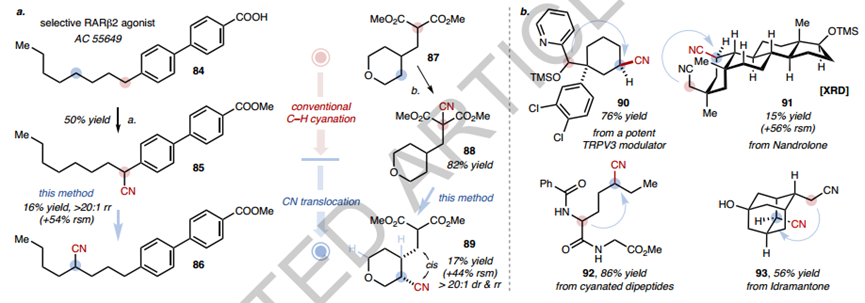
接下来检查底物范围(图3)。首先,作者确认的高区域选择性是普遍存在的(在所有情况下>20:1)并且不受烷基长度的影响(例如,在13、15、17和19中)。对于示例,即使对于含有8个类似 -CH2- 单元的底物19,排他性C4选择性也保持不变,尽管观察到较低的转化率。在某些情况下,1,4-易位的保真度被发现超越了传统基于 HAT 的 C-H 功能化中的典型位点偏好。值得注意的例子包括底物 96 29(1° C-H 超过 2°),31 (受阻 2° C–H 超过 3o )、33(2°C–H 超过醚α C-H)和 35(2°C-H 超过苄基)。多种丙二腈可以转化为具有不同功能化模式的有价值的 1,4-二腈(例如22和97)。“单”-腈底物在稍微修改的条件下是相容的,只要它们拥有个自由基稳定的α-取代基,例如α-氰基酯 (37)、酮 (51)、芳烃 (39-41, 53) 和杂芳烃 ( 47)。还测试了种α-氰化二酯 (55) 和氨基酯 (49, 101-104),从而产生了精确引入远程 CN 基团的新型衍生物。CNs 易位至三级 (99)、二级甚至未激活的一级(30) C-H 位点都是可行的各种。官能团--包括烷基氯(11)、芳基溴(26)和硼酸酯(10)、叔醇(12)、次膦酸酯(50)、噻吩(108)和酮(52)--都是可以耐受的。与机制假说一致,由于 C-H 形成步骤不受控制,大多数线性底物的非对映选择性低于2:1。然而,其非对映体比例在自由基加成步骤中确定的产物可能表现出高非对映选择性。值得注意的是,在几乎所有检查的腈中,无论是通过1电子过程还是2电子过程,CN 基团都重新定位到本质上不是最容易接近的 C-H 位点的位置,无论是通过1或2电子过程,强调了这种方法在访问难以操纵的C(sp3 )-H 键数据方面的潜力。最后,100个含有烯丙基的 C-H 键是不相容的,导致了复杂的反应混合物。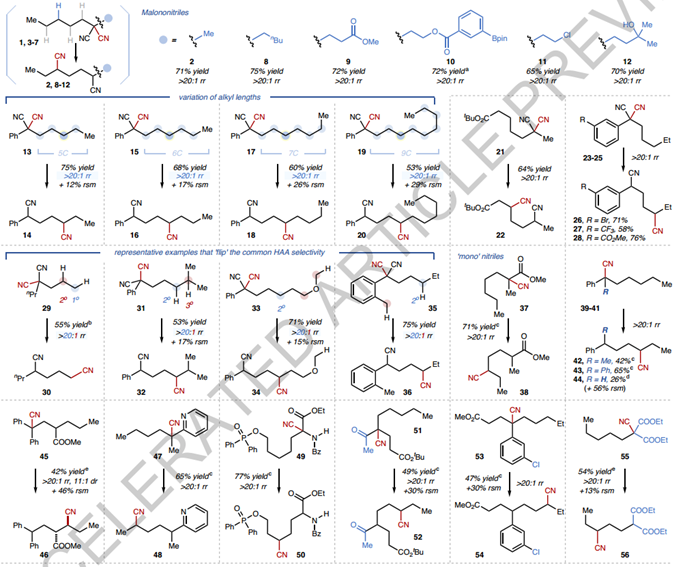 接下来,作者检查了直接跨环 CN 易位,其中涉及桥接(且通常是应变的)双环中间体(图4)。将碳自由基添加到 CN 中形成此类中间体可能在动力学上具有挑战性。与使用卤化物或烯烃的经典自由基生成方案相比,光催化 CN 易位系统从 C-H 键(重新)生成所需碳自由基的能力抵消了过早碳自由基猝灭的风险。事实上,跨环 CN 易位在不同的结构中顺利发生。各种六元环(67、70)、七元环(58、61、64、76)和八元环(73)被发现是合适的,其中CN被置于环状骨架或侧链上。在所有情况下均观察到优异的 1,4-易位选择性,并且使用含有两个潜在1,4-易位目的地的α-氰基环庚酮 64 获得了额外的 17:1γ-选择性。值得注意的是,利用CN的合成多功能性,所有环状腈底物的合成均由原料化学品通过1-2个步骤完成。这与CN易位方法相结合,提供了构建多种多取代碳环的直接途径,这些途径的构建并不简单。例如,以前费力合成与80中相同的功能化模式现在可以通过1-苯并环酮(78)的简洁的两步序列来完成。在另一个例子中,82的位点和非对映选择性CN易位使得能够在9种C-H键的骨架中精确引入CN,这在其他情况下很难实现,并提供了一种具有独特功能的新型构建模块(83)三维属性。作者还进行了其他研究来展示该方法的潜在效用(图5)。首先,通过使用选择性 RARβ2 激动剂(AC 55649)和γ-烷基化四氢吡喃 (87) 作为底物,证明了“C-H 氰化 - CN易位”策略。通过首先在易于官能化的 C-H 位点引入 CN,然后选择性 CN 易位,实现了在非常规 C-H 位点精确获得新型氰化衍生物(图5a)。其次,该方法可用于一些复杂骨架的后期修饰,例如类固醇(91)、肽(92)和生物活性分子(90)的衍生物(图5b)。既不需要多官能化偶联伴侣,也不需要费力的途径,并且产物可以进一步多样化为酰胺(112)、酮(114)、醛(115)、受保护的胺(113)和137二氨基嘧啶(116)CN的简单转化衍生品。此外,CN的合成多功能性和CN易位反应可以结合起来,以加快有价值的构建模块的合成。例如,作为 HBV 抑制剂的关键中间体,二酯 120 之前经过 7 步制备;在此,通过采用 CN 促进的亲核取代、CN 易位以及 CN 转化为酮酯,只需3步即可获得120步骤自2-氰基乙酸甲酯。雌激素受体-β激动剂的前体的合成也是在CN易位的帮助下完成的,再次为7步文献程序提供了简化的替代方案。作者的实验室正在探索其他 FG 易位反应并利用可逆 C-H采样策略进行进一步研究。
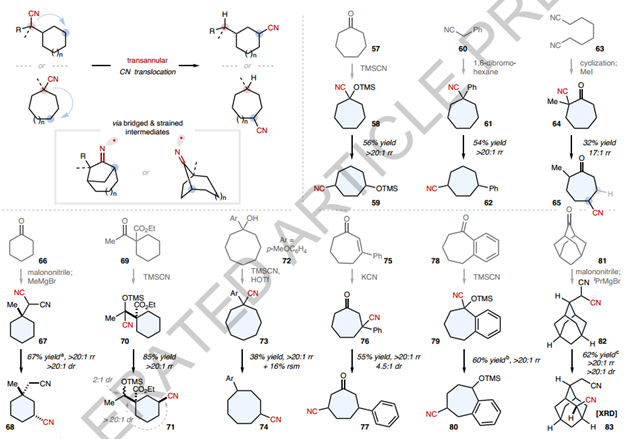
接下来,作者检查了直接跨环 CN 易位,其中涉及桥接(且通常是应变的)双环中间体(图4)。将碳自由基添加到 CN 中形成此类中间体可能在动力学上具有挑战性。与使用卤化物或烯烃的经典自由基生成方案相比,光催化 CN 易位系统从 C-H 键(重新)生成所需碳自由基的能力抵消了过早碳自由基猝灭的风险。事实上,跨环 CN 易位在不同的结构中顺利发生。各种六元环(67、70)、七元环(58、61、64、76)和八元环(73)被发现是合适的,其中CN被置于环状骨架或侧链上。在所有情况下均观察到优异的 1,4-易位选择性,并且使用含有两个潜在1,4-易位目的地的α-氰基环庚酮 64 获得了额外的 17:1γ-选择性。值得注意的是,利用CN的合成多功能性,所有环状腈底物的合成均由原料化学品通过1-2个步骤完成。这与CN易位方法相结合,提供了构建多种多取代碳环的直接途径,这些途径的构建并不简单。例如,以前费力合成与80中相同的功能化模式现在可以通过1-苯并环酮(78)的简洁的两步序列来完成。在另一个例子中,82的位点和非对映选择性CN易位使得能够在9种C-H键的骨架中精确引入CN,这在其他情况下很难实现,并提供了一种具有独特功能的新型构建模块(83)三维属性。作者还进行了其他研究来展示该方法的潜在效用(图5)。首先,通过使用选择性 RARβ2 激动剂(AC 55649)和γ-烷基化四氢吡喃 (87) 作为底物,证明了“C-H 氰化 - CN易位”策略。通过首先在易于官能化的 C-H 位点引入 CN,然后选择性 CN 易位,实现了在非常规 C-H 位点精确获得新型氰化衍生物(图5a)。其次,该方法可用于一些复杂骨架的后期修饰,例如类固醇(91)、肽(92)和生物活性分子(90)的衍生物(图5b)。既不需要多官能化偶联伴侣,也不需要费力的途径,并且产物可以进一步多样化为酰胺(112)、酮(114)、醛(115)、受保护的胺(113)和137二氨基嘧啶(116)CN的简单转化衍生品。此外,CN的合成多功能性和CN易位反应可以结合起来,以加快有价值的构建模块的合成。例如,作为 HBV 抑制剂的关键中间体,二酯 120 之前经过 7 步制备;在此,通过采用 CN 促进的亲核取代、CN 易位以及 CN 转化为酮酯,只需3步即可获得120步骤自2-氰基乙酸甲酯。雌激素受体-β激动剂的前体的合成也是在CN易位的帮助下完成的,再次为7步文献程序提供了简化的替代方案。作者的实验室正在探索其他 FG 易位反应并利用可逆 C-H采样策略进行进一步研究。