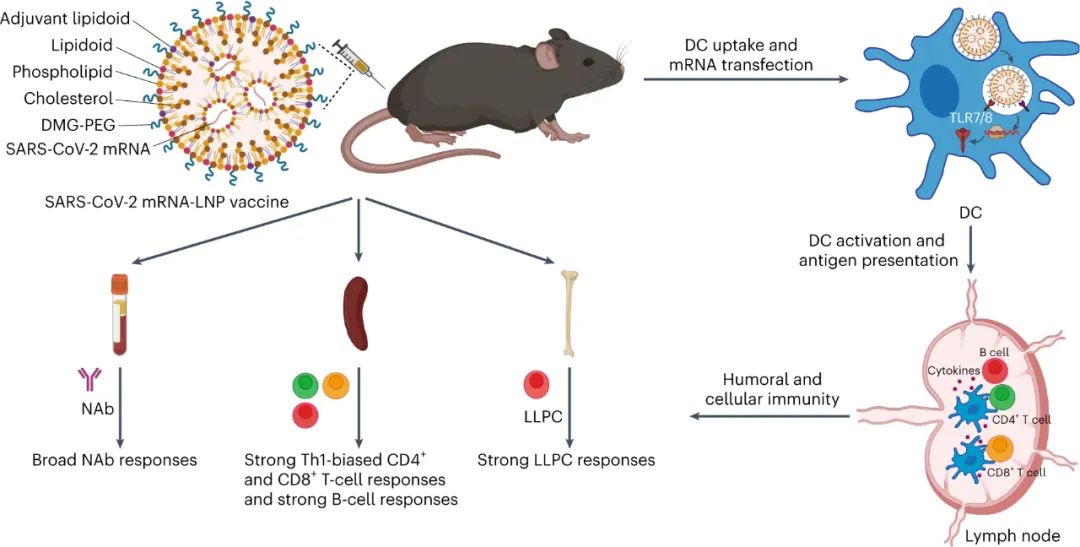
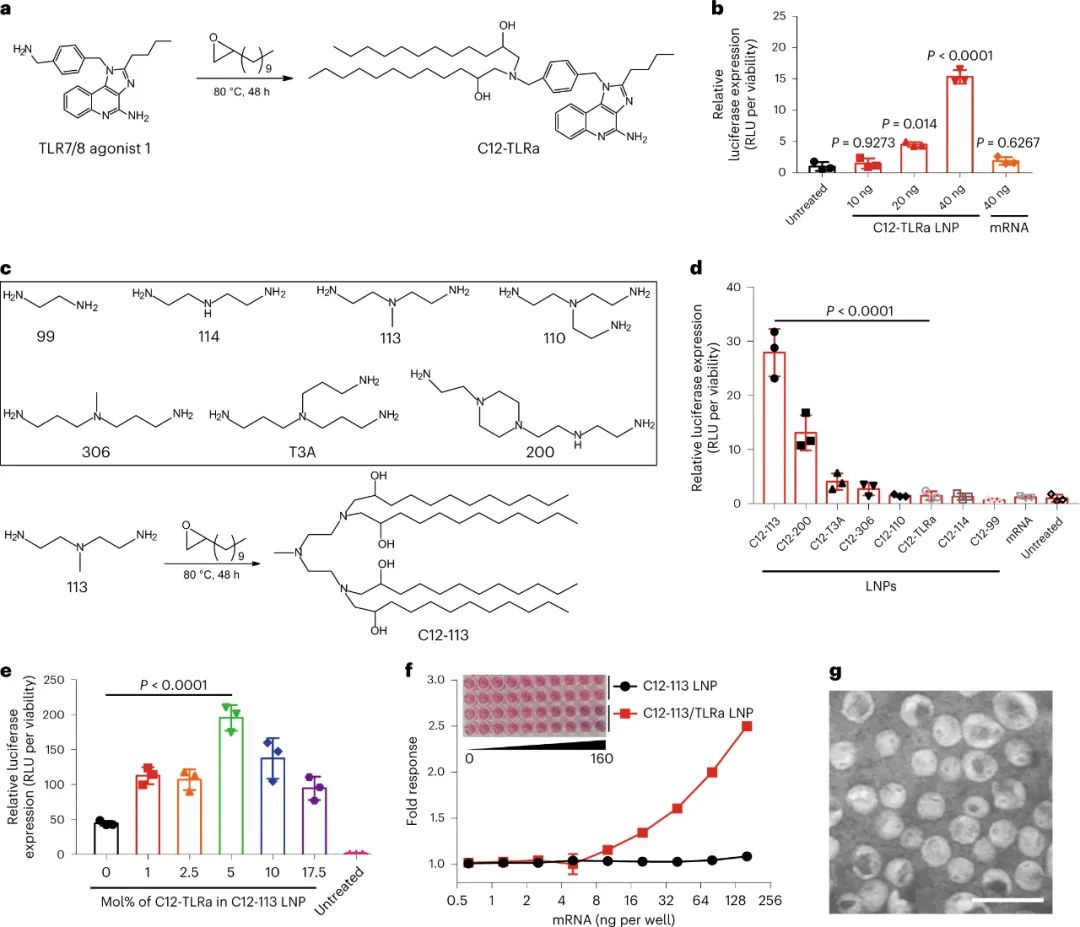
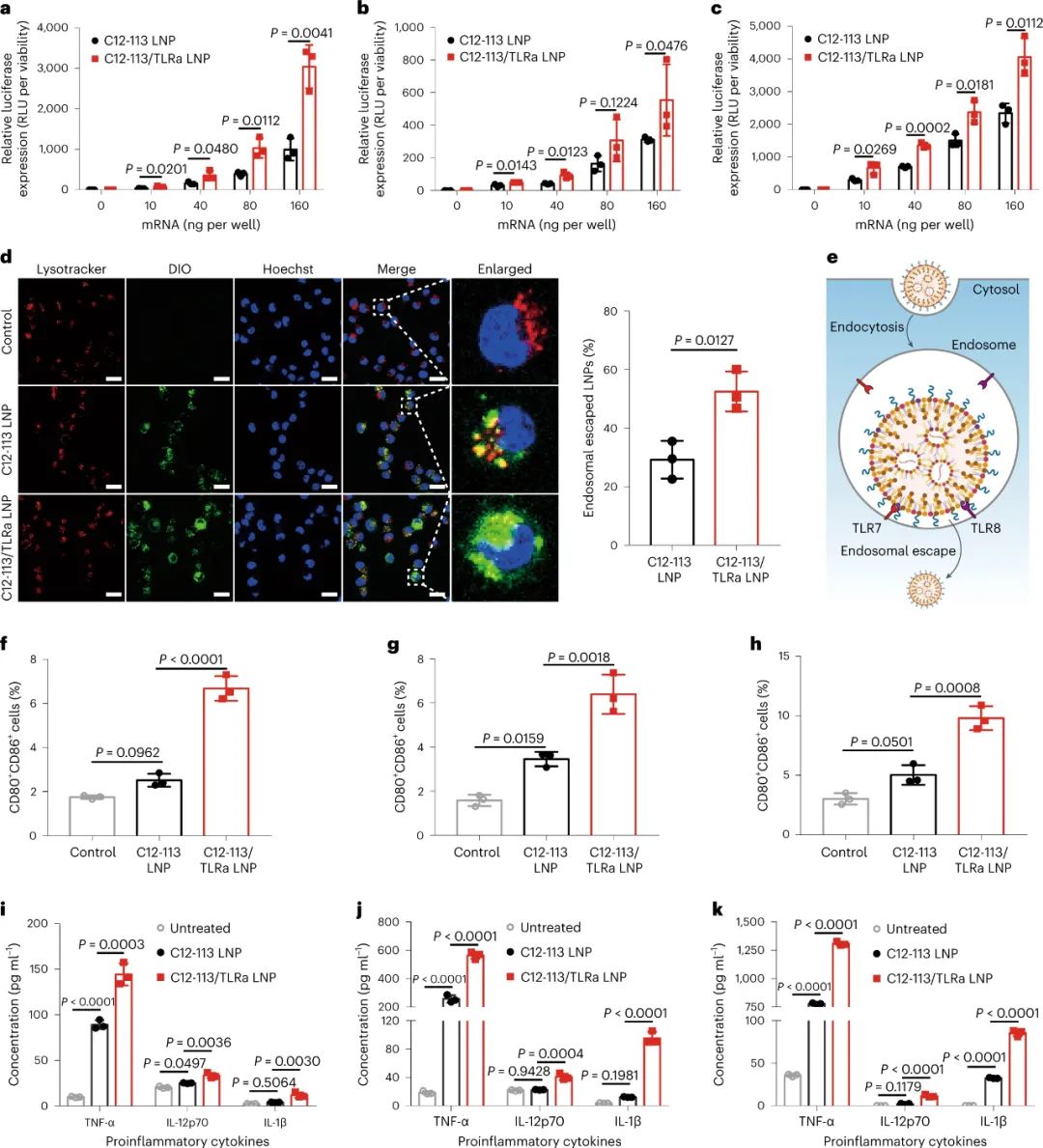
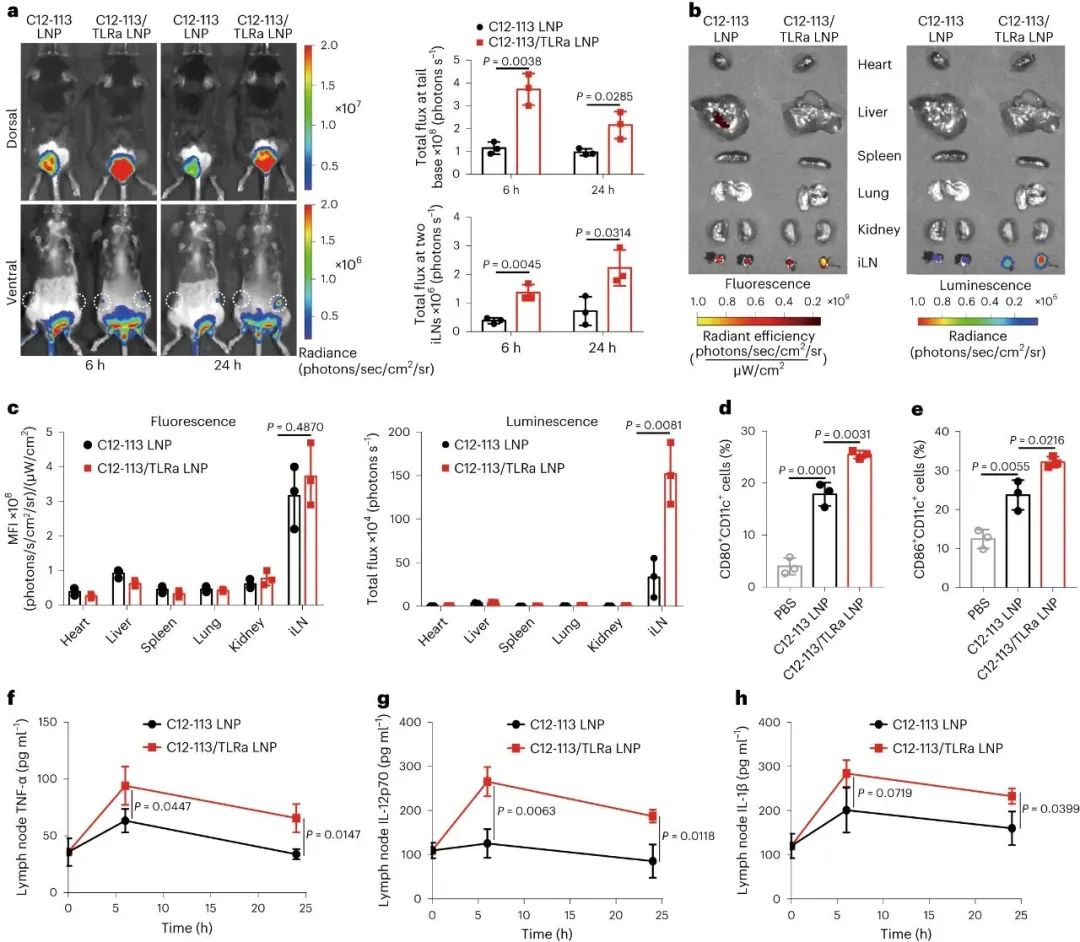
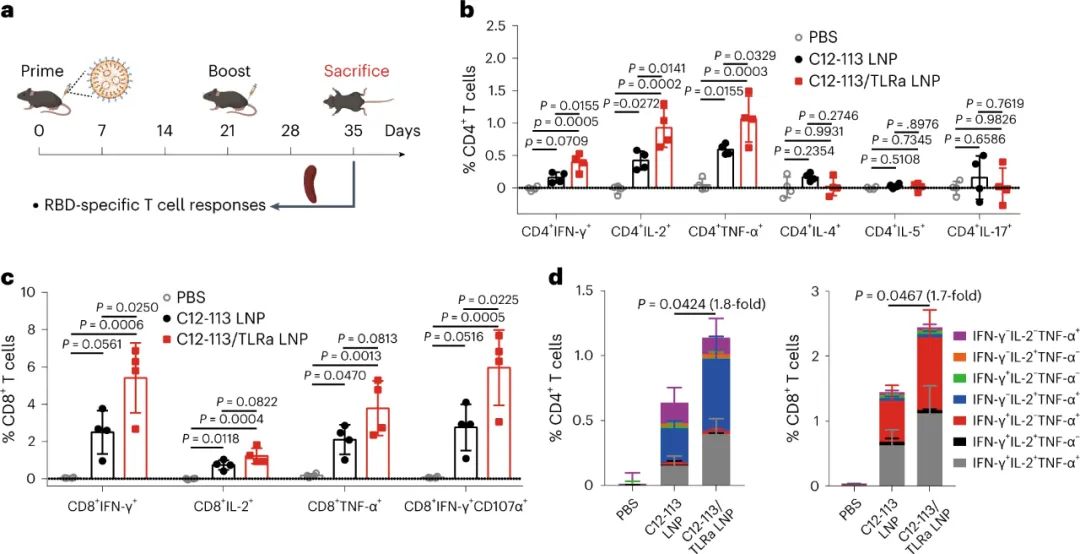
新型冠状病毒(SARS-CoV-2)已导致全球健康危机,迄今为止已造成超过 600 万人死亡。疫苗已被证明可以有效降低这种传染病的发病率和死亡率。目前,多种疫苗模式,包括信使RNA (mRNA)疫苗、表达抗原的腺病毒、灭活病毒和亚单位疫苗,已获批准或正在临床开发中。在不同的平台中,mRNA疫苗不仅表现出优异的能力,能够引发针对多种SARS-CoV-2变体的中和抗体(NAb)和T细胞反应,而且生产成本低,开发和制造时间短。尽管 mRNA 于 1961 年被发现,但由于其易被酶降解、体内递送效率低以及先天免疫原性高,其在疫苗开发中的应用一直受到阻碍。通过将 mRNA 纳入递送系统,可以保护其免遭降解并护送其穿过各种生物屏障,从而克服了前两个挑战。值得注意的是,由可电离脂质(或类脂质)、磷脂、聚乙二醇化脂质和胆固醇组成的四组分脂质纳米粒子(LNP)是临床上最先进的mRNA递送平台,辉瑞/BioNTech的BNT162b2和Moderna的mRNA-1273疫苗就是例证。最后一个挑战是通过将天然存在的核苷(例如 1-甲基假尿苷 (m1ψ))掺入体外转录的 mRNA 序列以避免其被模式识别受体识别来解决。尽管其耐受性和翻译能力有所提高,但核苷修饰的 mRNA 的使用在很大程度上损害了先天免疫反应,并削弱了树突状细胞(DC,mRNA-LNP 疫苗的主要受体细胞)的激活,而这一过程对建立对疫苗接种的强大适应性免疫力至关重要。有趣的是,先前研究人员发现某些 LNP 具有内在的佐剂活性,可以促进 mRNA 和亚单位疫苗诱导细胞和体液免疫反应。然而,LNP 的佐剂作用根据所使用的类脂质而变化,并且通常较弱且非特异性。Toll样受体激动剂(TLRas)是一种有效的佐剂,可激活DC呈递抗原,表达共刺激分子,并产生选择性细胞因子(例如,肿瘤坏死因子-α(TNF-α)),有效刺激从先天免疫向适应性免疫的转变。几种具有高特异性的小分子 TLRas 已被批准用于免疫调节,包括基于咪唑喹啉的 TLR7/8 激动剂(例如咪喹莫特)。已证明将脂肪酸修饰的 TLRas 掺入负载抗原的脂质体或 NP 中可以增强适应性免疫反应的强度和持续时间。研究人员假设,由于辅助佐剂特性,将合理设计的 TLRa 衍生的可电离类脂质配制到 LNP 中可以进一步增强 mRNA-LNP 疫苗的免疫原性。鉴于此,宾夕法尼亚大学Michael J. Mitchell、Drew Weissman等人基于 TLR7/8 激动剂化学合成了一种 LNP 成分(一种类脂佐剂)。与之前的研究不同,TLRa通常通过酰化与大分子(例如脂质、肽和聚合物)缀合,研究人员在含胺的TLRa和环氧化物烷基之间进行开环反应,产生含有叔胺的可电离脂质,该脂质可以与带负电荷的信使核糖核酸复合并将其输送到细胞中。研究人员优化了这种佐剂类脂掺入的 SARS-CoV-2 mRNA-LNP 疫苗的配方,并系统地评估了其先天性和适应性免疫反应图 类脂质替代佐剂 SARS-CoV-2 mRNA-LNP 疫苗及其拟议的引发有效适应性免疫的作用机制C12-TLRa是一种合成的类脂质化合物,源自 TLR7/8 激动剂和 C12 环氧化物。其结构得以证实,计算分析表明其与 TLR7 受体相容。C12-TLRa 表现出可预测的 TLR7 激动活性,但不如同类激动剂有效。它与其他脂质和 mRNA 一起配制为脂质纳米颗粒 (LNP),有效封装 mRNA。由此产生的 C12-TLRa LNP 在树突状细胞中证明了剂量依赖性 mRNA 转染。与其他多胺衍生的类脂质相比,C12-TLRa 被发现具有较低的转染能力。为了增强 mRNA 疫苗中的抗原表达,C12-113 LNP 中的可电离类脂质被 C12-TLRa 部分替换,以添加 TLR7/8 激动特性而不影响 mRNA 递送。配制并测试了各种C12-113/TLRa LNP,5% C12-TLRa取代实现了最高的 mRNA 转染效率。与 C12-113 LNP 不同,C12-113/TLRa LNP 显示剂量依赖性 TLR7 激动活性并刺激 TNF-α 产生。使用不同类脂质的其他 LNP 也获得了类似的结果。理化表征揭示了 C12-113/TLRa LNP 的稳定性和均匀结构,与 C12-113 LNP 相当。与 C12-113 LNP相比,C12-113/TLRa LNP 在各种细胞类型中表现出优异的 mRNA 转染效率,且无细胞毒性。C12-TLRa的掺入改善了 LNP 的内体逃逸,从而增强了 mRNA 的递送。C12-TLRa 和内体 TLR7/8 之间的强亲和力可能增强了 LNP 和内体膜之间的相互作用。此外,与 C12-113 LNP 相比,C12-113/TLRa LNP 诱导树突状细胞更加成熟,并增加促炎细胞因子的分泌。这些发现表明,C12-TLRa 取代显著增强了 LNP 的佐剂特性和树突状细胞的激活。图 佐剂类脂质取代的 LNP 介导的体外 mRNA 递送和 DC 激活体内实验表明,与C12-113 LNP相比,C12-113/TLRa LNP在注射部位和腹股沟淋巴结获得了更高的mRNA转染效率。两种 LNP 在主要器官中均表现出有限的分布和转染,其中 C12-113/TLRa LNP 在腹股沟淋巴结中观察到更强的转染。C12-113/TLRa LNP 增强的 mRNA 表达随着时间的推移是持久且一致的。此外,C12-113/TLRa LNP 促进树突状细胞进一步成熟,并在淋巴结中引发更高、更持久的细胞因子反应,而没有明显的全身分布或炎症。这些发现表明,在SARS-CoV-2 mRNA-LNP疫苗接种的情况下,C12 TLRa取代显著增强 mRNA 表达和局部先天免疫反应,而不会引起全身毒性。佐剂类脂质取代的 LNP 介导的体内 mRNA 递送和先天免疫反应进一步检查了原始和类脂替代佐剂 SARS-CoV-2 mRNA-LNP 疫苗产生的适应性免疫反应。小鼠使用初免-加强策略接受了两次疫苗接种,没有观察到不良反应。加强剂量后两周,收集脾脏并分析抗原特异性 CD4+和 CD8+ T 细胞。两种 LNP 都能诱导表达Th1细胞因子的RBD 特异性 CD4+ T 细胞,但C12-113/TLRa LNP 引发的反应明显更高。两种疫苗制剂均不能诱导表达 Th2 细胞因子的 CD4+ T 细胞。C12-113/TLRa LNP 还诱导更多表达 Th1 细胞因子和细胞毒性标记物的 RBD 特异性 CD8+ T 细胞。此外,与 C12-113 LNP 相比,C12-113/TLRa LNP 引发了更高比例的多功能CD4+和 CD8+ T 细胞,表明免疫反应更强。这些双阳性细胞的细胞因子分泌模式在CD4+和 CD8+ T 细胞之间有所不同,反映了它们各自的辅助和细胞毒活性。图 由佐剂类脂替代的 SARS-CoV-2 mRNA-LNP 疫苗诱导的细胞免疫反应分析了 SARS-CoV-2 mRNA-LNP 疫苗诱导的体液免疫反应。两种疫苗均引发高水平的RBD 特异性 IgG 抗体,但 C12-113/TLRa LNP 的滴度明显更高。与 C12-113 LNP 相比,C12-113/TLRa LNP 还引发了更高水平的 IgG2c 抗体,表明更强的Th1 偏向免疫反应。就中和抗体 (NAb) 水平而言,C12-113/TLRa LNP 针对不同的 SARS-CoV-2 变体产生了更多的NAb。此外,与 C12-113 LNP 相比,C12-113/TLRa LNP 疫苗接种更大程度地增加了 RBD 特异性记忆 B 细胞和骨髓驻留长寿命浆细胞 (LLPC) 的数量。这些发现表明,类脂质替代的 mRNA-LNP 佐剂疫苗可诱导更强的体液免疫反应和 LLPC 生成。
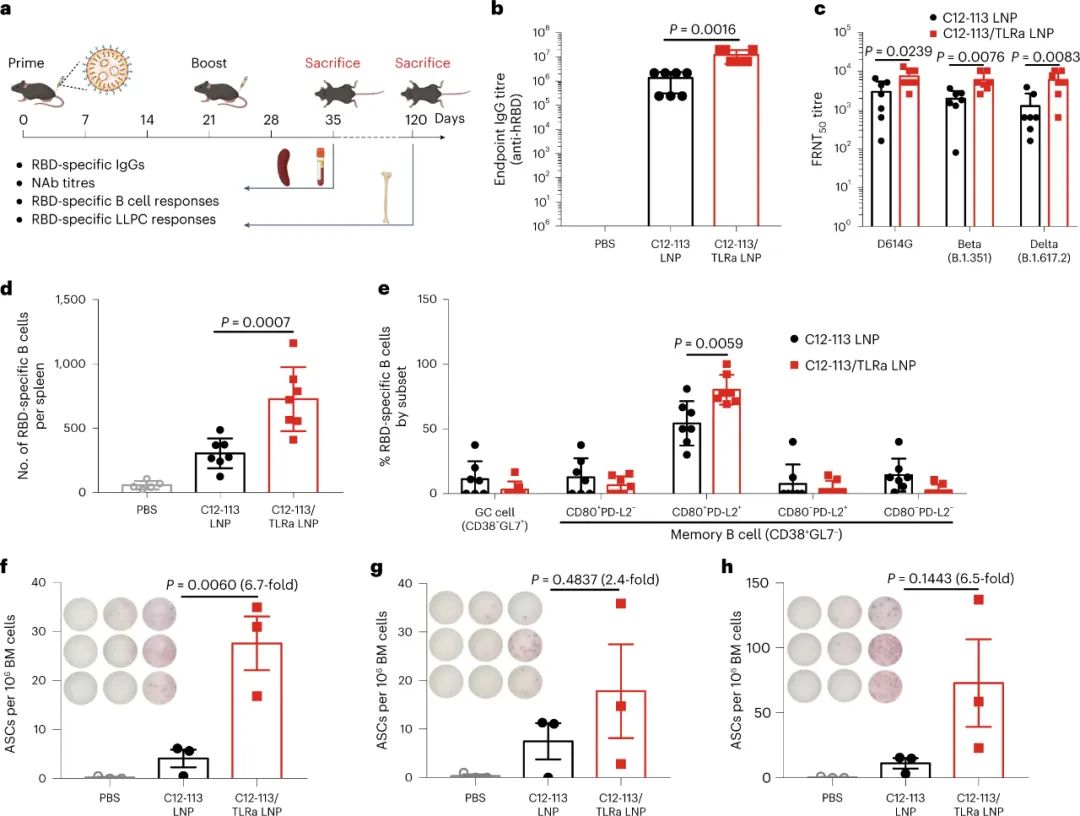
图 由佐剂类脂替代的 SARS-CoV-2 mRNA-LNP 疫苗诱导的体液免疫反应该研究调查了佐剂类脂质替代对临床相关 mRNA-LNP 疫苗的影响。对 SM-102 LNP 和 SM-102/TLRa LNP 配方进行了比较。结果表明,与 SM-102 LNP 相比,SM-102/TLRa LNP 实现了更大的 mRNA 转染,并引发了表达 Th1 细胞因子的 RBD 特异性CD4+和 CD8+ T 细胞比例明显更高。SM-102/TLRa LNP还诱导更多的 RBD 特异性细胞毒性 CD8+T 细胞以及更高比例的多功能CD4+和CD8+ T 细胞。在体液免疫反应方面,SM-102/TLRa LNP 产生了更高水平的抗 RBD IgG 抗体和针对不同 SARS-CoV-2 变体的更多中和抗体。此外,SM-102/TLRa LNP 诱导了更多 RBD 特异性记忆 B 细胞,具有快速分化为抗体分泌细胞的潜力。这些发现表明,佐剂类脂质替代增强了临床相关 mRNA-LNP 疫苗的免疫原性,表明了其转化潜力。研究人员开发了一种可电离的类脂质——一种佐剂类脂质——它不仅作为 LNP 的结构成分来增强 mRNA 的递送,而且还作为功能部分来增加 LNP 的佐剂作用。佐剂类脂替代的 SARS-CoV-2 mRNA-LNP 疫苗显着增强淋巴内 DC 激活和结内促炎细胞因子的产生,由于其在注射部位和引流淋巴结的独特分布和转染,在小鼠中具有良好的耐受性。由于先天免疫的改善,使用类脂替代mRNA-LNP佐剂疫苗免疫后,建立了更有效的针对SARS-CoV-2的适应性免疫,包括强烈的Th1偏向细胞免疫反应、抗体反应、B细胞反应和LLPC反应 。此外,研究人员证实佐剂类脂替代可以增强临床相关 mRNA-LNP 疫苗的免疫原性。该研究为引入类脂质佐剂以提高 mRNA 疫苗适应性免疫反应的质量和程度提供了 LNP 配方基础。Han, X., Alameh, MG., Butowska, K. et al. Adjuvant lipidoid-substituted lipid nanoparticles augment the immunogenicity of SARS-CoV-2 mRNA vaccines. Nat. Nanotechnol. (2023).https://doi.org/10.1038/s41565-023-01404-4