光驱动癌症疗法(例如光动力疗法(PDT))的出现引起了越来越多的兴趣。与传统化疗相比,这些光激活治疗具有多种独特的优势,包括时间和空间上可控的激活、不与化疗药物产生交叉耐药性以及微创性。迄今为止,这些 PDT 药物的治疗效果非常有希望。几种作为 PDT 活性剂的光敏剂 (PS) 已被批准用于临床癌症治疗,还有许多其他药物正在进行临床试验。
典型的 PS 会间接损害生物分子:需要氧气来产生活性氧 (ROS) 以诱导细胞死亡。然而,大多数实体瘤组织具有缺氧微环境的特点,这极大地限制了传统PS的抗癌功效。尽管某些 I 型 PS 并不完全依赖氧气来产生 ROS,但这些试剂仍然不能通过直接破坏细胞内生物分子来杀死细胞。因此,所产生的 ROS的细胞损伤效率仍然会受到低水平的氧气、内源性细胞内还原剂和 PS 有限的量子产率的影响。此外,这些PDT药物的进一步应用仍然受到其短波长激发光相对较低的组织穿透能力的限制。除此之外,癌细胞有多种机制可以恢复被 PS 产生的 ROS 破坏的细胞内氧化还原平衡,从而在使用传统 PS 时导致耐药性问题。除了细胞内氧化还原平衡外,其他类型的细胞内稳态如细胞内pH(intracellular pH, pHi)也可以通过协同机制来解决耐药问题;癌细胞相对较高的pHi不仅有利于癌症的增殖、转移和侵袭性,而且还会导致治疗耐药性。
因此,开发能够直接氧化细胞内成分并以不依赖于氧的方式有效破坏pHi 稳态来消除癌细胞的长波长光激活抗癌药物不仅有望解决传统 PDT 药物的局限性,还有望降低癌症恶性度。
开发可以双光子激发(TPE)方式激发的化合物已被证明是延长激发波长的有效策略。鉴于此,香港城市大学朱光宇、何明亮等研究人员将此策略应用于可光活化的Pt(IV)配合物。

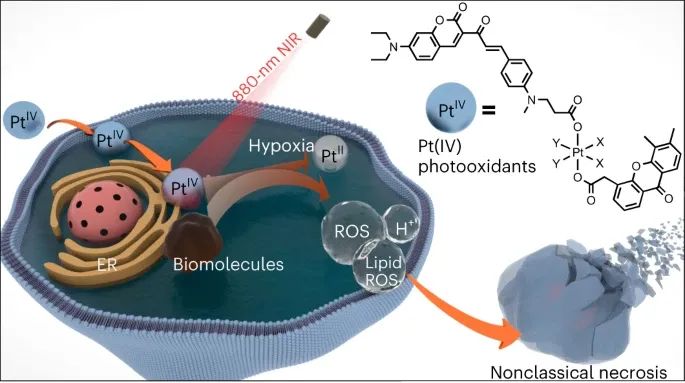
示意图
设计、合成、表征和光化学
首先,研究人员设计和合成了一种基于香豆素的光敏配体(配体3),可以通过880纳米激光进行双光子激发。已有研究表明,将过渡金属引入光敏剂可提高光动力疗法效率,并产生更多的激发态电子构型。研究人员将配体3与Pt(IV)配合物结合,以获得改进的近红外激活Pt(IV)配合物。合成了两个配合物5a和5b,并证明它们在细胞中具有高稳定性和高效的光活化。这是首次实现通过双光子激发的近红外光活化小分子Pt(IV)配合物。
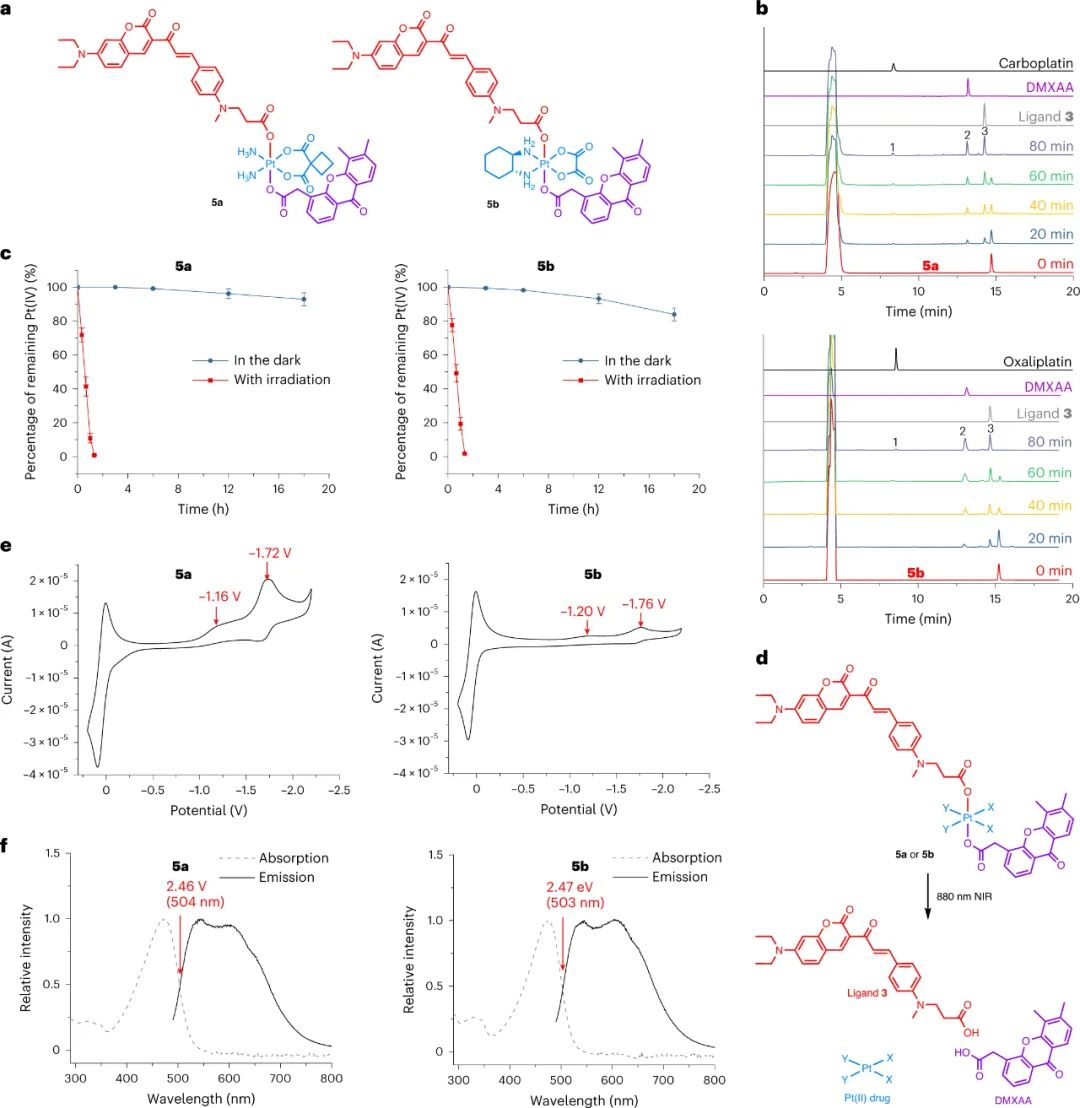
图|5a和5b的光活化和电化学性质
电化学和光氧化性能
激发态还原电位实验表明,与铂的缀合可以显着增强有机光敏配体的光氧化能力。由于它们显示出强大的光氧化剂潜力,研究人员进一步测量了它们的光氧化能力。研究人员假设在生物环境中,常规生物分子很可能充当电子给体,并被Pt(IV)配合物氧化。为了证实这一假设,研究人员研究了5a和5b对多种生物分子的氧化能力,包括NADH、血红素、DNA、牛血清白蛋白(BSA)和细胞裂解液中的蛋白质。总体而言,5a和5b能够有效地氧化这些生物分子,即使在没有氧气的情况下。实验结果证实了将铂引入有机光敏配体中不仅极大地提高了配体的光动力疗法效率,而且赋予了所得配合物氧独立的光氧化能力。研究人员将这种效应称为金属增强型光氧化,并预期这种强大的光氧化能力可能导致增强的抗癌效果。
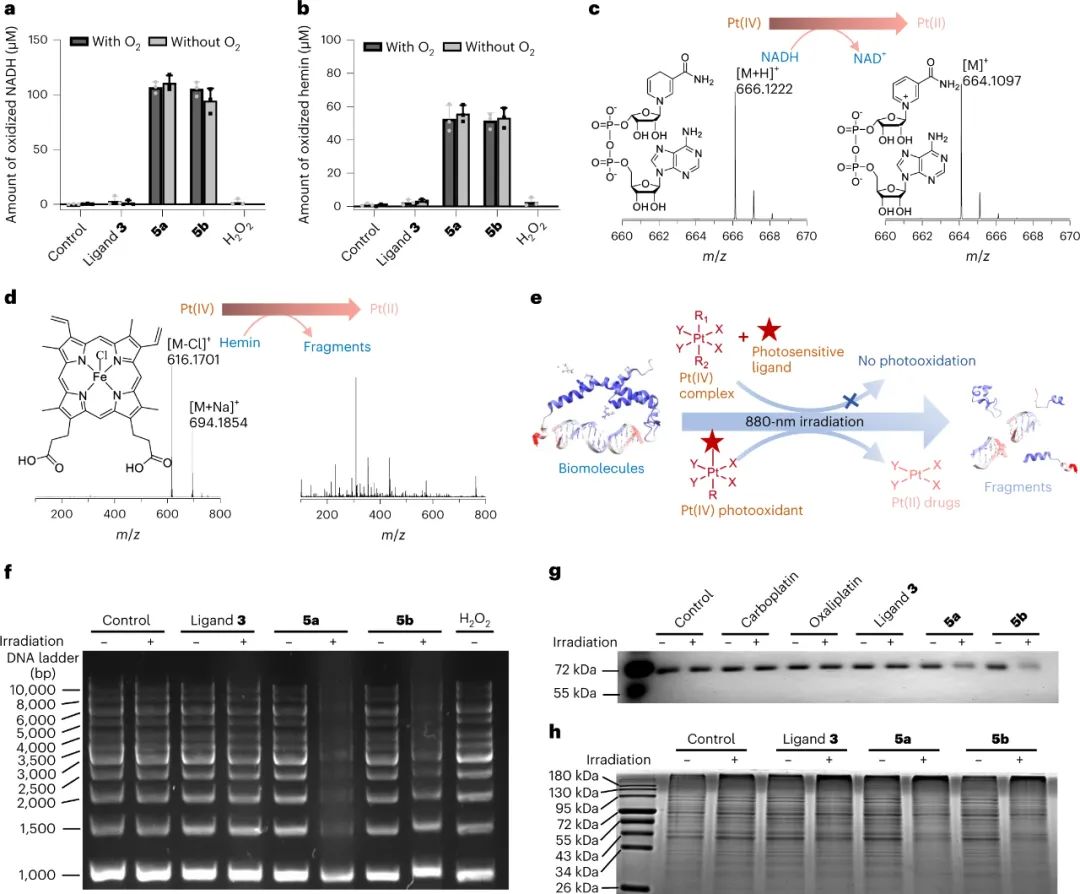
图|光氧化剂5a和5b在NIR光活化时有效地氧化了传统的细胞内生物分子。
在内质网中积累
在确认光氧化剂在激活后氧化生物分子的能力后,下一步是评估其细胞渗透能力,这对于其抗癌作用至关重要。癌症干细胞(CSC)在肿瘤对传统治疗的耐药性中发挥着重要作用。因此,以 CSC 为目标是非常可取的。检查了肺癌干细胞 (LCSC) 中 5a 和 5b 的细胞积聚,结果显示与其相应的 Pt(II) 药物相比,细胞内积聚增加。在三维肿瘤球体模型中,两种光氧化剂有效渗透核心区域,而配体 3 保留在外层。定位研究表明,5a 和 5b 主要在内质网 (ER)区域积累。
在体外具有很高的光细胞毒性
实验结果表明,5a和5b是有效的光氧化剂,可以氧化生物分子并积累在内质网中。它们对多种癌细胞系表现出显著的光细胞毒性,在黑暗条件下无毒。5a和5b的光细胞毒性明显高于对应的Pt(II)药物,并显示出低抗药性。这些光氧化剂在缺氧条件下仍保持光细胞毒性,而传统的光动力疗法药物不具备这种特性。在三维肿瘤球模型中,5a和5b有效地杀死癌细胞,而Pt(II)药物和配体3则无效。研究揭示了5a的细胞内作用机制,包括诱导氧化应激、降低细胞内pH和引发内质网应激。5a的荧光光谱在光激活后发生了偏移,表明细胞内pH下降。总体而言,这些实验结果表明合成的光氧化剂具有优越的抗癌活性和独特的作用机制,相比传统的化疗或光动力疗法药物有着明显的优势。
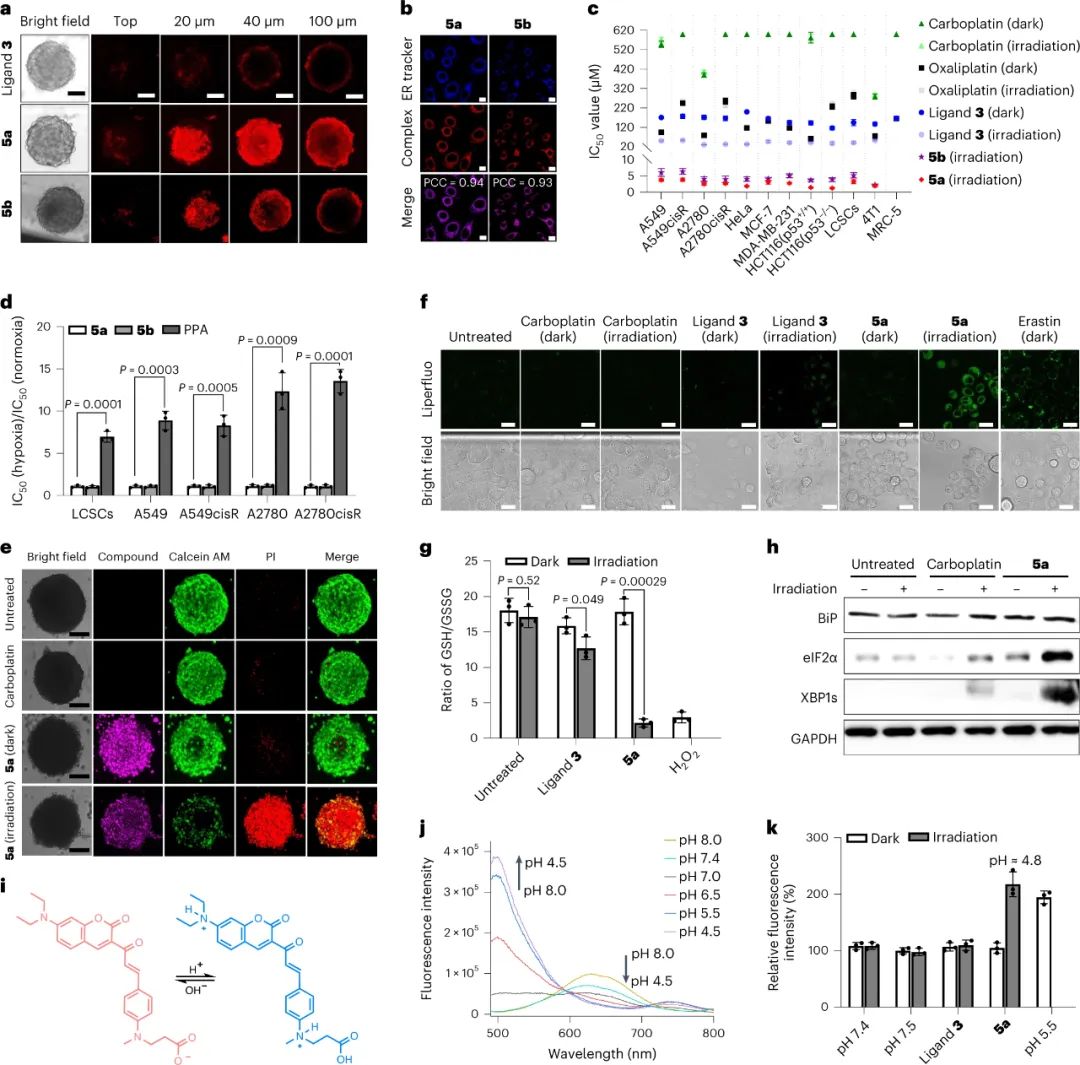
图|光氧化剂5a和5b在内质网中积累,并在NIR光激活后有效清除癌症细胞
诱导非经典性坏死
进一步的分析表明,5a诱导的细胞死亡与铁死亡(ferroptosis)具有相似特征,但与典型的铁死亡不同,5a诱导的细胞死亡不依赖于铁元素。同时,5a处理后细胞中出现大量的脂质过氧化产物,而添加铁死亡抑制剂也无法减少这些产物的生成。此外,5a诱导的细胞死亡与DNA损伤无关,而是由于强烈的细胞内氧化应激和降低的细胞内pH引起。此外,5a还能诱导免疫细胞死亡,并激活免疫细胞,进一步提高抗癌效果。总之,这些实验结果揭示了5a在细胞死亡机制上的独特性,通过氧化应激和降低细胞内pH实现非典型的细胞坏死。
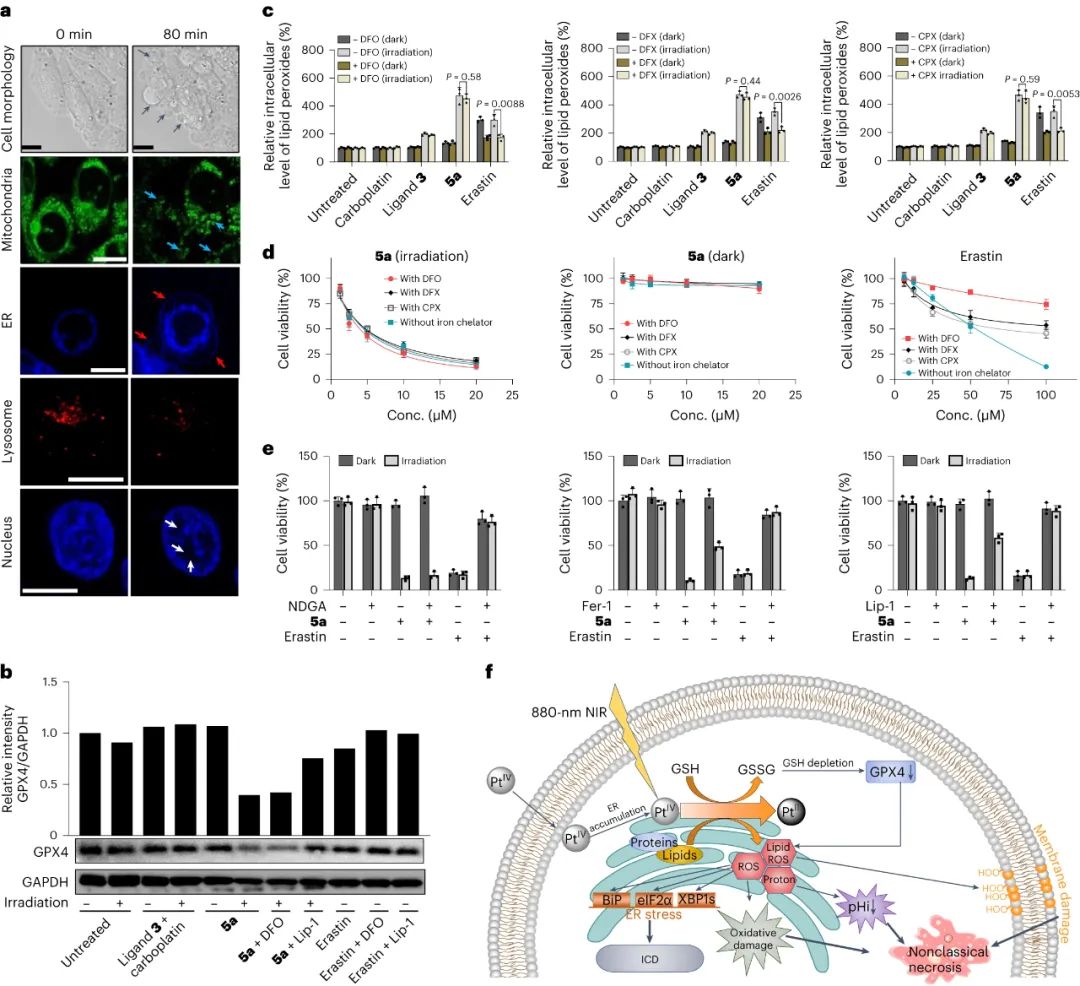
图|光氧化剂5a在光活化后诱导非经典坏死
体内肿瘤抑制和免疫系统激活
最后,研究人员还检查了5a的体内肿瘤抑制效果和免疫系统激活。用光激活5a治疗后,小鼠的肿瘤体积和肿瘤重量都得以大幅度地减小。在光激活5a处理的小鼠肿瘤组织中,CD4+ 和CD8+ T细胞数量分别大幅增加了7倍和23倍,表明光激活5a可以激活免疫系统并在肿瘤微环境中招募免疫细胞,这有助于其抗肿瘤和抗转移作用。
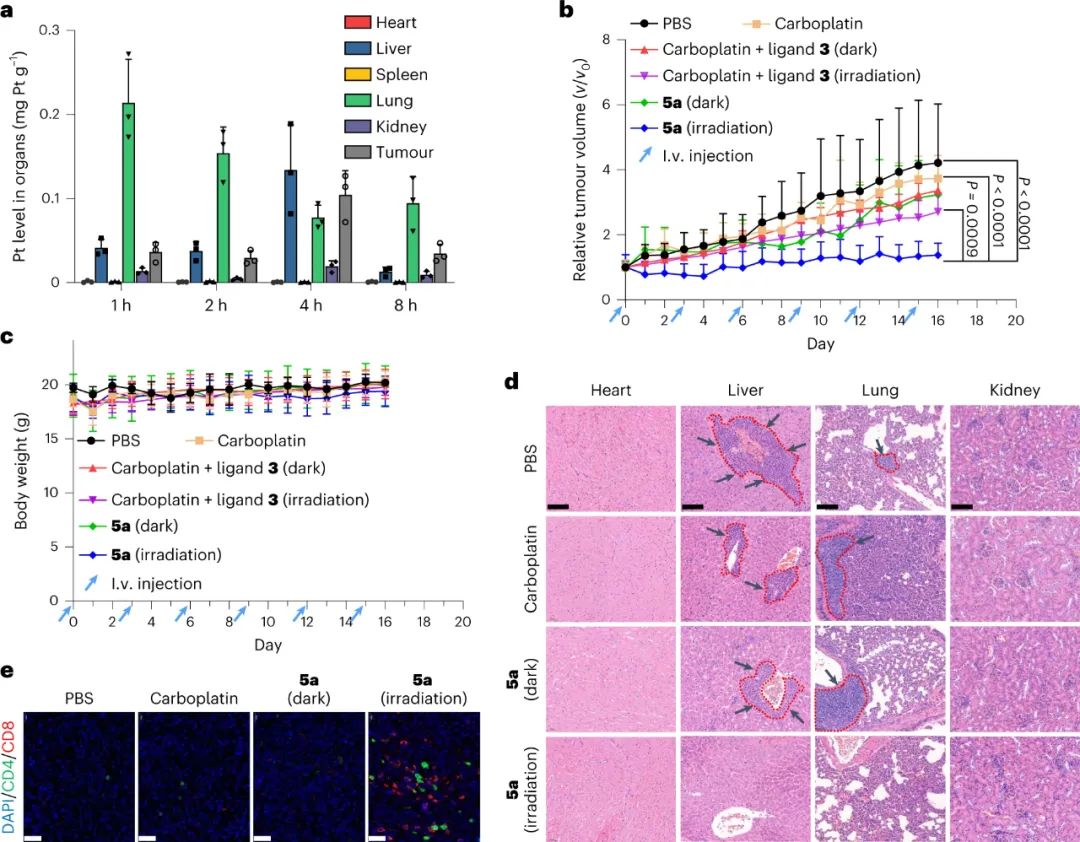
图|体内抗肿瘤作用
小结:
综上所述,基于金属增强光氧化的意想不到的效果,研究人员开发了一类近红外激活的Pt(IV)光氧化剂,它可以直接氧化细胞内生物分子,并以可控的方式在体外和体内有效地消灭肿瘤细胞。与经典的抗癌PSs相比,这些Pt(IV)光氧化剂具有更长的激活波长,这提高了它们的组织渗透能力并扩大了它们在癌症治疗中的潜在应用。
这项研究提供了开发近红外激活的 Pt(IV) 抗癌光氧化剂的策略,克服了使用传统 PS 和化疗药物的主要障碍。此外,结果强调了光活化抗癌金属配合物的光氧化特性及其独特的细胞杀伤模式的重要性。作为概念证明,这项研究表明基于金属增强光氧化的光氧化剂的开发是金属药物设计的一个有前途的方向。
参考文献:
Deng, Z., Li, H., Chen, S. et al. Near-infrared-activated anticancer platinum(IV) complexes directly photooxidize biomolecules in an oxygen-independent manner. Nat. Chem. (2023).
https://doi.org/10.1038/s41557-023-01242-w











