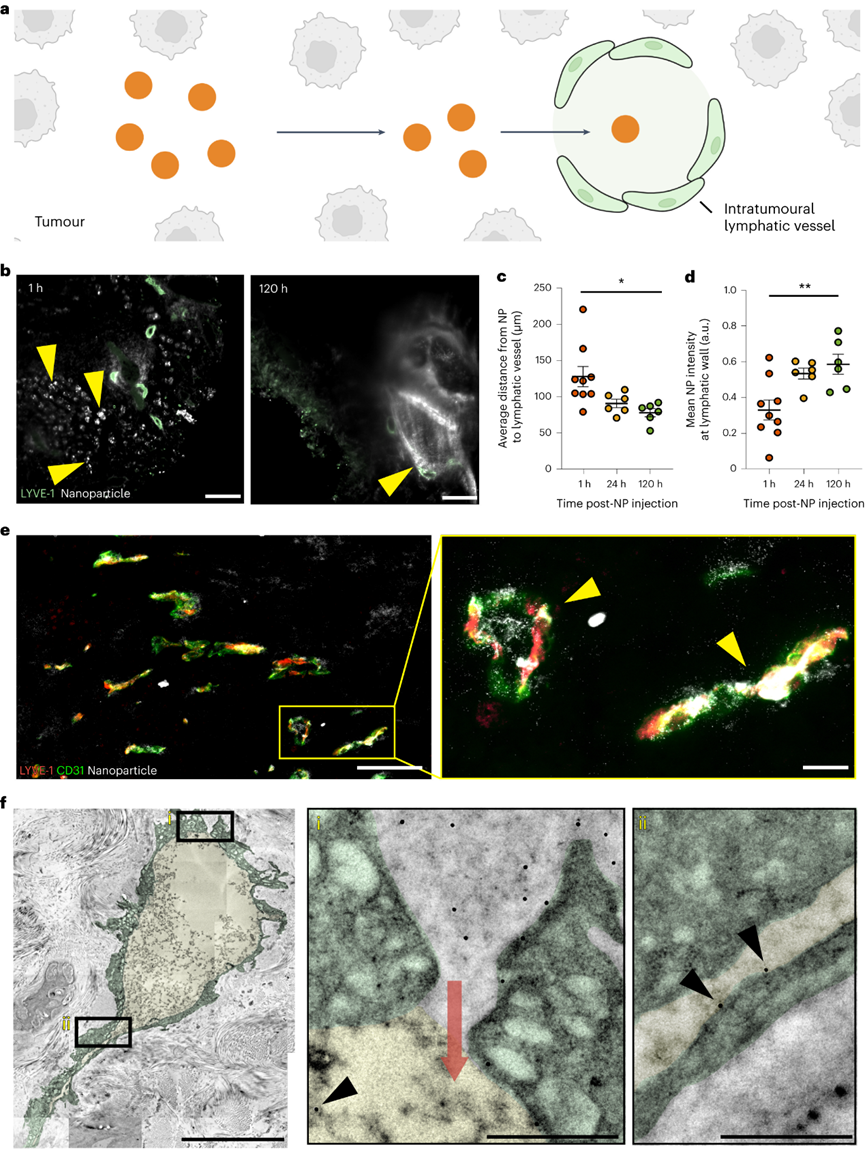
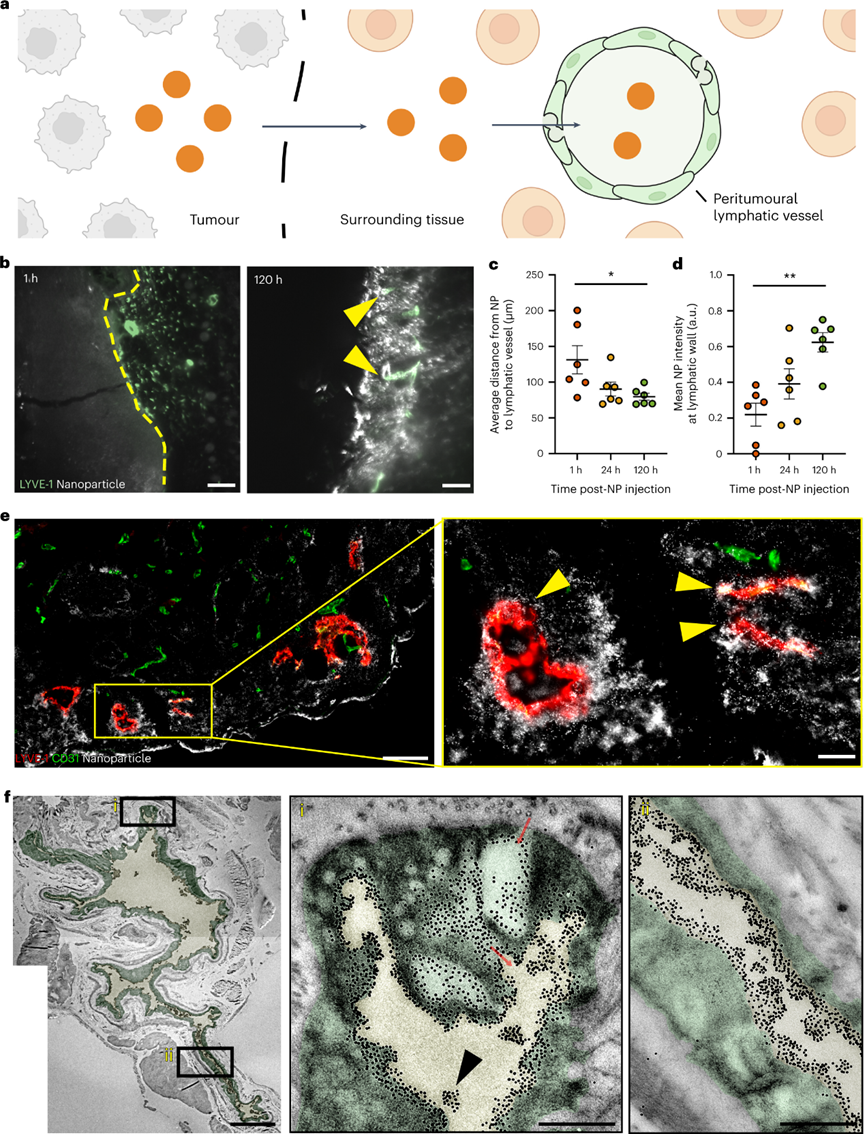
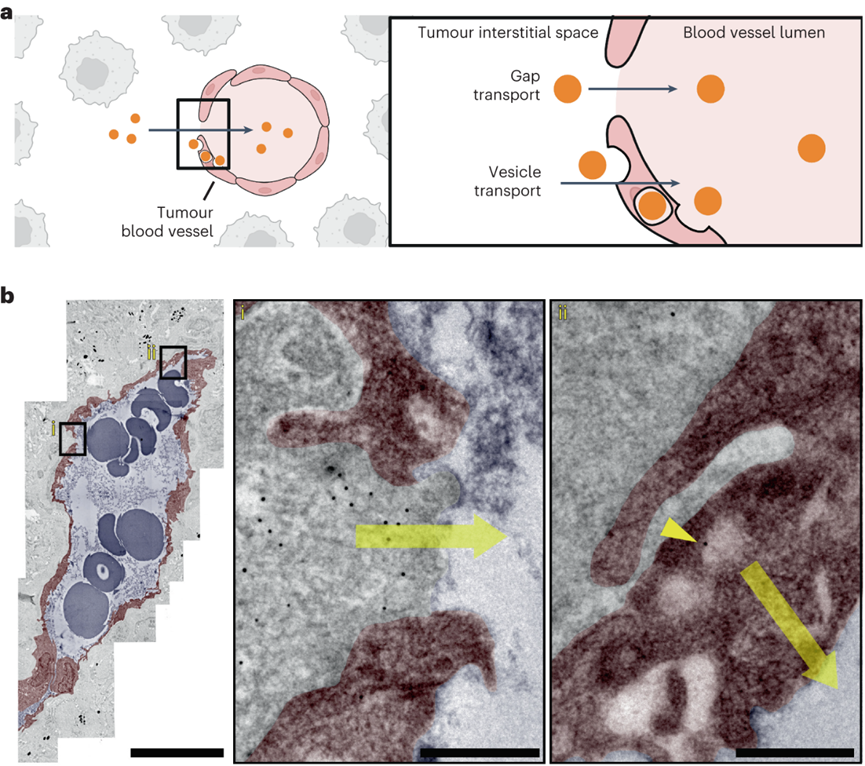
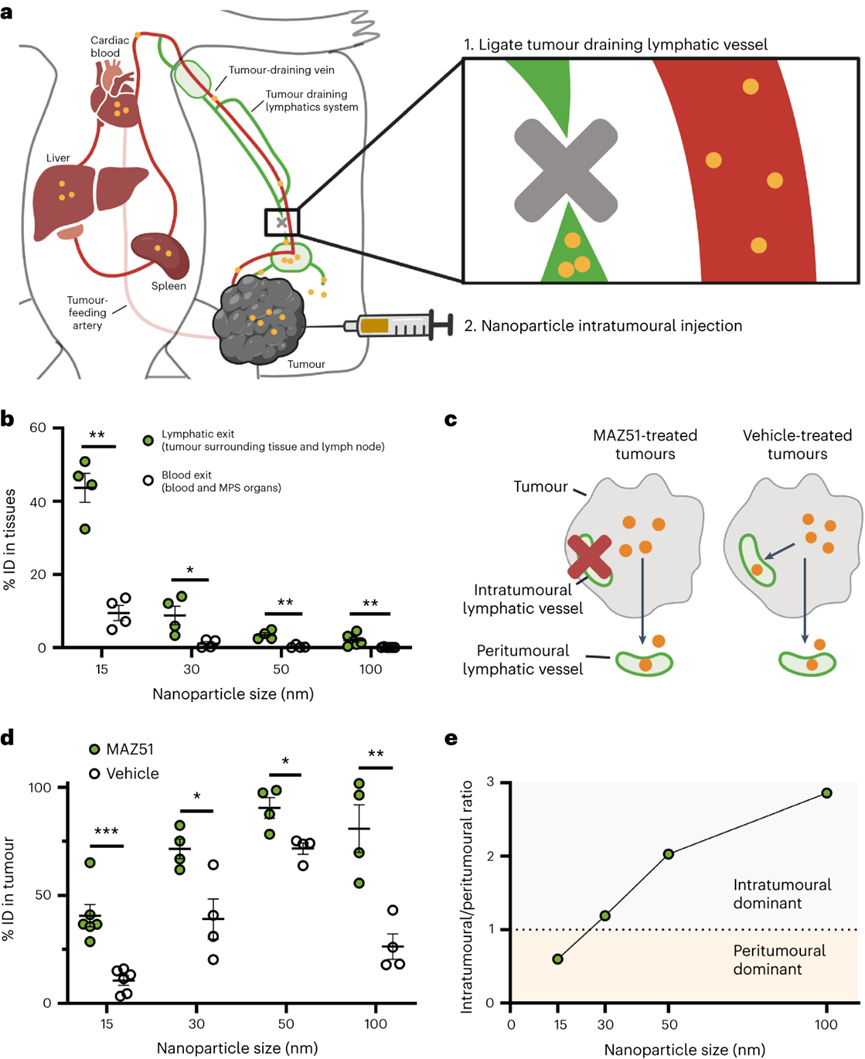
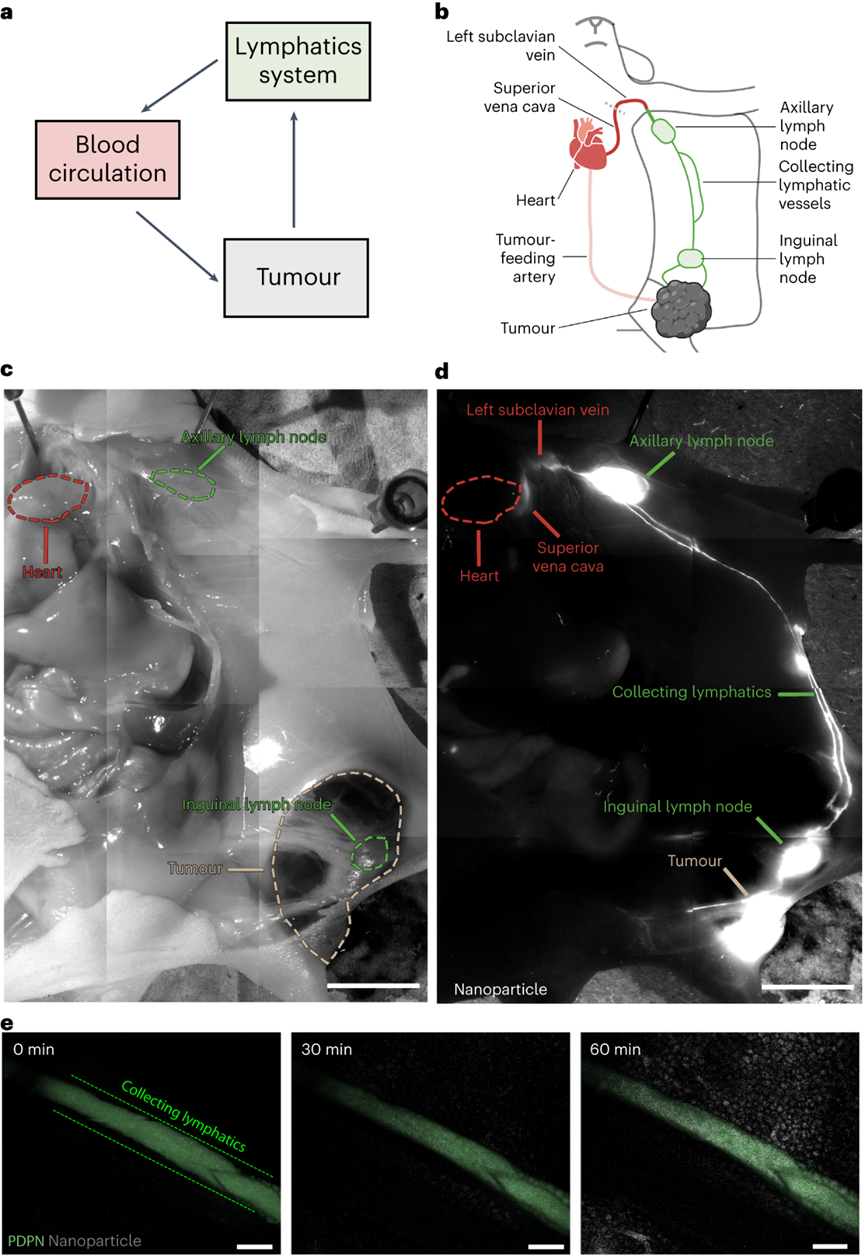
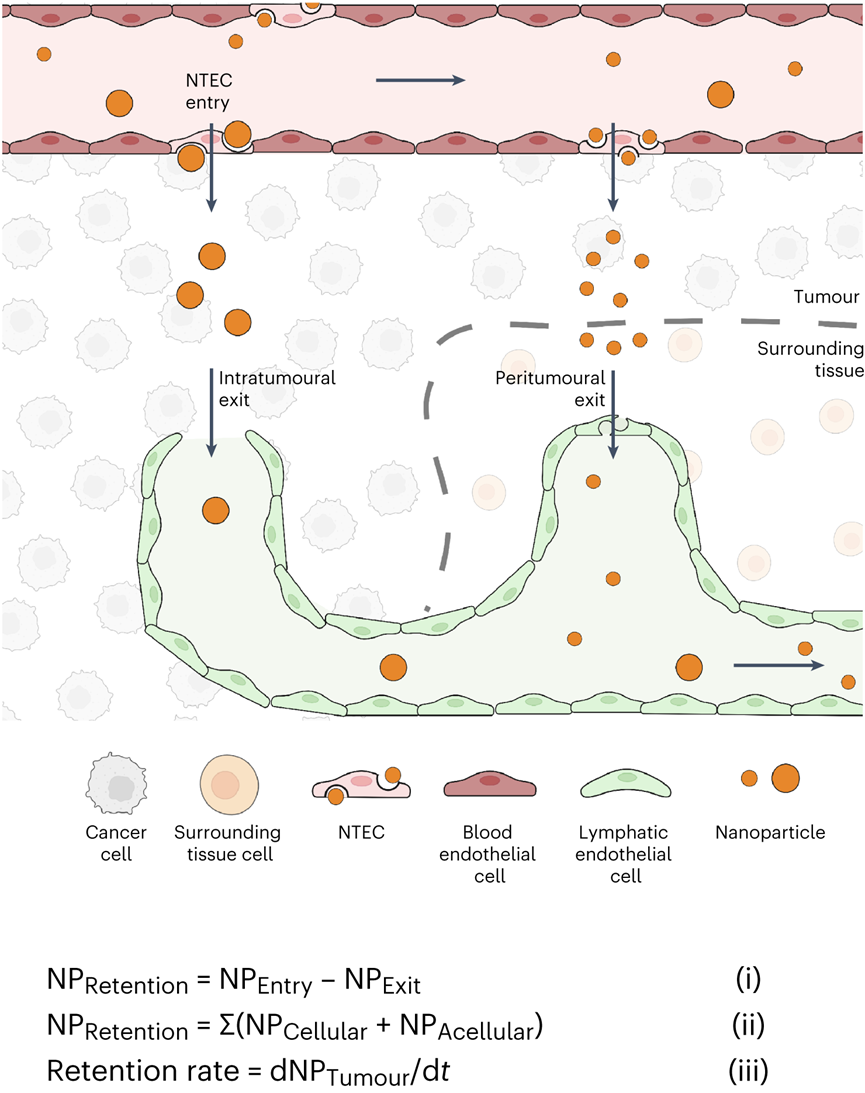
设计纳米颗粒递送系统以将制剂运送到实体肿瘤需要对纳米颗粒进入和排出过程的深入理解。目前解释这些过程的教条是EPR效应。它指出纳米颗粒通过内皮间隙进入实体肿瘤,并留在肿瘤内。这些研究显示了通过光学显微镜显示淋巴管塌陷的组织学图像,并表明蛋白质和大分子在功能测定中与这些血管不共定位。EPR机制促使研究人员专注于具有长循环,多种特性和功能的工程颗粒,并且尺寸足够小,可以通过间隙扩散以被动进入肿瘤。但是学界开始质疑这一原理,因为纳米颗粒在癌症应用中的临床应用很差。如果这种机制是正确的,为什么这么多纳米颗粒在临床试验中失败?加拿大多伦多大学化学系与生物工程研究所的Warren C W Chan教授一直对EPR效应存疑,EPR效应就一定是正确的吗?Warren C W Chan教授在继2020年于Nature Materials上阐述了纳米粒子进入实体瘤的新机制之后,完成对教条的挑战之后。近日又再次在Nature Materials上发表了纳米粒子离开实体瘤的相关机制。作者团队展示了纳米粒子通过肿瘤内部或周围的淋巴管离开肿瘤,主要的淋巴排出机制取决于纳米颗粒的大小。通过淋巴管离开肿瘤的纳米颗粒返回血液系统,并通过再循环与肿瘤作用。这确定了纳米颗粒递送到实体瘤的机制,作者团队称之为主动传输和保留原则。这种递送原则为设计用于癌症治疗和检测的纳米药物提供了新的框架。针对纳米颗粒是否通过肿瘤内淋巴管离开肿瘤,目前的理论指出这些淋巴管塌陷,这意味着管腔太小,纳米颗粒无法通过。可能是因为光学显微镜成像时,大多数肿瘤淋巴管的大小接近或低于衍射极限,导致看上去“塌陷”。TEM成像的所有肿瘤淋巴管的管腔尺寸大于286nm,肿瘤淋巴管足够大,可以进行纳米颗粒运输。首先确定纳米颗粒是否向淋巴管移动并运输到淋巴管中。将 15 nm 金纳米颗粒静脉注射到肿瘤小鼠中。120 h后,纳米颗粒与肿瘤内淋巴管分离的距离减少了 50.1μm,淋巴管壁的纳米颗粒强度从0.33 a.u.增加到0.58 a.u.。纳米粒子在所有时间点都在管腔内。这些结果表明,纳米颗粒向肿瘤内淋巴管移动,到达淋巴管壁并在腔内发现。组织学能够量化更多的肿瘤淋巴管群,TEM能够可视化单个纳米颗粒。将15nm纳米颗粒直接施用于肿瘤中,并在1小时后制备用于组织学或TEM的肿瘤切片。在组织学切片中80.7%的纳米颗粒(白色)定位于肿瘤内淋巴管(红黄色)。虽然在肿瘤淋巴管内也观察到100nm纳米颗粒存在,但频率比15nm纳米颗粒低了21倍。检查不同纳米颗粒尺寸和材料类型的通过不同的注射方案在不同肿瘤模型中肿瘤内淋巴转移。53%的50 nm金纳米颗粒,61%的100 nm金纳米颗粒,67%的100 nm二氧化硅纳米颗粒和47%的100 nm脂质体定位于肿瘤内淋巴管。数据共同表明,纳米颗粒均会通过肿瘤内淋巴管离开肿瘤。研究纳米颗粒是否通过肿瘤周围淋巴管离开肿瘤。这个过程需要纳米颗粒从肿瘤边缘运输出来,积聚在周围组织中,并通过肿瘤周围淋巴管排出。使用上文相似的方案,120h后,纳米颗粒到淋巴管的距离减少了51.8μm,管壁处的平均纳米颗粒强度从0.21 a.u.增加到0.62 a.u.。在1h和24h在肿瘤周围淋巴管内观察到低纳米颗粒信号,120 h观察到大纳米颗粒簇。肿瘤周围淋巴管的组织学显示,74%的纳米颗粒(白色)位于肿瘤周围淋巴管。TEM成像显示单个纳米颗粒通过相互连接的囊泡和液泡簇穿过肿瘤周围淋巴管壁。ICP-MS和组织学证实,这些由肿瘤周围淋巴管排出的纳米颗粒被运出肿瘤。测试不同纳米颗粒尺寸和材料类型的通过不同的注射方案在不同肿瘤模型中肿瘤周围淋巴转移。50 nm金纳米颗粒、100 nm金纳米颗粒、100 nm二氧化硅纳米颗粒和100 nm脂质体分别存在40.0%、36.6%、20.0%和30.0%定位于肿瘤周围淋巴管。这些结果表明,不同肿瘤模型和不同注射方案的不同大小和组成的纳米颗粒均会通过肿瘤周围淋巴管排出肿瘤。研究纳米颗粒是否通过血管离开肿瘤,假设这种退出机制同时通过间隙和运输囊泡。将 15 nm 纳米颗粒直接注射到肿瘤中,1h时大多数纳米颗粒留在肿瘤内,而只有0.026%在血液循环内。鉴于血液循环中纳米颗粒的数量,计算出纳米颗粒通过间隙和囊泡从肿瘤中运输出并进入血管的准确率大于97%。TEM结果在内皮细胞间隙和囊泡中发现了3nm纳米颗粒,证实了纳米颗粒通过血管离开肿瘤。但通过淋巴管排出相比,这些过程很少见。间隙和囊泡通过血管运输的纳米颗粒密度分别仅为每毫米7.2和10.4个纳米颗粒,而肿瘤内和周围淋巴管每毫米分别运输43.5和2123.3个纳米颗粒。对不同的纳米材料重复这种定量。向B16F10肿瘤施用100nm金和二氧化硅纳米颗粒,在间隙或囊泡内都没有观察到这些纳米颗粒。对MMTV-PyVT肿瘤模型重复了这种定量,同样,纳米颗粒很少通过间隙和囊泡运输。TEM证实纳米颗粒通过间隙和囊泡运输过程通过血管离开肿瘤,但与淋巴管排除机制相比,这些过程很少被观察到。接下来作者团队确定主要的排出机制。使用淋巴管造影确定了肿瘤引流淋巴系统,并进行血管结扎以防止纳米颗粒从淋巴系统转移到血液循环中。将30 nm、50 nm和100 nm金纳米颗粒注射到肿瘤中。由于肿瘤引流淋巴系统被结扎,通过淋巴管离开肿瘤的纳米颗粒保留在周围组织和肿瘤引流淋巴系统中。通过血管离开肿瘤的纳米颗粒位于血液和主要单核吞噬细胞系统(MPS)器官(肝脏和脾脏)内。结果显示43.6%的15nm纳米颗粒通过淋巴管离开肿瘤,但只有9.6%通过血管离开肿瘤,表明淋巴管机制比血管机制高出4.6倍。对于30 nm,50 nm和100 nm纳米颗粒,淋巴管机制分别超过血管机制8.1,12.3和41.0倍。预计血液排出量会随着纳米颗粒的增大而减少。纳米颗粒主要通过淋巴管而不是血管离开肿瘤,因为与瘤内压力相比,淋巴管的内压较低,并且具有纳米颗粒运输的超微结构特征,这在数学建模与其他肿瘤模型中也得到了验证。进一步确认两种淋巴出口机制中的哪一种占主导地位。首先通过血管内皮生长因子受体-3抑制剂MAZ51抑制肿瘤内淋巴管抑制肿瘤内淋巴管排出纳米颗粒,同时保持肿瘤周围淋巴管不变来区分它们的贡献。对于15nm纳米颗粒,24h后分别有40.6%和10.6%纳米颗粒驻留在MAZ51处理和对照的肿瘤内。15nm纳米颗粒的肿瘤内与肿瘤周围淋巴管排出的比率计算值为0.6。对30 nm,50 nm和100 nm纳米颗粒重复实验。30nm纳米颗粒的比率在1附近,但50 nm和100 nm纳米颗粒通过肿瘤内排出的比例高于肿瘤周围淋巴管(分别高2.03和2.86倍)。这些趋势同样适用于静脉内给药的纳米颗粒。这一证据表明,主要的排出机制取决于纳米颗粒尺寸。较小的(15 nm)纳米颗粒主要分别通过肿瘤周围淋巴管离开肿瘤,而较大的(50 nm和100 nm)纳米颗粒主要分别通过肿瘤内淋巴管离开肿瘤。中等尺寸(30nm)纳米颗粒以相近的比例通过肿瘤内和肿瘤周围淋巴管离开肿瘤。探索通过淋巴机制离开肿瘤的纳米颗粒是否通过胸导管进入血液循环。Cy5偶联的15nm金纳米颗粒注射到肿瘤中,并对引流肿瘤的淋巴系统进行荧光成像。在引流肿瘤的淋巴系统系统中观察到纳米颗粒(白色),包括腹股沟和腋窝淋巴结,以及连接这些组织与肿瘤的淋巴管。纳米颗粒位于淋巴管内传出至腋窝淋巴结、锁骨下静脉和通向心脏的上腔静脉。活体成像进一步证实了纳米颗粒通过该系统的转运。ICP-MS证实,15nm金纳米颗粒从淋巴系统转移回血液循环。 在引流肿瘤的淋巴系统、血液循环和连接这两个系统的部位也发现了100 nm的纳米二氧化硅纳米颗粒和脂质体。这一证据表明,纳米颗粒在离开肿瘤后通过淋巴机制被转移回血液循环。这些纳米颗粒有可能在全身再循环,并在另一次通过中与肿瘤相互作用。作者团队的研究结果提出一种纳米颗粒递送到实体瘤的机制,以替代EPR效应。EPR机制促使研究人员专注于具有长循环,多种特性和功能的工程颗粒,并且尺寸足够小,可以通过间隙扩散以被动进入肿瘤。但是学界开始质疑这一原理,因为纳米颗粒在癌症应用中的临床应用很差。如果这种机制是正确的,为什么这么多纳米颗粒在临床试验中失败?作者团队认为EPR机制可能不正确,在十年间研究了特定的纳米颗粒进入和排出途径,以及这些途径如何决定纳米颗粒的运输。这些研究是系统地进行的,能够将研究结果拼凑成一个具体的中心概念。2020年,作者团队证明了主导进入机制是通过一个主动运输过程。在这里,作者团队专注于纳米颗粒退出机制。作者先后的实验结果阐述了,纳米颗粒通过主动运输过程进入肿瘤,包括跨内皮,囊泡-液泡细胞器和EPR效应。纳米颗粒通过基于细胞的肿瘤环境在肿瘤环境中运输或流体动力学机制,在肿瘤中与各种成分相互作用。然后,纳米颗粒通过肿瘤内或肿瘤周围淋巴管离开肿瘤,具体取决于它们的大小。通过淋巴机制离开肿瘤的纳米颗粒通过淋巴系统输送,最终会重新进入血液循环,从而再次将它们输送到肿瘤。纳米颗粒保留是由从进入到出口的运输延迟引起的肿瘤中纳米颗粒的量。这种延迟是运输机制(例如,扩散,对流,基于细胞)以及纳米颗粒与肿瘤细胞和无细胞成分相互作用的结果。这些相互作用可能会永久地将纳米颗粒困在肿瘤内。由于生物成分的差异,这些相互作用在肿瘤模型之间可能有所不同,导致不同的纳米颗粒保留量。将这些传输过程的收集称为主动传输和保留(ATR)原则。作者团队概述了四个研究领域:(1)确定通过内皮细胞的纳米颗粒转运机制。(2)通过纳米颗粒与肿瘤微环境成分的相互作用,评估纳米颗粒设计在影响肿瘤保留中的作用。(3)探查肿瘤中淋巴管与健康组织之间的功能和生理差异(例如,通透性变化,液体转移能力等)。(4)研究功能性淋巴管对肿瘤内纳米颗粒转运的影响。这些基础研究将定义ATR原理的设计规则和数学方程。最终,这一原则应该改变设计肿瘤递送颗粒和材料的策略。它应该引导研究人员通过纳米颗粒和生物系统之间的分子相互作用来控制纳米颗粒的运输和保留,以增加递送,希望这将改善纳米药物对人类患者的临床转化。(本文阅读)Luan N M Nguyen, Zachary P Lin, Shrey Sindhwani, et al. The exit of nanoparticles from solid tumours. Nat Mater. 2023 Aug 17.https://www.nature.com/articles/s41563-023-01630-0(推荐阅读)Shrey Sindhwani, Abdullah Muhammad Syed, Jessica Ngai, et al. The entry of nanoparticles into solid tumours. Nat Mater. 2020 May;19(5):566-575.https://www.nature.com/articles/s41563-019-0566-2