“手性(chirality)”是微观小分子和宏观物质的一种基本属性,就像人们的左右手,互为镜像异构体,但是左手与右手无法相互重叠。手性催化剂(具有共同结构特征并在一系列反应中具有对映选择性的催化剂)大大改变了化学研究的格局。利用光作为外部刺激来克服基态反应性边界是当代催化学的核心研究方向。
近年来,人们通过光激活的激发态催化获得了新的反应模式,但基态优势催化剂的选择性是否能与之匹配尚不清楚。尽管基态循环对光生中间体的截留部分解决了这一挑战,但同时调节反应活性和选择性的单一手性光催化剂却很少。到目前为止,精确的供体-受体识别基序仍然是对映选择性光催化剂设计的关键。
在此,来自德国明斯特大学Johannes Neugebauer和Ryan Gilmour团队展示了具有明确光物理性质的Al-salen配合物,可用于环丙基酮的高效光化学去甲基化。在λ=400 nm(紫光)下照射可提高商用催化剂的反应活性,从而同时调节反应活性和对映体选择性。这就避免了定制催化剂-底物识别图案的需要。据预测,这项研究将促使人们重新评估激发态过程中许多古老的(基态)手性催化剂,最终确定在两种反应模型中均可被视为最佳的候选催化剂。

技术优势:
本工作推进了Al-salen框架作为手性光催化剂的发展,它允许利用酮官能团作为识别元素,从而向合成有用的去甲基化迈出了重要的一步。其次,这项研究提供了一种新的去甲基化反应框架(C-C键断裂),即通过断裂/重组C-C键而不C-H键或C=C键来实现去甲基化。这原则上为完全取代的立体中心的去甲基化打开了大门。最后,也是最重要的一点,Al-salen配合物作为手性光催化剂的鉴定是一个潜在的突破,因为它们具有合成的可及性,并且在整个反应平台上的立体诱导得到了验证--这也是本文的催化优势所在。
环丙烷的脱乙酰化验证salen光催化的概念
利用光作为外部刺激来克服基态反应性边界虽然成功突出了光催化在形成新键方面的有效性,但活化的非共价性质,加上生成的中间体的高反应性,使对映体控制成为一个明显的挑战。但是,当存在互补(H键)识别基序时,在单一手性光催化剂的支持下,可以实现显著水平的对映诱导。将这个模型扩展到包括具有常见官能团的基板,以进行识别是非常有吸引力的,并最终导致更普遍的手性光催化剂的识别。不过,本文的目的是确定基态识别模式,可以在激发态模型中复制。这使得作者在创造一个新兴手性蓝图中的Lewis酸-Lewis碱组分时,探索了富含地球的铝的强亲氧性。并且手性Al-Salen配合物可以通过电子转移到羰基而有效地用于环丙基酮的去甲基化,这将通过底物配位和随后的配体生色团激发以及在手性环境中的电子转移来实现。
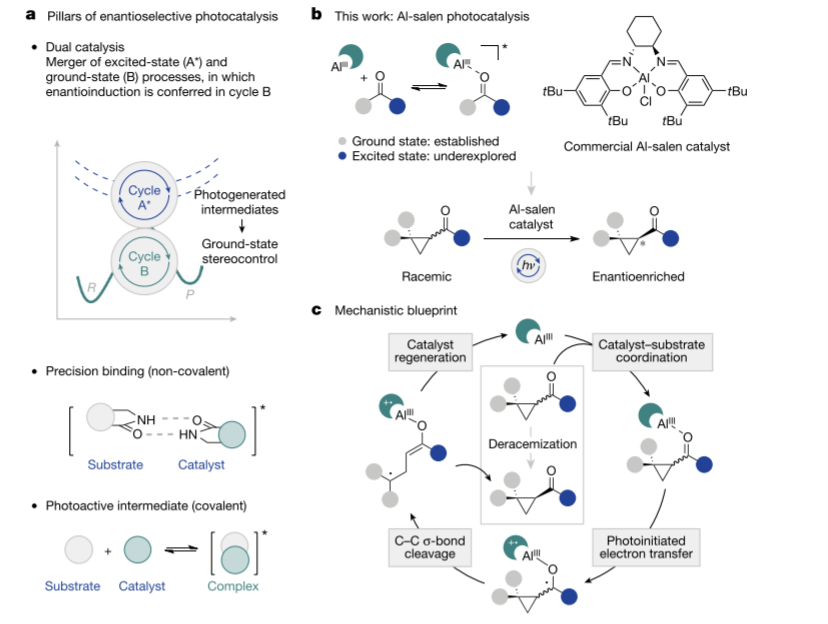
图 对映选择性光催化
验证手性光催化剂对映诱导的假设
作者使用丙酮中的商用Al-Salen配合物Al-1,在-70 ℃下催化环丙烷rac-1脱烷基。根据光催化剂和底物的吸收光谱,在400 nm波长下照射反应混合物,实现了催化剂的选择性激发。4.5小时后,分离出对映体富集产物(+)-1,收获率率为78%。并且,作者还进行了反应优化过程,首先加入一种可溶性盐以稳定电荷分离的中间产物。n-Bu4NCl的加入提高了产率(80%)和对映选择性。通过反应监测观察到rac-1的快速去甲基化,耗竭量为(-)-1,并在100分钟后完成。研究了温度对映体选择性的影响,揭示了一个经典的温度依赖关系。
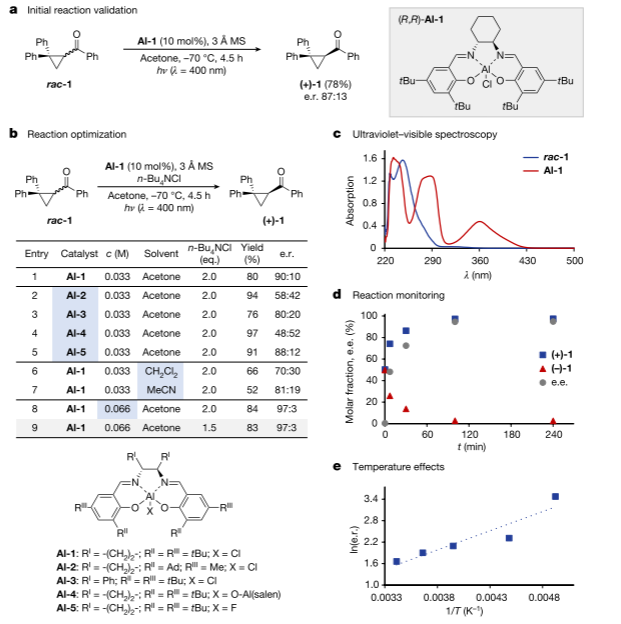
图 利用Al-salen光催化技术使环丙基酮脱烷基化
环丙基酮的脱烷基的局限性
在确定了优化条件后,对该方法的范围和局限性进行了研究。对位取代底物具有较高的收率和对映体选择性,对映体富集1的单晶X射线分析使绝对构型归属为(S)。为了摆脱geminal-substitution,本研究还在该salen光催化平台的框架内探索了非对称取代的环丙烷。作者猜测,通过正式的动力学解析过程,可以获得由对映体非对映异构体混合物组成的光致变性成分。
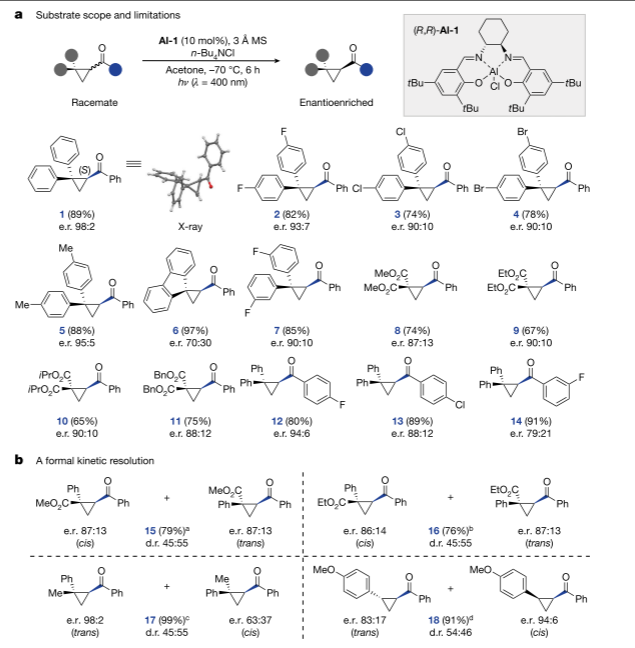
图研究环丙基酮的脱烷基范围
揭示Al-salen光催化的脱钙作用的机理
为了揭示Al-salen光催化的脱钙作用的机理,并为前面工作假设提供支持,作者将紫外可见光谱数据、反应进程监测和温度数据与实验观察结果进行了对比。结果发现,在没有Al-salen或光的情况下,脱钙化反应被完全抑制,这使得环丙烷rac-1得以定量回收。此外,漏掉分子筛会降低反应效率,突出了水对反应过程的不利影响。所以作者又研究了电荷转移过程的可行性。此外,为了进一步研究脱甲基化机理,作者还进行了scalemic 19和20的对照反应,并证实没有发生可检测到的背景外消旋化。
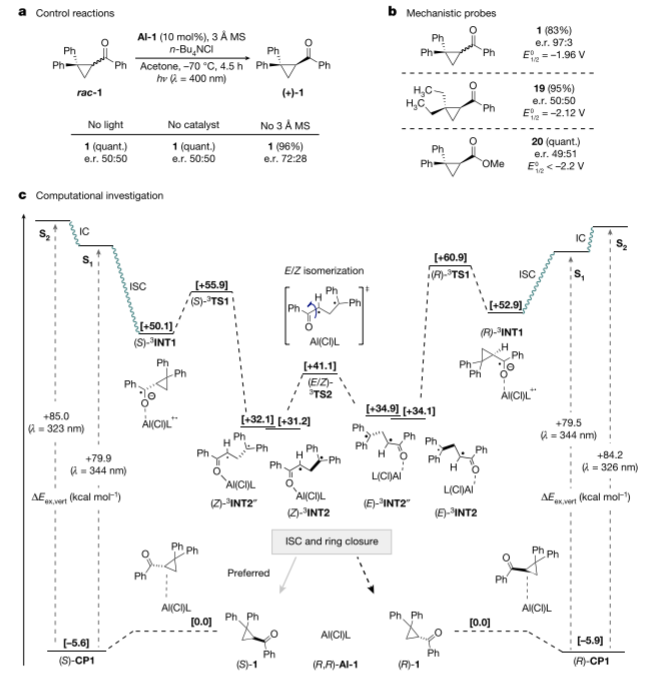
图机理研究
验证获得光学富集、官能度高的环丙烷衍生物的合成实用性
为了证明上述方法在获得光学富集、官能度高的环丙烷衍生物方面的合成实用性,作者进一步修饰了(+)-1和(+)-8/(+) -10的gem-diaryl和gem-diester衍生物。苯酮发色团在操作上的简单裂解被认为是有利的。因此,通过Beckmann重排或Baeyer-Villiger氧化直接转化为酰胺或酯的方法得到了验证。Johnson-Corey-Chaykovsky 环氧化和还原(+) -1生成(+)-22和(+)-23的过程完全是非对映选择性的,还原/环化过程也是如此,可获得融合的内酯衍生物(+)-25。(+)-8的广泛还原也很有效,并使三元醇(+)-26的制备在不影响光学纯度的情况下进行。
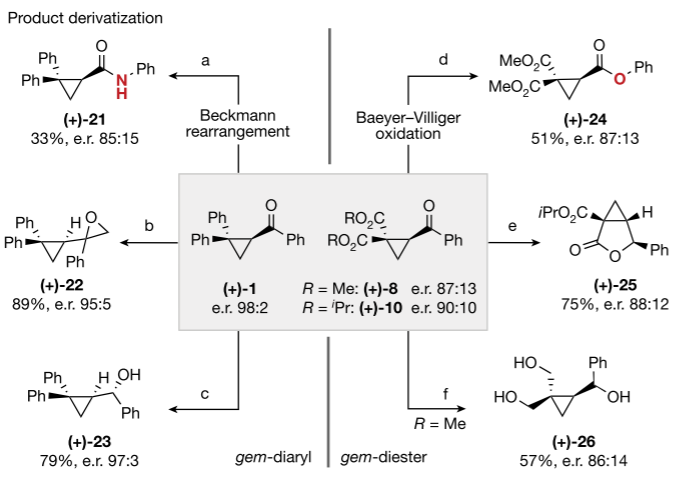
图Al-Salen光催化去乙酰化对映体富集环丙基酮的功能化研究
来自德国明斯特大学Johannes Neugebauer和Ryan Gilmour等人的工作描述了使用双功能Al-Salen催化剂在可见光介导的环丙烷脱甲基化反应。作者提出了一种概念新颖的不对称光催化方法,该方法将Al的Lewis酸性质所提供的酮的LUMO降低激活与环丙基酮的可逆均裂作用以及配体提供的不对称诱导结合起来。这种流形不同于手性H键给体-受体能量转移和基态手性LA激活过程。总之,Salen催化剂可以用来控制激发态对映体选择性的发现是非常有价值的,所描述的转化过程也是非常有趣。
参考文献:
Carina Onneken, Tobias Morack, Julia Soika1, Olga Sokolova1, Niklas Niemeyer, Christian Mück-Lichtenfeld, Constantin G. Daniliuc, Johannes Neugebauer*, Ryan Gilmour*. Light-enabled deracemization of cyclopropanes by Al-salen photocatalysis. Nature, (2023). https://doi.org/10.1038/s41586-023-06407-8.











