
特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。
不清晰之机制
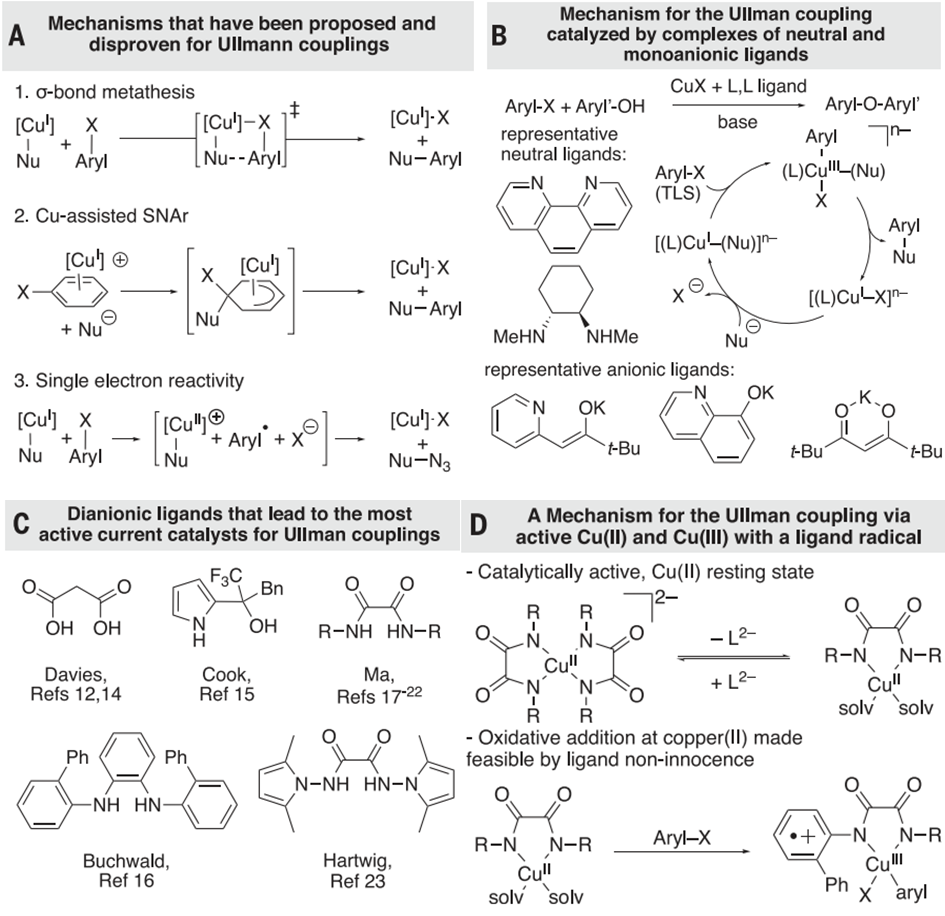
芳基卤化物亲电体和杂原子亲核体之间的金属催化交叉偶联反应是有机合成领域(包括药物合成、材料化学和天然产物合成等)中一种重要的方法,这种反应利用金属催化剂的作用,使芳基卤化物亲电体和杂原子亲核体之间发生反应,通过此反应,可以构建复杂的有机分子结构,扩展有机合成的化学空间。此外,金属催化交叉偶联反应还具有高效、高选择性和环境友好的特点,成为现代有机合成中不可或缺的工具。目前常用的金属催化剂通常是过渡金属,如钯、铜等,能够促进反应的进行,提高反应的效率和选择性。但与钯催化的偶联相比,由于铜配合物的顺磁性,导致在光谱上识别,因此铜催化偶联的机制知之甚少。目前,已知的反应机制包括σ键复分解,芳烃π配位激活碳-卤素键,或电子转移形成芳基自由基、Cu(I)配合物与中性或阴离子结合的机制等(图1)。但没有关于催化剂高活性的机制解释的报道。
大佬之思路
基于此,美国加州大学伯克利分校John F. Hartwig教授团队发现草酰胺配体的配合物催化芳基卤化物与酚和其他可能的亲核试剂的交叉偶联的新机制(图1D),其机制不同于乌尔曼型偶联反应中Cu(I)和Cu(III)中间体的机理。该机制经历了一个协调的,决定速率的铜插入芳基卤化物的碳-卤素键的过程。Cu(II)草酰胺配体催化乌尔曼偶联,通过芳基卤化物与Cu(II)的协同氧化加成,形成高价物质,该物质通过草酰胺配体上的自由基特性而稳定,从而形成芳基醚中的C-O键。最终Cu(II)草酰胺配合物在空气条件下催化偶联,并催化了周转量超过1000的氧化苯酚与芳基氯亲电体的偶联反应。相关结果以《Cross-coupling by a noncanonical mechanism involving the addition of aryl halide to Cu(II)》为题发表在Science上。以芳基溴和酚之间形成联芳醚的反应为模型反应进行机理研究。由碘化铜(I)和双-(2-苯基苯基)草酰胺催化1-溴-4-氟苯与苯氧化钾的偶联反应生成4-氟联苯醚,产率为98%(图2A)。对单阴离子配体的研究表明,酚类化合物的偶联是通过将芳基卤化物氧化加成到Cu(I)苯氧化合物络合物上而发生的,因此研究首先尝试生成一种由单或双阴离子形式的草酰胺配体结合的Cu(I)苯氧化合物络合物,并测试其与芳基卤化物的反应性。在室温条件下,1-溴-4-氟苯(1)与5和苯氧化钾的混合物生成少量芳醚(图2B)。而100°C处理样品后,虽然溶液中不存在Cu(I)苯氧化物络合物,但也会形成产率为75%的联芳烃醚3和产率为18%的氟苯,说明这些Cu(I)物种不是催化过程中的中间体。
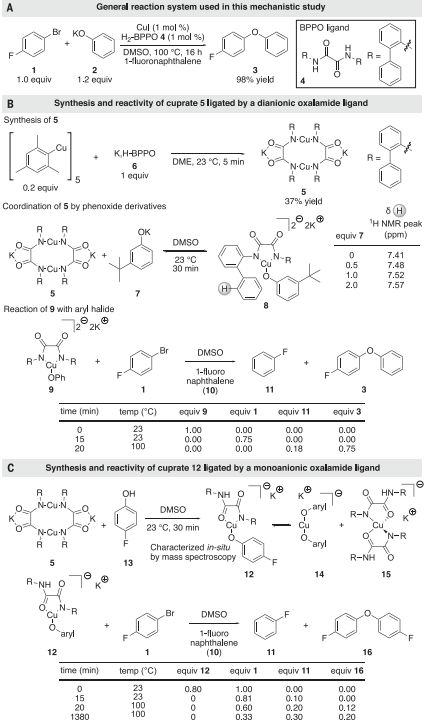
图 2:草酰胺配体Cu(I)配合物的合成及其反应性Cu(II)配合物的鉴定和反应,评价其在催化反应中的中间作用使用EPR光谱探测催化反应中的Cu(II)配合物(图3A)。在DMSO中100°C加热处理20分钟后,芳烃卤化物1、苯氧化合物2、碘化铜和草酰胺4产生的冷冻反应混合物的EPR信号对应于一种4个氮原子结合的铜(II)二草酰胺配合物(图3B)。Cu(II)配合物可以引发由Cu(I)/Cu(III)偶对催化的反应,因此进一步评估了Cu(II)配合物是真正的催化剂还是还原为Cu(I)的预催化剂(图4A)。如果配合物17是预催化剂,并且比偶联反应更快地转化为活性催化剂,则在催化剂活化步骤中会消耗等摩尔量的铜试剂,导致联芳醚的产率较低,会观察到一个诱导期。结果发现联芳醚的产率接近99%,与17的中间作用或由17可逆形成机制一致。动力学研究(图4B)表明4-氯苯氧化钾的反应为零级,反应的发生与催化剂浓度呈线性关系,尽管有明显的非零截距。CV表明17被氧化为Cu(III)种和相应的17被还原为Cu(I)种都是可逆的,并且相隔1.81 V。这一分离结果表明,17的两个等价物歧化成Cu(I)和Cu(III)的速率大于41 kcal/mol,这为Cu(II)歧化产生活性催化剂提供了有力的证据。
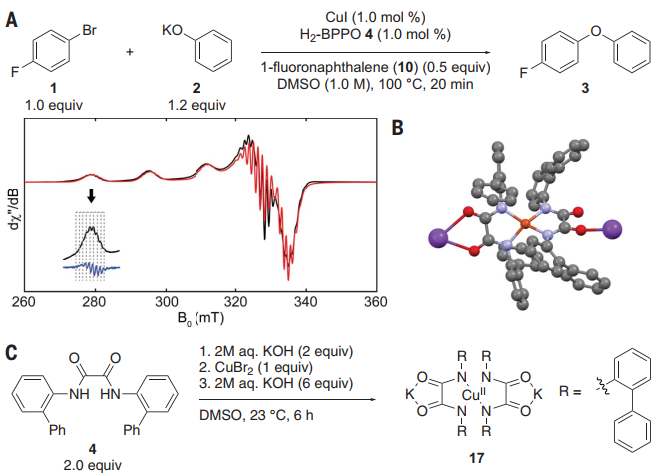
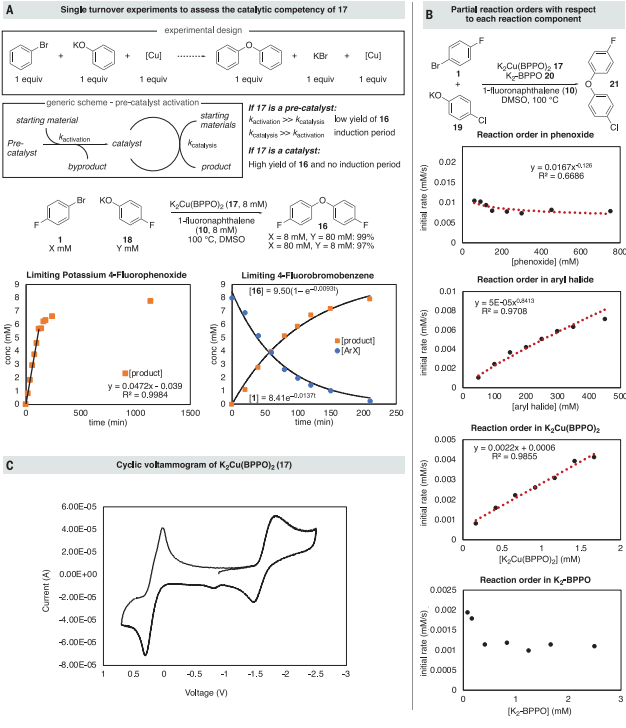
图 4:机理实验确定的静态,周转限制步骤,和预平衡图5A显示了Ullmann耦合的四种机制。为了区分这些机制,进行了一系列进一步的实验。(i)只有当苯氧化合物在静止状态下与铜结合,并通过限制周转的步骤保持结合时,σ键复分解机制才与该研究的动力学数据一致。当铜与芳基卤化物反应时,没有检测到苯氧化合物的性质对反应速率的影响(图5B),证实了苯氧化合物衍生物与Cu(II)配合物17没有结合。(ii)进一步测量了13C KIE(图5C)以确定在Cu(II)和芳基卤化物之间的限速反应中是否发生了芳烃配位或C-X键的断裂,13C KIE值与芳基碘化物氧化添加到Cu(I)配合物的KIE值相当,排除了芳基卤化物在亲核芳香族取代之前的不可逆结合。(iii)通过铜(II)配合物催化苯氧化合物与芳基卤化物的偶联来评估电子转移机制(图5D)。排除了电子转移机制。最终,研究发现所有的数据都与第四种机制一致,即芳基卤化物与草酰胺配体的Cu(II)配合物的协调,决定速率的反应,以切割碳-卤素键。
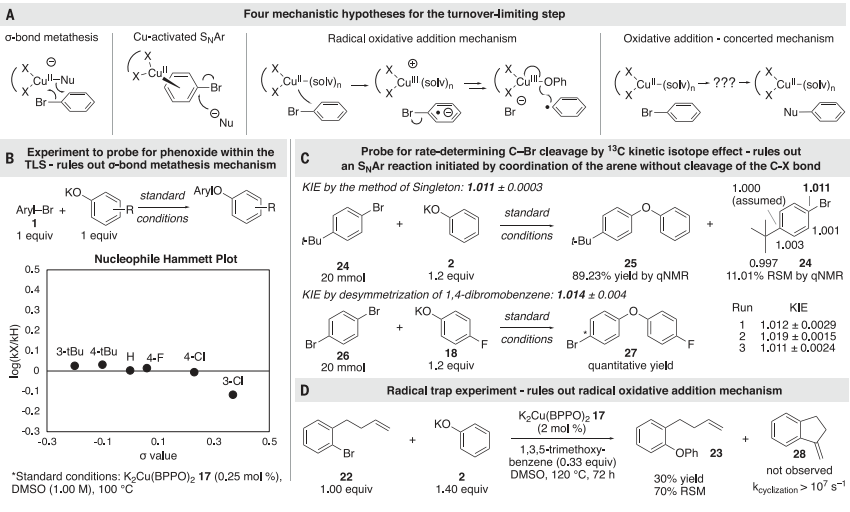
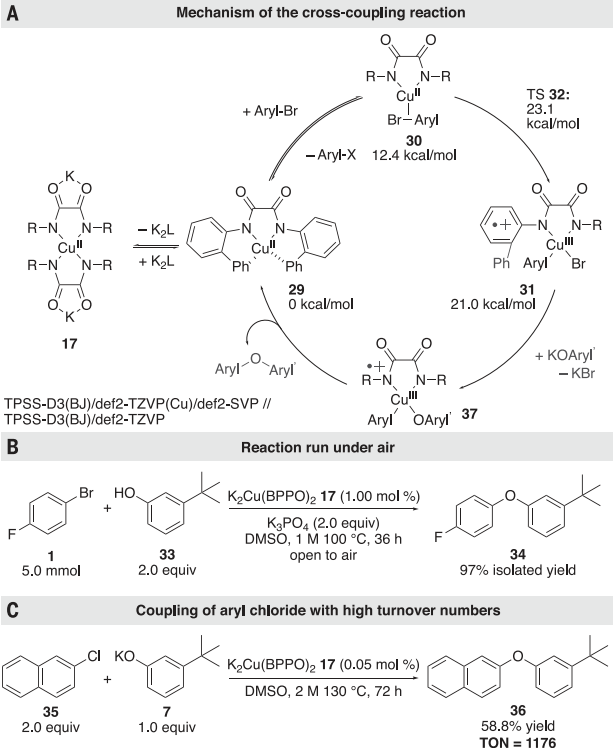
图 5:机制研究以探讨静息状态和失误限制步骤的性质进一步,研究通过DFT计算评估了Cu(II)与芳基卤化物反应裂解碳-卤素键的机理。研究了通过协同氧化加成的步骤将Cu中间体插入到芳基卤化物的碳-卤素键中的可行性。图6A显示的计算的反应能量与实验结论一致,即Cu(II)在速率决定步骤中切割碳-卤素键,并表明这种键的切割可能通过氧化加成发生。
应用及展望
最后实验探究了Cu(II)的静态对空气和歧化反应稳定以探索其适应应用潜力。在130℃仅含百万分之500的纯17作为催化剂条件下,2-氯萘与3-叔丁基苯氧化钾偶联反应对应的,联芳醚36的收率为59%,得到>1000次周转,表明其稳定性及高活性,展现出应用潜力,为下一代铜或其他金属催化剂配体的发展提供了参考。https://www.science.org/doi/10.1126/science.adi9226Connor P. Delaney et al. Cross-coupling by a noncanonical mechanisminvolving the addition of aryl halide to Cu(II).Science (2023).DOI:10.1126/science.adi9226














