建立针对癌症衍生表位的免疫反应已成为癌症免疫治疗的支柱。释放 T 细胞免疫来引发抗肿瘤免疫反应,在抗癌方面取得了重要的临床进展,包括检查点抑制剂、癌症疫苗和嵌合抗原受体 T 细胞 (CAR-T) 疗法。结直肠癌(CRC)免疫治疗未能取得疗效的原因包括突变负荷低(导致缺乏突变衍生的新抗原)和肿瘤的免疫抑制环境。突变负荷低的肿瘤对个性化新抗原疫苗提出了更大的挑战,例如微卫星稳定 (MSS) CRC 肿瘤患者。MSS CRC通常对免疫检查点封锁具有抵抗力,因此需要创新的免疫调节策略。最近的研究表明,肿瘤内细菌存在于肿瘤微环境中的癌症和免疫细胞的细胞内,这可能为癌症免疫治疗提供新表位的替代来源。因此,可以假设杀死肿瘤中的细胞内细菌将暴露微生物表位并产生癌症相关新抗原的替代来源。
临床前研究表明,细菌引发的 T 细胞免疫与癌细胞的主要组织相容性复合物 I 类 (MHC-I) 限制性抗原发生交叉反应,这表明微生物特异性 T 细胞有助于抗肿瘤免疫反应。共生拟杆菌属肽模拟物依赖心肌肌球蛋白特异性 TH17 细胞驱动自发性自身免疫性心肌炎的进展。微生物群引发微生物特异性T细胞反应,推测这些反应是为了逃避自我耐受机制。可以假设细菌和宿主共享的同源表位有助于抗肿瘤免疫。
纳米技术是将小分子细胞内递送至肿瘤部位的有前途的工具。载药纳米颗粒可以特异性消除肿瘤细胞内细菌的定植。
成果简介
鉴于此,北卡罗来纳大学黄力夫(Leaf Huang)等人测试了一种策略,通过远程加载技术将载有银替硝唑复合物(LipoAgTNZ)的脂质体递送至细菌感染的小鼠原位结直肠癌肿瘤中。在此表明,通过脂质体递送针对厌氧细菌的抗生素来消除结直肠癌肿瘤中的细菌,从而释放出抗肿瘤 CD8 T 细胞。

针对厌氧菌的抗生素可改善癌症存活率
首先,作者探讨了针对癌症相关菌株的特定抗生素(如硝基咪唑和林可霉素)对结直肠癌患者的预后影响。研究采用了对全国范围内的结直肠癌患者进行药物流行病学数据库的调查,发现在手术切除肿瘤前后6个月内使用这类抗生素的患者,相比于未接受抗生素或接受其他类抗生素的患者,其疾病无复发存活率(DFS)较高。研究还发现,这种保护作用主要出现在术前使用这类抗生素的患者中,术后使用则没有类似效果。进一步的研究也表明,这种保护作用在乳腺癌患者中并未观察到,暗示了这种特定抗生素对结直肠癌及其微生物群落具有特异性作用。总的来说,这些研究结果暗示了特定类别的抗生素可能具有降低结直肠癌复发风险的潜力,其效果可能与化疗相当,后者通常能在术后结合辅助治疗时降低复发风险。尽管在数据库中患者的微生物群落状况并不清楚,但针对厌氧菌的特定类别抗生素在临床上的鼓舞人心的结果促使了建立一个明确定义的、受细菌感染的小鼠模型以进行详细研究。
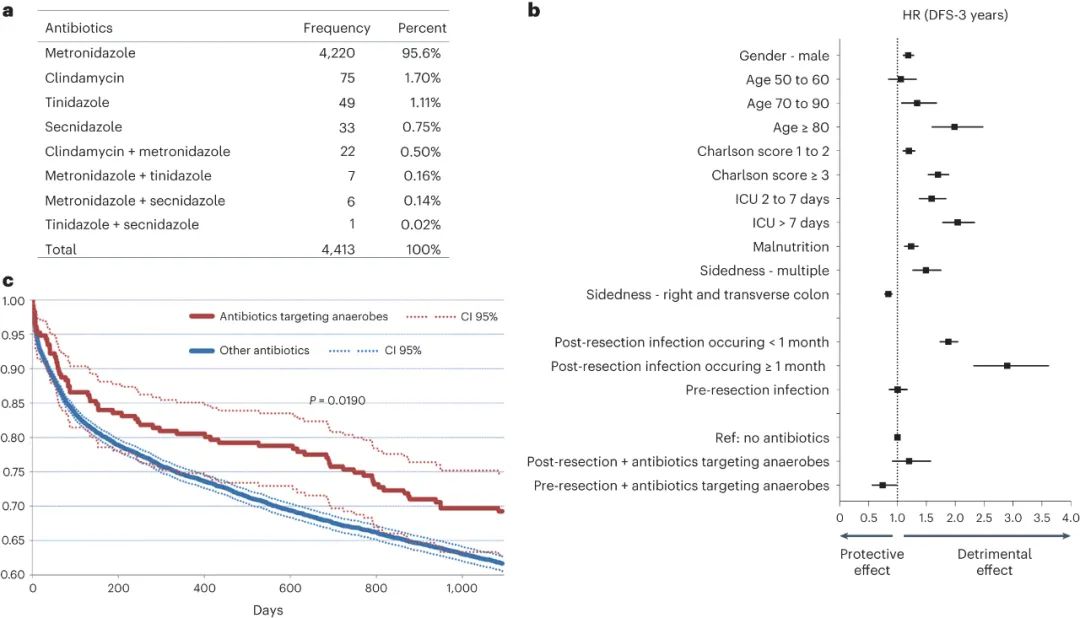
图|针对厌氧菌的抗生素对CRC患者具有保护作用
细菌响应低氧水平侵入肿瘤细胞
研究发现结直肠癌及其转移中普遍存在具核梭杆菌菌株。实验证实了具核梭杆菌能在低氧环境下侵入肿瘤细胞。在小鼠实验中,具核梭杆菌感染导致肿瘤生长显著增加,并促使肿瘤转移。肿瘤组织、转移瘤及粪便中均发现了具核梭杆菌存在。此外,具核梭杆菌感染引起了肿瘤微环境中抗炎巨噬细胞和抑制性免疫细胞的显著增加,而免疫细胞(如CD8+ T细胞)的数量显著减少。电镜和荧光实验证实了具核梭杆菌在肿瘤内部存在。研究还表明另一种细菌Escherichia coli Nissle也会在低氧环境中侵入肿瘤细胞。这些研究结果揭示了微生物与肿瘤微环境的相互作用,对于了解肿瘤发展具有重要意义。
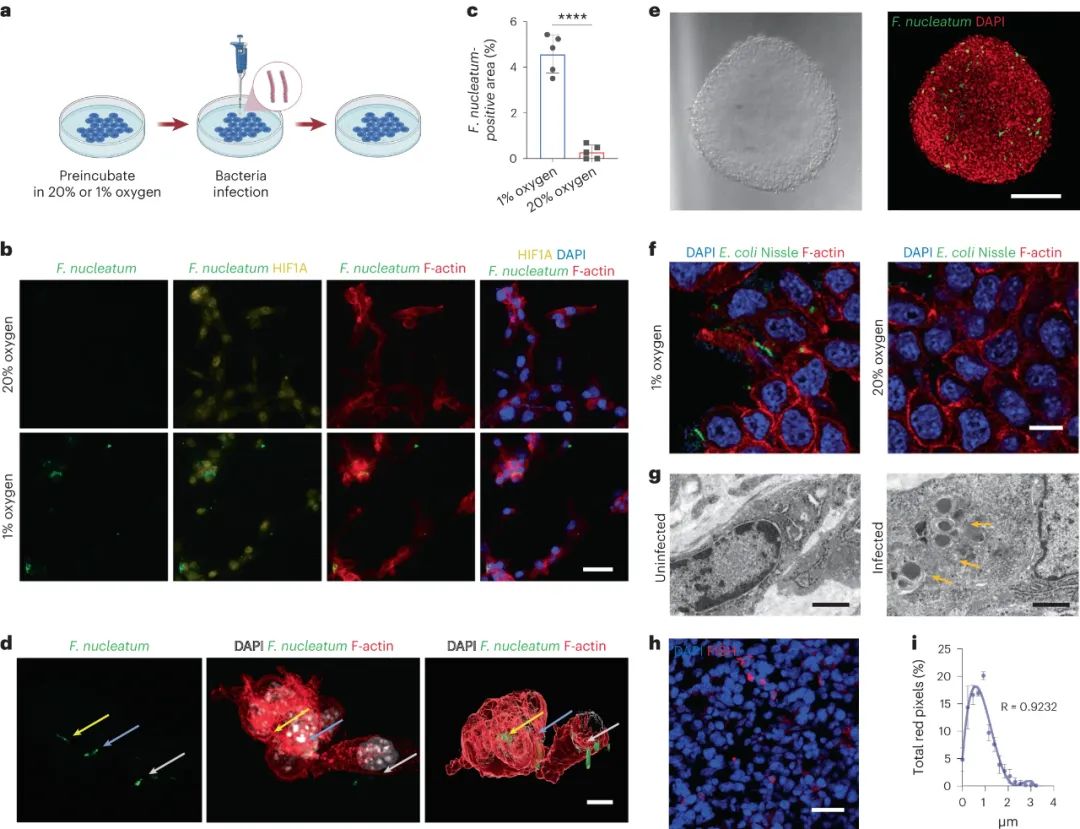
图|细菌侵入CT26FL3(Luc/RFP)肿瘤细胞以响应缺氧
脂质体抗生素消除肿瘤中的细菌
该研究探讨了一种针对寄生在肿瘤低氧区的厌氧菌的药物递送系统,旨在减少对肠道共生微生物的损害。硝基咪唑属于一类抗微生物前药,只有在厌氧菌中通过一氧化还原系统活化后才变得活性。氧气的存在抑制了其产生细胞毒性衍生物的过程。硝基咪唑可与多种金属离子结合,其中Ag+离子被用作抗菌剂。银与硝基咪唑形成的复合物在酸性条件下解离,可释放药物。采用的金属离子作为载体成功将硝基咪唑装载到脂质体中,实现了在肿瘤低pH环境下释放药物的效果。该药物递送系统对厌氧菌具核梭杆菌具有显著的抑制作用,且通过脂质体传递药物可提高药效。此外,实验证实该药物递送系统在一定浓度范围内对细胞和小鼠组织无明显毒性作用。
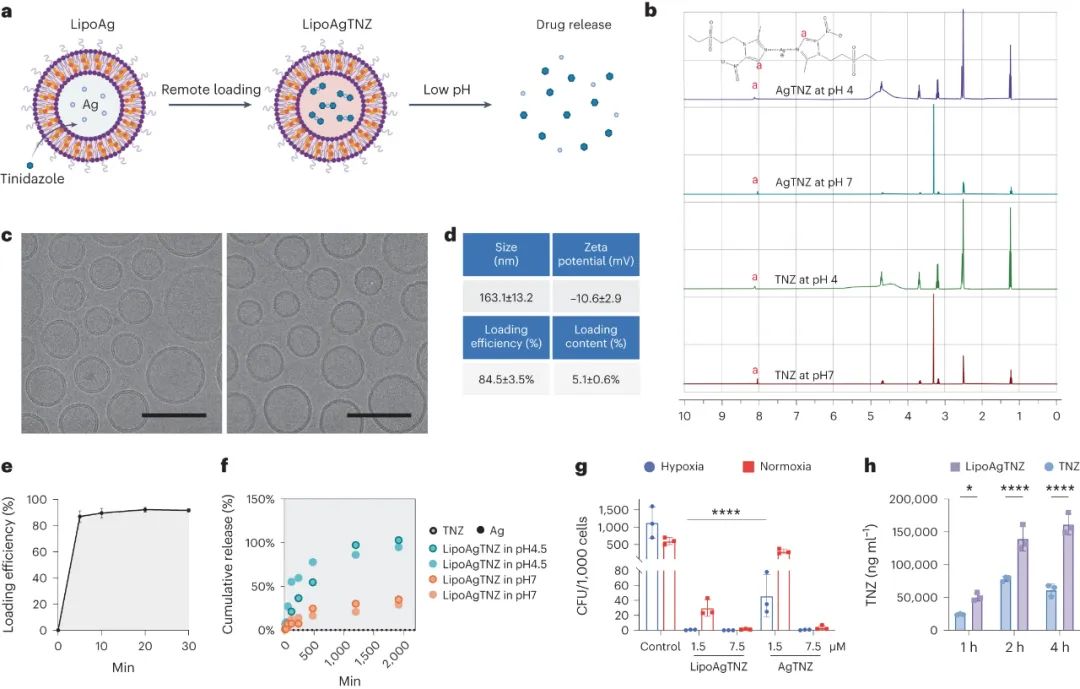
图|pH敏感抗生素脂质体的表征
杀死细胞内细菌改善免疫监视
研究使用感染的结直肠癌(CRC)小鼠模型测试了抗生素脂质体的治疗效果。对于感染了具核梭杆菌或E. coli Nissle的Balb/C小鼠,抗生素脂质体治疗显著抑制了肿瘤生长,特别是LipoAgTNZ在一部分小鼠中实现了长期存活。研究还验证了该方法在不同小鼠模型中的有效性。使用抗生素混合疗法治疗感染的肿瘤减小了肿瘤,但随后发生了癌症复发。LipoAgTNZ通过杀灭肿瘤相关的细菌,诱导了抗癌反应,并在抑制了原发肿瘤生长的同时,恢复了免疫监视并抑制了转移的发展。
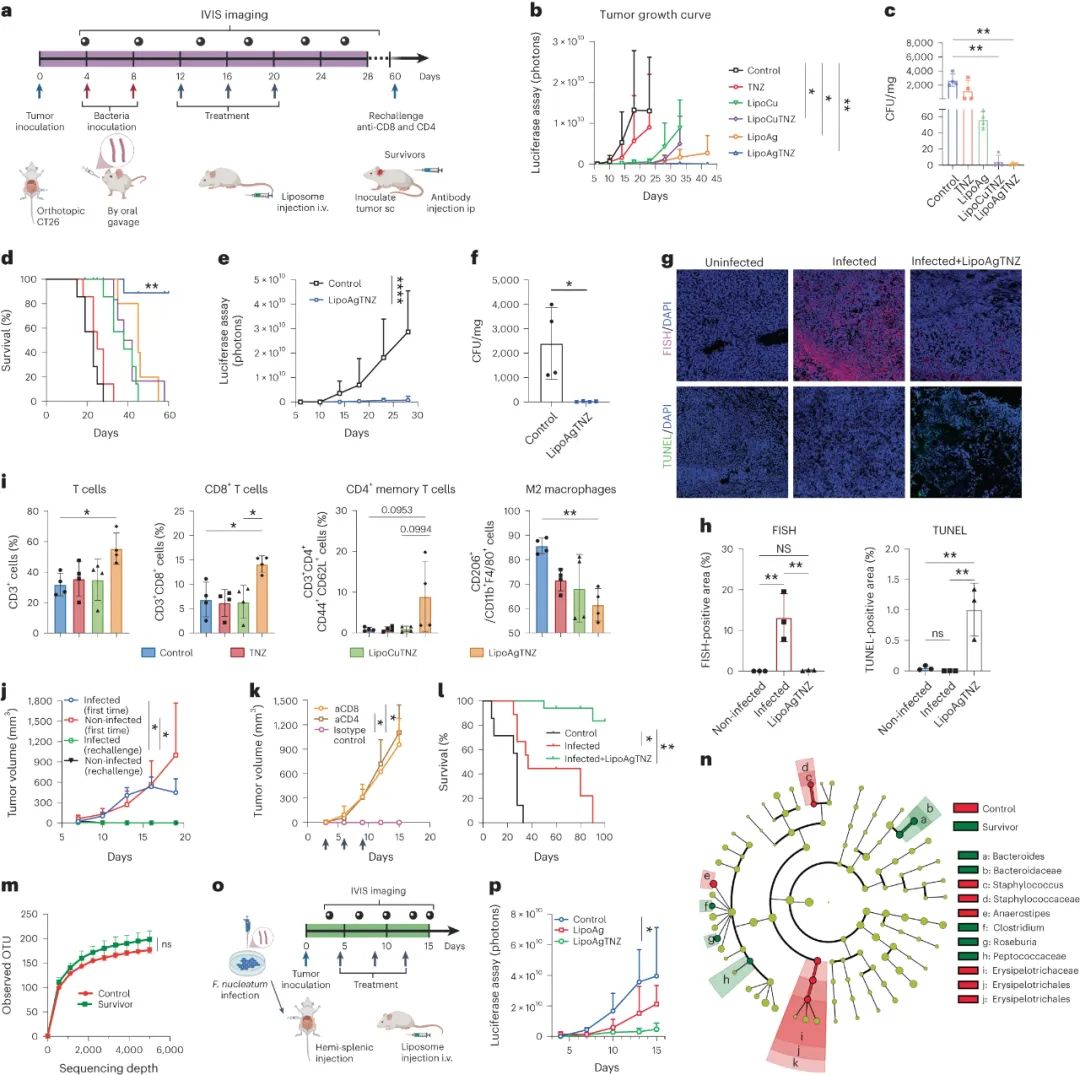
图|脂质体抗生素AgTNZ去除肿瘤中的有核F.nucleum根除CRC
来自长期幸存者的 T 细胞对感染和未感染的肿瘤均表现出特异性
研究发现,来自幸存小鼠的T细胞对感染和未感染的肿瘤细胞都产生了应答,显示出一定的特异性。将这些来自幸存者的T细胞移植到受体小鼠体内,发现它们不仅能有效抑制感染了细菌的肿瘤生长,也可以抑制未感染的肿瘤生长。此外,在受体小鼠的肿瘤中也发现了大量的T细胞。研究表明,幸存者的T细胞对感染和未感染的肿瘤细胞都具有识别能力。
此外,研究还发现,细菌感染降低了某些免疫相关分子的表达,这可能是感染肿瘤细胞免疫抑制机制的一部分。然而,在LipoAgTNZ治疗下,通过杀灭细胞内细菌,恢复了这些分子的表达,从而促进了免疫原性细胞死亡,激活了肿瘤细胞的免疫应答。这项研究的结果表明,通过消除与肿瘤相关的细菌,可以将免疫抑制的微环境转变为抗肿瘤的免疫激活状态。
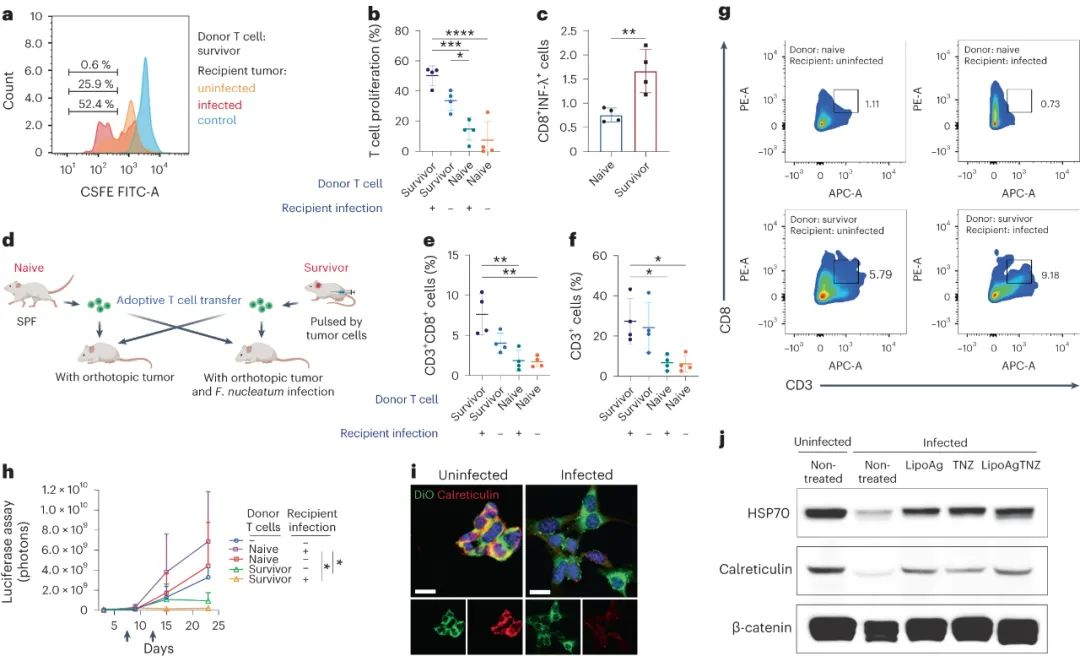
图|来自幸存者的T细胞抑制了感染和未感染肿瘤的生长
抗生素治疗后宿主 T 细胞特异性靶向细菌表位
研究发现,LipoAgTNZ引发了在携带结直肠癌的小鼠中的T细胞免疫反应。通过分析细菌死亡产生的表位,研究者发现细菌蛋白质中含有丰富的细胞质蛋白。为了预测潜在的新表位,研究者选择了数量上排名前的细胞质蛋白进行预测,并从中挑选出具有高结合亲和力的表位。进一步通过与小鼠基因组比对,发现了与细菌共有的同源抗原。研究者从中选定了特定的蛋白质,其含有可能通过MHC-I递呈的序列。这些研究揭示了抗生素治疗后,T细胞主要针对细菌-宿主共有的表位,从而对感染和未感染的肿瘤细胞产生了重要的免疫反应。
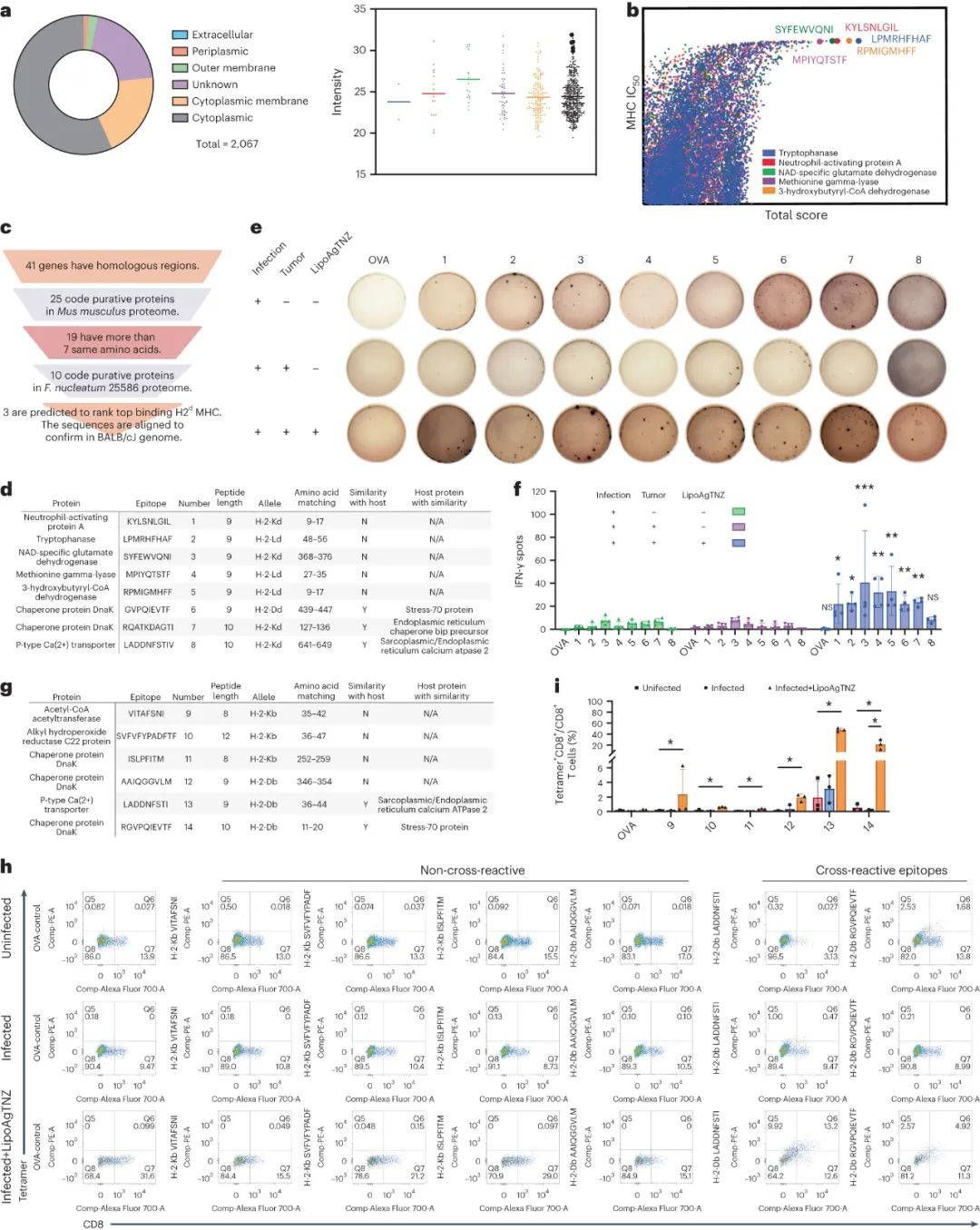
图|肿瘤相关细菌的杀伤促进了细菌新表位的免疫识别
小结:
正在开发的个性化癌症疫苗旨在引导免疫系统对抗个体肿瘤的独特新抗原。除了足够的免疫功能之外,这个过程还依赖于足够的新抗原数量和质量。杀死肿瘤相关细菌可能会提供新抗原的新来源,以促进针对结直肠癌的同源和新表位介导的细胞免疫。
该工作源于这样的观察:针对厌氧菌的抗生素延长了 CRC 患者和感染小鼠的无病存活率。在结肠癌患者中,抗生素带来的益处仅限于切除前的摄入量,这表明瘤内细菌的数量对增强免疫力可能是成功的关键。这些结果为使用针对肿瘤内微生物群的靶向抗生素结合免疫疗法来增强抗肿瘤免疫力的新辅助临床干预铺平了道路。在临床实施之前,需要进行专门的前瞻性研究,对瘤内细菌、肿瘤分期以及抗生素的最佳时机和影响进行分类。
抗生素可以靶向在免疫抑制的肿瘤环境中建立的瘤内促肿瘤细菌,以诱导癌症特异性微生物新抗原的释放。此外,该治疗诱导肿瘤中细胞毒性 CD8+ T 细胞的浸润,该细胞对微生物新表位具有特异性。同源表位还表现出抗肿瘤功效,这可能会导致对未感染肿瘤的免疫反应。因此,杀死肿瘤相关细菌可以将免疫冷肿瘤转变为热肿瘤,并启动免疫系统识别感染和未感染的肿瘤细胞。癌症相关微生物新抗原的发现为开发创新的抗肿瘤治疗或预防性疫苗策略提供了令人兴奋的可能性。
参考文献:
Wang, M., Rousseau, B., Qiu, K. et al. Killing tumor-associated bacteria with a liposomal antibiotic generates neoantigens that induce anti-tumor immune responses. Nat Biotechnol (2023).
https://doi.org/10.1038/s41587-023-01957-8











