癌细胞的代谢适应以满足增殖、肿瘤生长和转移所需的能量、生物合成和抗氧化剂的需求增加。然而,这种代谢重编程是否会影响免疫细胞对癌细胞的识别和消除尚未得到很好的研究。适应性免疫系统由细胞组成,这些细胞通过称为抗原呈递的过程识别和响应各种外部刺激。在肿瘤发展的早期阶段,细胞毒性免疫细胞(如CD8 T细胞)识别并消除免疫原性癌细胞,防止肿瘤生长和转移。然而,随着它们的进展,肿瘤通常会获得使它们逃避免疫检测的特性。免疫细胞的代谢是其功能的重要决定因素,但是癌细胞中的代谢是否会影响它们的免疫原性一直是一个悬而未决的问题。
近日,美国索尔克生物研究所的Susan M Kaech与Gerald S Shadel教授合作报道了线粒体电子传递链在肿瘤生长与免疫反应中的作用。作者团队证明了电子传递链(ETC)中的复合体Ⅱ(CⅡ)的缺失,而不是复合体Ⅰ(CⅠ)缺失,会导致肿瘤抗原呈递与T细胞介导的抗肿瘤作用增强。

这种生物学效应主要是由琥珀酸介导的主要组织相容性复合体-抗原处理和呈递(MHC-APP)基因的转录和表观遗传学激活驱动的。此外,通过敲除甲基化控制的J蛋白(MCJ)使得电子优先通过CⅠ,这促使了ETC重构并实现抗肿瘤反应,同时不会诱导非癌细胞线粒体呼吸总体减少相关的副作用。这些发现表明,靶向线粒体代谢可能是癌症免疫治疗的有效方法,以增强免疫检查点抑制剂的作用。
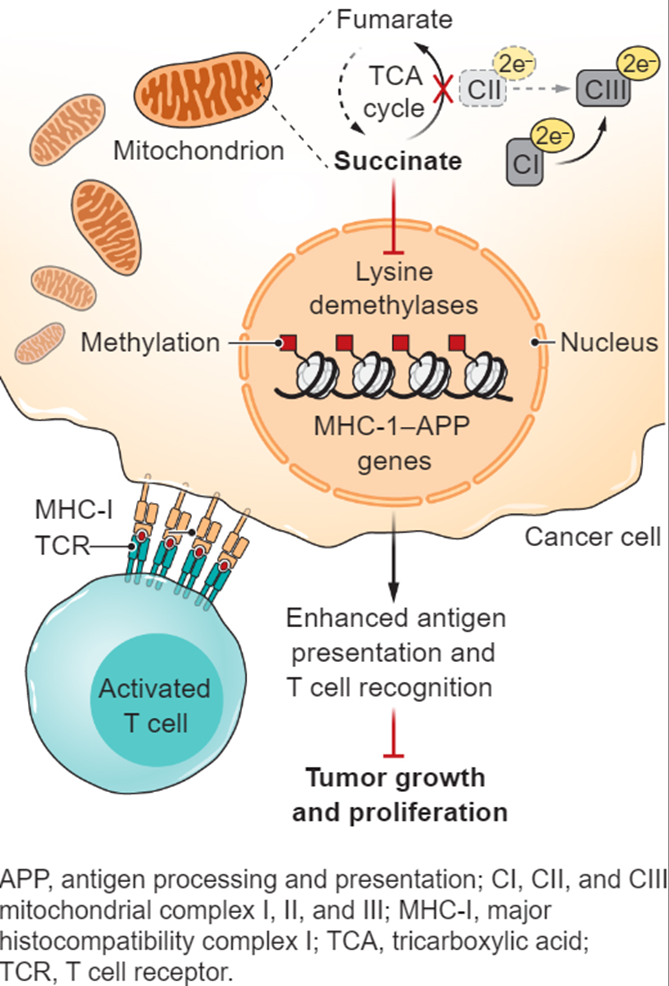
图 文章整体思路
降低线粒体CII活性增强抗肿瘤免疫反应:
为了研究CI和CII对肿瘤生长和抗肿瘤免疫反应的贡献,作者团队调试了等基因CI(sgNdufa1)或CII(sgSdha或sgSdhc)敲除的YUMM1.7(BrafV600E/Pten−/−/Cdkn2a−/−)小鼠黑色素瘤细胞,并将其植入具有免疫能力的小鼠中。敲除CI或CII亚基如预期的那样减少了各自的复合物,但不影响其他ETC复合物的丰度度。CI或CII的丧失也显著降低了氧气消耗、备用呼吸能力和细胞增殖。出乎意料的是,CI和CII敲除对肿瘤生长有显著的不同影响。尽管与CII敲除和对照细胞相比,体外增殖较慢,但CI敲除肿瘤在体内没有表现出任何生长缺陷,这表明YUMM1.7肿瘤生长不需要CI。CII敲除肿瘤的流式细胞术分析显示,与对照和CI敲除肿瘤相比,免疫细胞(CD45+)浸润显著增加,尤其是CD8+T细胞。CD4+T细胞的数量或调节性T细胞(Tregs)的百分比没有观察到显著变化。与此一致,来自CII敲除肿瘤的CD8+T细胞产生更多的干扰素-γ和颗粒酶-B,这表明显著的肿瘤杀伤效应功能是观察到的抗肿瘤活性的原因。
由于主要组织相容性复合体I类(MHC-I)的抗原呈递是T细胞活化和杀伤的主要决定因素,接下来测量了MHC-I在CI和CII缺陷肿瘤细胞上的表达。与CI敲除和对照肿瘤细胞相比,CII敲除肿瘤细胞上的MHC-I表达显著更高。此外,通过敲除CII敲除细胞中的β2-微球蛋白来抑制抗原呈递,证实了肿瘤抗原呈递是CII耗竭的抗肿瘤作用所必需的。与这些数据一致,泛癌数据集的CIBERSORT相关性分析显示,CII基因(SDHA、SDHB、SDHC和SDHD)的表达与多种癌症类型的细胞毒性T细胞基因特征呈负相关。因此,CII的缺失,而不是CI的缺失,通过增加抗原呈递,导致强烈的抗肿瘤T细胞反应。
但是似乎与上述的发现相反的是,CII功能的丧失(即SDHx亚基基因突变)可能在人类中致癌。CII缺乏和琥珀酸盐积累将从一开始就存在,并可能促进肿瘤发生的早期事件。上文论证CII的耗竭通过增强抗原呈递来减少肿瘤生长;因此,这种作用很可能不是对肿瘤起始的影响,而是对免疫系统攻击引起的肿瘤生长的影响。除非存在其他致癌条件,否则小鼠模型中CII的缺失不会导致自发的肿瘤形成。此外,遗传的致癌CII突变通常会影响特定生理环境中的神经内分泌组织,当CII活性受到抑制和/或与其他致癌基因改变结合时,可以促进特定的肿瘤微环境,这些微环境是有条件致瘤的。
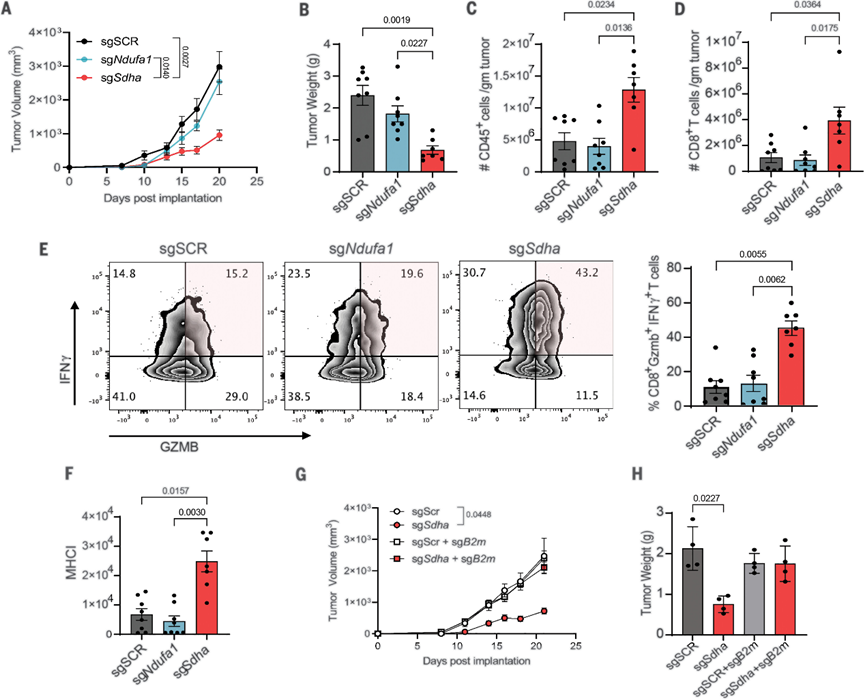
图 线粒体CII抑制通过增加MHC-I增强抗肿瘤免疫力
线粒体琥珀酸增加肿瘤抗原呈递:
接下来探索肿瘤细胞抗原呈递增加的分子机制。首先确定的是CII缺失增加了体外YUMM1.7细胞中MHC-I的细胞表面表达。抑制CII,而不是抑制CI,增加了YUMM1.7细胞中几个主要组织相容性复合体-抗原处理和呈递(MHC-APP)基因的转录。3-NPA处理的4T1小鼠癌症细胞获得了类似的结果。基因表达谱分析显示,CII抑制的细胞显示出IFN反应途径的显著富集,包括APP基因。IFN-γ诱导的MHC-I上调在Ifngr1和Stat1敲除细胞中被消除,但CII抑制仍然导致这些细胞中表面MHC-I的诱导和APP基因的表达。类似地,CII抑制没有诱导STAT1的Y701磷酸化。接下来测试CII抑制诱导的MHC-APP基因是否需要NLRC5或IRF1——这两种已知的转录激活因子。NLRC5的缺失,而不是IRF1的缺失,减弱了CII抑制诱导的细胞表面MHC-I和MHC-APP基因的表达。这些发现表明CII抑制诱导MHC-APP基因表达,不需要IFN信号传导但仍部分依赖于NLRC5。
CII是琥珀酸脱氢酶,而琥珀酸盐影响核基因表达,那么CII抑制是否通过促进琥珀酸盐积累来驱动MHC-APP基因表达。CII抑制的细胞具有高水平的琥珀酸累积。同时用细胞可渗透的琥珀酸盐处理野生型细胞会促进细胞表面MHC-I和MHC-APP基因的表达。由于谷氨酰胺是CII抑制细胞中琥珀酸盐的主要来源,谷氨酰胺饥饿显著减少了3-NPA诱导的琥珀酸盐积累以及细胞表面MHC-I和MHC-APP基因的伴随表达。最后,在CII敲除细胞中敲除2-氧戊二酸脱氢酶的亚基显著降低了琥珀酸水平和MHC-I表达。与此相一致,在CCLE中,CII(尤其是SDHC)和MHC-APP编码基因的表达之间确定了反相关性。此外,对来自肿瘤测序研究的人类乳腺和皮肤癌症样本的分析确定了高SDHC表达样本中MHC-APP基因的显著下调。因此,线粒体CII抑制可以通过琥珀酸盐的积累上调MHC-APP,而不依赖于IFN信号传导,这具有治疗意义。
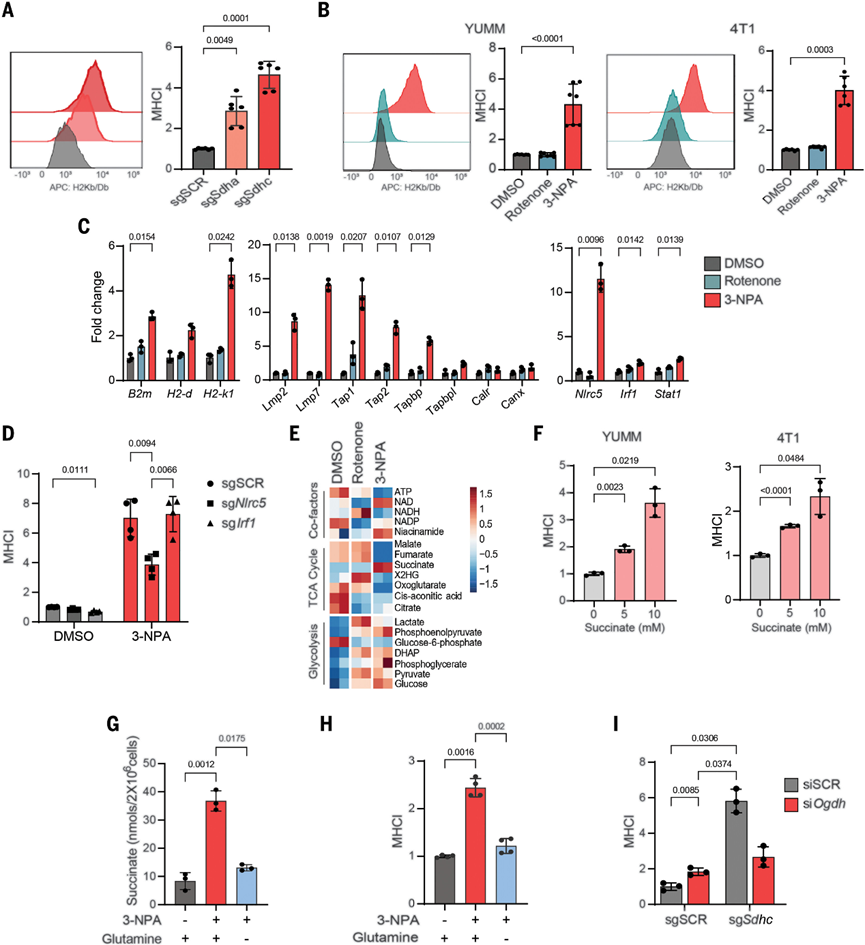
图 在CII抑制时,线粒体琥珀酸酯驱动MHC-I上调
线粒体琥珀酸通过调节肿瘤表观遗传学促进MHC-APP表达:
由于细胞内α-酮戊二酸(αKG)/琥珀酸酯比率是2-OGDD酶活性的重要决定因素,那么CII的抑制是否会降低αKG/琥珀酸酯比例,从而降低2-OGDD活性。抑制CII或向YUMM1.7细胞添加细胞可渗透的琥珀酸盐显著降低了细胞内αKG/琥珀酸盐比率,并增加了组蛋白H3的几个关键赖氨酸残基的三甲基化,这些残基通常与转录调控有关。CII抑制细胞在细胞渗透性αKG处理增加了αKG/琥珀酸盐比率后,并逆转了H3三甲基化、细胞表面MHC-I和MHC-APP基因的表达,与琥珀酸盐介导的2-OGDD的抑制一致,2-OGDD是CII抑制的关键下游效应分子。但是,用5-氮杂胞苷(DNA甲基转移酶抑制剂)处理CII抑制细胞并没有阻止MHC-I表达的增加,而是进一步增加了MHC-I的表达,因此琥珀酸盐对TET DNA去甲基化酶活性的抑制可能不是CII抑制介导的MHC-APP表达的主要因素。
组蛋白甲基化的状态由KDM和组蛋白甲基转移酶的相对活性决定,琥珀酸盐介导的KDMs抑制使平衡向组蛋白甲基化增加转变。与CII抑制相比,KDM5-C70对KDM5家族(H3K4me3去甲基化酶)的抑制增加了MHC-I的表达,并伴随着H3K4me3水平的增加。接下来,在CII敲除细胞中对H3K4me3、H3K36me3和H3K27me3特异性的组蛋白甲基转移酶进行敲除,以恢复各自的组蛋白甲酯化。尽管敲低这些不会影响IFN-γ诱导的MHC-I的增加,但敲低KMT2A和SETD2逆转了琥珀酸增加对表面MHC-I和MHC-APP基因表达的影响。因此,H3K4me3和H3K36me3是调节抗原呈递以响应琥珀酸积累的关键分子。
为了评估CII抑制对全局表观遗传重编程的影响,在用3-NPA、3-NPA和αKG(与琥珀酸竞争)或二甲基亚砜(DMSO)作为载体对照处理的YUMM1.7细胞中对H3K4me3和H3K36me3进行了染色质免疫沉淀测序(ChIP-seq)。正如预期的那样,在CII抑制后,H3K4me3和H3K36me3信号表现出全基因组增益,这通过补充αKG而显著逆转。值得注意的是,几个MHC-APP基因显著富集H3K4me3和H3K36me3。例如,在Nlrc5、Psmb9、Tap1和Psmb8的启动子区域中,H3K4me3水平显著增加,并且这通过αKG处理显著逆转。基于转录因子和表观遗传学结果,提出一个琥珀酸盐激活MHC-APP转录的模型。CII抑制导致下游的琥珀酸积累,通过抑制KDM4和KDM5组蛋白去甲基化酶活性与增加NLRC5水平,实现协同诱导MHC-APP基因转录增加。
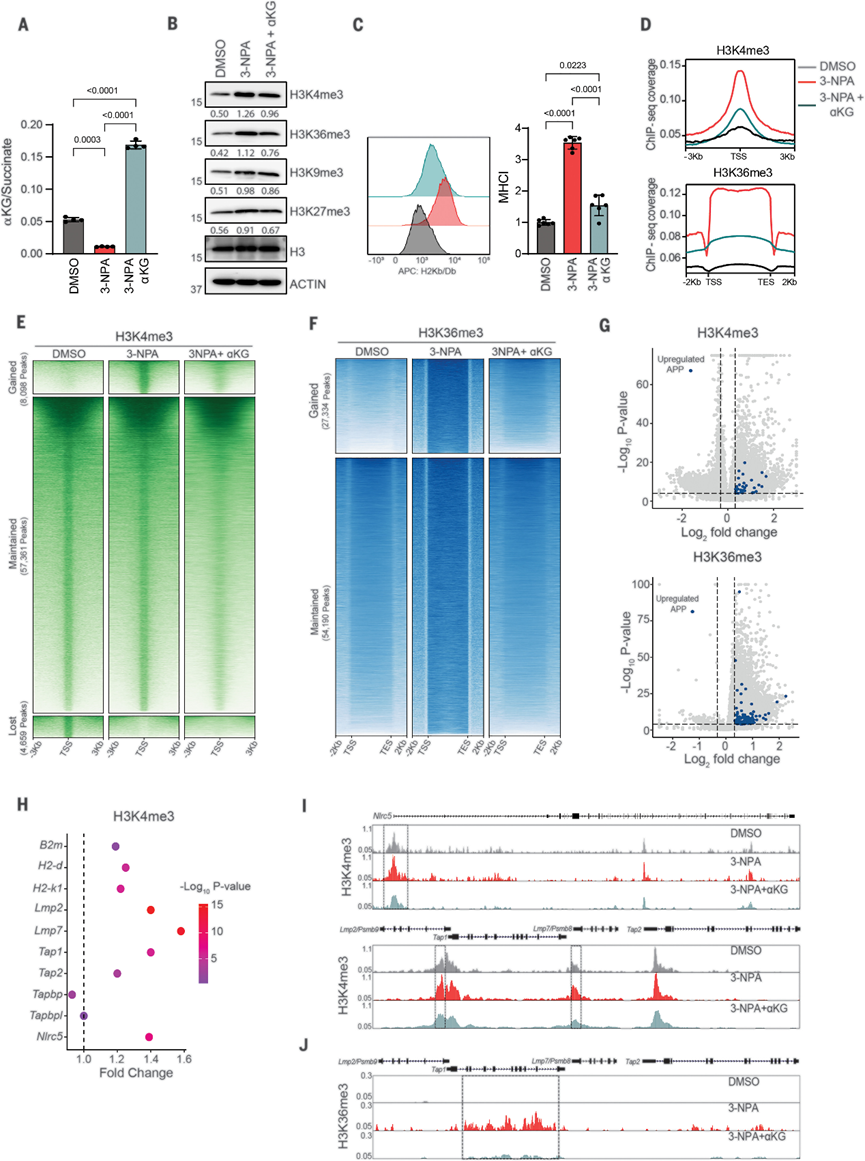
图 线粒体琥珀酸影响组蛋白甲基化调节抗原呈递
增加线粒体CI相对电子流量可增强肿瘤免疫原性和TCR多样性:
先前的研究已经证明琥珀酸对巨噬细胞和T细胞的促炎作用。上述研究还表明,琥珀酸盐在肿瘤细胞内的积累是通过增加抗原呈递来激活T细胞介导的杀伤。然而,全身抑制CII可能不是提高肿瘤琥珀酸水平的可行方法,因为它可以引发新的肿瘤发生,具有神经毒性,并且由于线粒体ETC活性和ATP产生减少很可能会对正常细胞和组织产生其他不利的生理影响。然而,增加CI驱动的电子流可能会竞争性抑制CII活性,以促使琥珀酸盐积累而不会显著降低总ETC活性和ATP产生。甲基化控制的J蛋白(MCJ)是线粒体内膜中的一种内源性CI相互作用蛋白,其敲除导致CI活性高于CII并与CIII形成超复合物。因此,假设通过敲除MCJ来重排ETC以降低CII活性,并促进MHC-APP的表达和抗肿瘤免疫。
在YUMM1.7细胞中敲除MCJ增加了CI+CIII活性,同时CII+CIII活性降低,导致细胞内琥珀酸盐、抗原呈递和MHC-APP基因表达水平增加。对Mcj KO细胞中代表性MHC-APP基因启动子qPCR证实了H3K4me3富集增加,类似于直接CII抑制。与对照肿瘤相比,Mcj-KO肿瘤在小鼠体内生长明显较慢,保持高水平的MHC-I并有更多的CD45+免疫细胞,尤其是CD8+T细胞浸润。在免疫原性更强的小鼠黑色素瘤肿瘤模型中观察到类似的结果。来自对照肿瘤的浸润性CD8+T细胞表达活化标记CD44和CD69以及TCF-1转录因子,而Mcj-KO肿瘤中的表达更大量的PD-1、TIM3、CXCR6、TOX,以及效应分子如IFN-γ和GZMB。抗体介导的CD8+T细胞的耗竭恢复了Mcj-KO肿瘤的生长,证实了CD8+T淋巴细胞在肿瘤控制中的作用。
接下来,进行单细胞转录组学和单细胞TCR测序,以分析YUMM1.7 Mcj KO和sgSCR肿瘤CD8+T细胞的mRNA和TCRαβ库。尽管sgSCR肿瘤中的大多数CD8+T细胞聚集在一起并显示出记忆性CD8+T的特征,但来自Mcj KO肿瘤的CD8+T细胞聚集成PD1+CXCR6+CD8+T,PD1+XCL1+CD8+T细胞,以及增殖的PD1+CD8+T细胞。来自对照的大多数CD8+T细胞具有独特的单TCR克隆型,但来自Mcj KO的CD8+T细胞由表达Pdcd1、Cxcr6、Gzmb,和IFNγ基因的超扩增克隆组成。总之,增加细胞内肿瘤琥珀酸盐和MHC-I(通过Mcj KO或直接CII抑制)增强了肿瘤细胞的免疫原性,并增强了抑制肿瘤生长的更多肿瘤反应性效应CD8+T细胞的激活和浸润。因此,这种ETC重构的方法可能代表了一种将冷肿瘤转化为热肿瘤并提高抗肿瘤反应和免疫治疗效果的新方案。
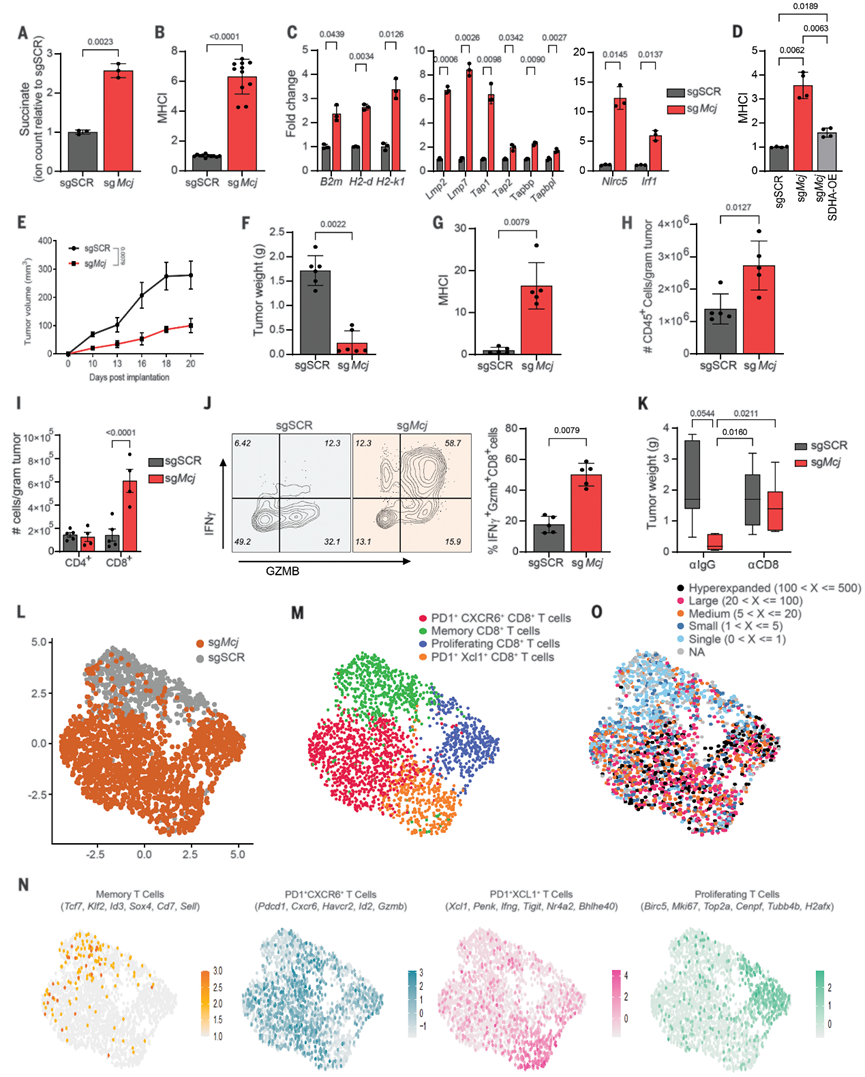
图 OXPHOS治疗概念性证明
小结:
本文中作者团队证明,在肿瘤细胞中由CII抑制引起的琥珀酸盐积累降低了α-酮戊二酸盐/琥珀酸盐的比率,随后抑制了组蛋白去甲基化酶。这些表观遗传酶的抑制增加了H3K4和H3K36对参与抗原处理和呈递的基因的三甲基化,从而诱导了这些基因的表达并激活了T细胞介导的肿瘤细胞杀伤。这些变化被α-酮戊二酸补充而逆转。全身抑制CII活性不是一种可行的治疗方法,因为可能会产生副作用,包括神经毒性。相反,作者团队提出了癌症细胞线粒体中电子传输链重排。甲基化控制的J蛋白(MCJ)的敲除增强了通过CI的电子流。这降低了CII的活性,导致琥珀酸盐的积累和更高的抗肿瘤免疫力。这种方法可以提高免疫治疗的成功率,尤其是在抗原处理和呈递基因表达低的肿瘤中。
这些研究结果引发了几个后续问题。如抑制CII活性阻止肿瘤生长的观察结果似乎与琥珀酸作为肿瘤促进代谢产物的既定作用相矛盾。作者讨论说明这可能是由促进肿瘤的CII突变发生的背景影响。大多数功能丧失CII突变是遗传的,因此存在于肿瘤发生的早期阶段,促进肿瘤的发生和发展。此外,CII种系突变可能与其他致癌基因改变共存,并协同刺激肿瘤的发生和发展,掩盖了琥珀酸可能的抗肿瘤作用。未来的研究应该阐明琥珀酸发挥致癌或抗肿瘤作用的分子机制。
目前尚不清楚琥珀酸是如何从线粒体输出到细胞核中并改变基因表达的。线粒体二羧酸盐载体(SLC25A10)是线粒体琥珀酸盐载体,但其是否参与以及其活性的改变是否与所提出的琥珀酸-组蛋白去甲基化酶-免疫原性轴有关仍有待探索。此外,琥珀酸可能通过核膜上的孔隙扩散到细胞核中。然而,维持线粒体和细胞核这两个不同的琥珀酸库并阻止不必要的细胞器间易位的机制仍然难以捉摸。作为一种可能的解释,最近的研究已经确定了细胞核中的非经典三羧酸循环,其局部产生琥珀酸。然而,目前尚不清楚如何及时、准确地将琥珀酸从线粒体转运到细胞核。事实上,线粒体、胞质溶胶和细胞核的生物物理性质不同都会阻碍细胞器间运输。
不可否认的是作者团队的研究结果在多个层面上都令人兴奋。线粒体代谢产物与免疫原性的表观遗传学调节之间的联系,可能对免疫学和以琥珀酸积累为特征的条件的研究(如缺血再灌注损伤)具有广泛的意义。这些发现还表明,靶向线粒体代谢可能是癌症免疫疗法的有效方法,以增强免疫检查点抑制剂的作用。
参考文献:
Manipulating mitochondrial electron flow enhances tumor immunogenicity. Science 2023.
DOI: 10.1126/science.abq1053
https://www.science.org/doi/10.1126/science.abq1053











