
特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。
原创丨彤心未泯(学研汇 技术中心)
编辑丨风云
分子的单原子变化对其功能特性影响巨大,如氢键、极性、代谢稳定性、靶标特异性和溶解度,都可以通过用一个组成原子替换另一个原子来显着调节。用氮原子取代芳香族碳原子将有助于发现潜在的药物,但只有间接方法可以实现C到N的转变,对芳香族和杂芳香族骨架进行直接“转化”的能力仍然受到很大限制。
有鉴于此,芝加哥大学Mark D. Levin和美国默克公司Alec H. Christian等人报道了将杂芳族碳原子直接转化为氮原子,从而将喹啉转化为喹唑啉。母体氮杂芳烃的氧化重组产生了带有亲电位点的开环中间体,为环的重新闭合和碳基离去基团的排出奠定了基础。这种“粘性末端”方法颠覆了现有的原子插入-删除方法,从而避免了骨架旋转和取代基扰动在逐步骨架编辑中常见的缺陷。作者展示了广泛的喹啉和相关氮杂芳烃,它们都可以通过用氮原子替换C3碳来转化为相应的喹唑啉。机理实验支持了活化中间体的关键作用,并表明了C-N转化反应发展的更通用策略。
药物化学中C-N转变简介
在药物化学中,通过用N取代芳香族碳原子可以显著调节其分子特性,进而实现功能调节。作者展示了“必要氮原子”效应的说明性示例,表明替换先导支架中的一个或多个碳对于最终临床候选药物的成功至关重要。目前,对芳香族和杂芳香族骨架进行直接“转化”的能力仍然受到很大限制。作者开发了一种独特的碳到氮转变策略,其中骨架重建将为系统同时氮插入和碳缺失做好准备。这种方法有效地解决了位点选择性问题,中间体可以通过苯并氮杂环的氧化裂解原位制备,其中反芳香性驱动的解共使得烯醇醚部分能够充当独立的烯基官能团。
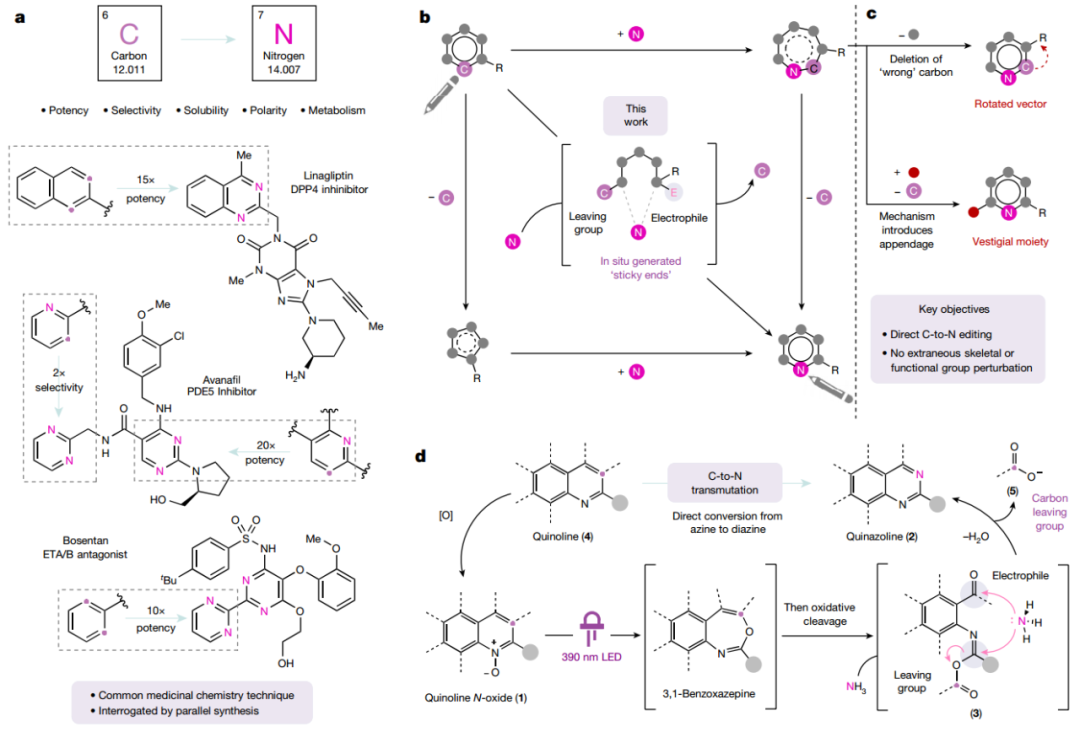
图 C-N转变简介
氮杂芳烃的C至N转变范围
接着,作者检查了该策略的适用范围,发现可以以良好的产率制备多种C2-芳基喹唑啉,包括杂环取代基,还可以扩展到N,N'-二氧化物。C2-酯和C2-烷基喹唑啉同样可以通过此方法获得。氯、甲氧基和邻苯二甲酰亚胺等杂原子取代基都可以通过该方法成功转化为喹唑啉。N-氧化物部分还可以直接在喹啉的C8位上进行过渡金属催化的C-H官能化。尽管在C2-未取代喹啉氮氧化物中,形成喹诺酮的竞争氢化物转变仅部分被苯并恶嗪竞争,但该方法可以制备缺少C2取代基的喹唑啉,尽管产率有所降低。
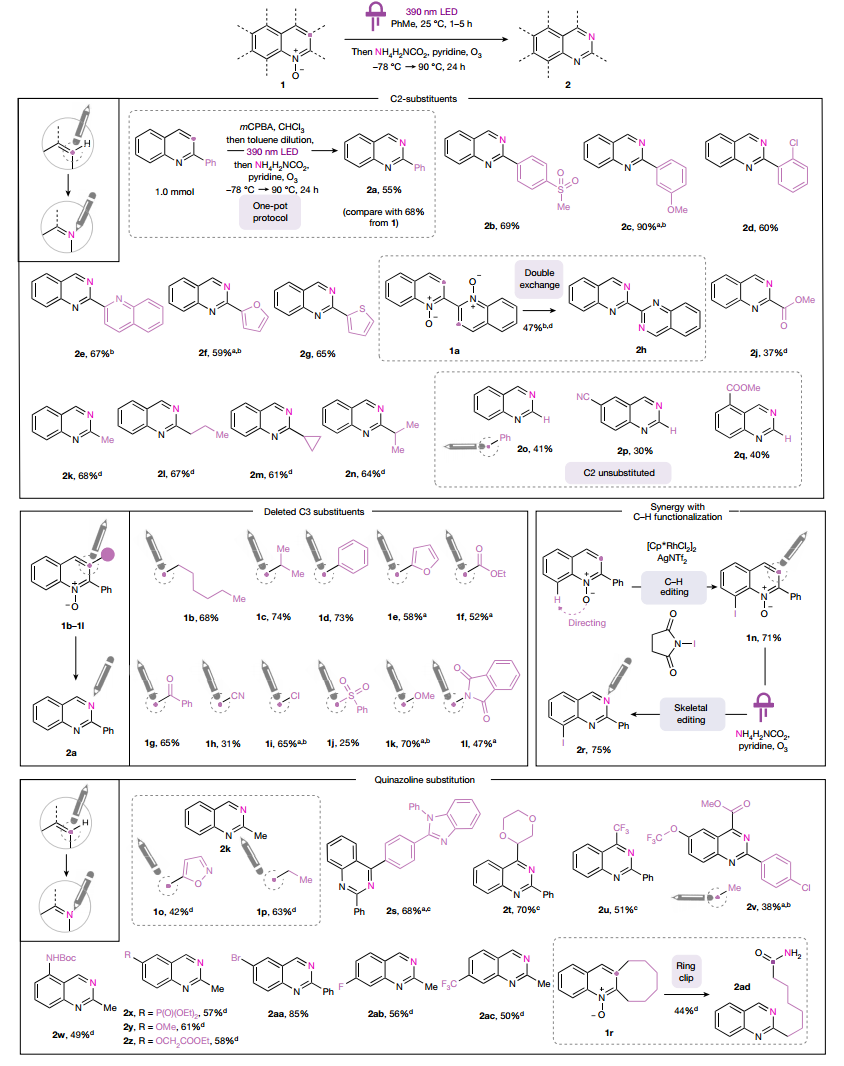
图 氮杂芳烃C至N转化的范围
C-N转变合成应用
贝鲁舒地尔是FDA于2021 年批准的药物,作者在合成贝鲁舒地尔的克级规模上展示了C-N转变方法。通过将本工作提出的方法应用于全套异构[1,n]-萘啶,以简单的方式提供稀有的[1,3,n]-三氮萘,进一步证明了该方法的相关性。作者还使用转变方案编辑了制备他奈坦)的合成中间体,O-甲基他奈坦 N-氧化物在相应条件下转化为相应的喹唑啉。二氢乳清酸脱氢酶抑制剂布喹那的甲酯衍生物同样容易受到该方法的影响,得到相应的喹唑啉。
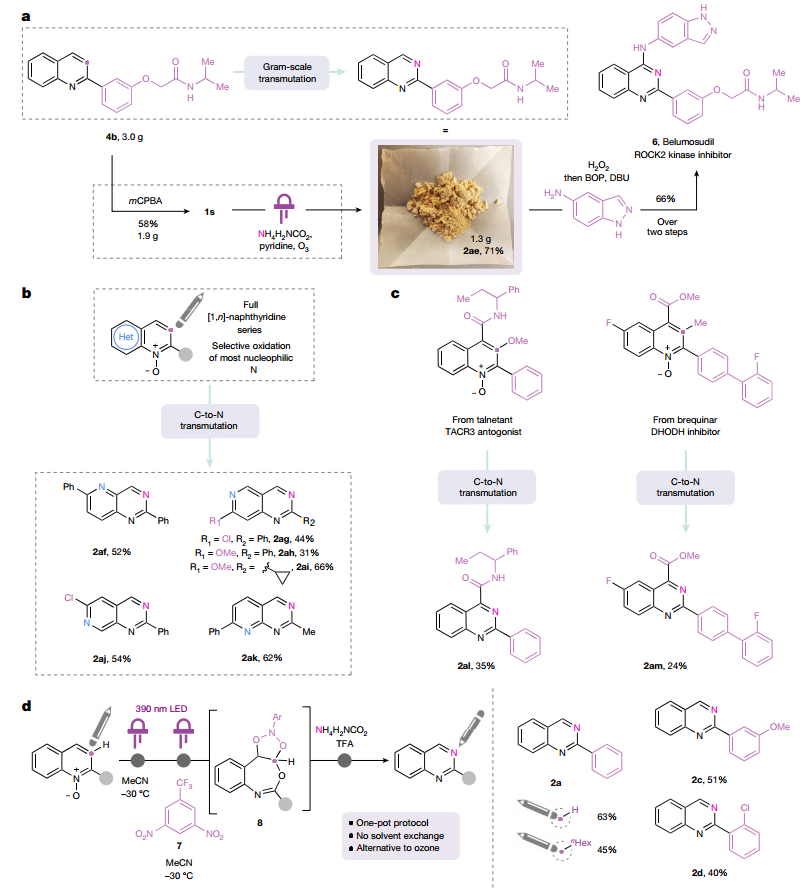
图 氮杂芳烃C-N变换的合成应用
机理研究
为了进一步了解转化机制,作者制备了13C标记的喹啉N-氧化物,通过13C核磁共振波谱监测反应。实验结果强调了“粘端”中间体的关键——它不仅激活C3作为羧酸离去基团,而且还通过激活C2以取代亚胺酸酐来促进氨的缩合。这种“粘性末端”方法避免了骨架旋转和取代基扰动在逐步骨架编辑中常见的缺陷。
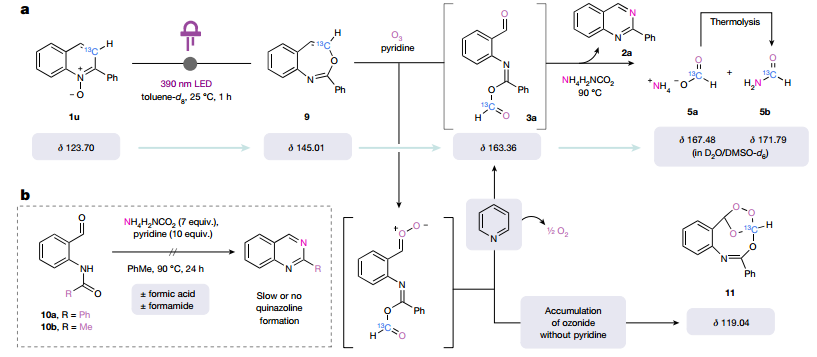
图 机理实验
参考文献:
Woo, J., Stein, C., Christian, A.H. et al. Carbon-to-nitrogen single-atom transmutation of azaarenes. Nature 623, 77–82 (2023).
DOI:10.1038/s41586-023-06613-4
https://doi.org/10.1038/s41586-023-06613-4











