
特别说明:本文由米测技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。
原创丨彤心未泯(米测 技术中心)
编辑丨风云
对映体纯手性产品可被用作药物和功能材料,其需求不断增加,因此,对映选择性催化剂的设计和发现一直是有机化学的持久目标。在过去的几十年里,以自由基物质为关键中间体的催化对映选择性反应的发展取得了巨大进展,其中包括使用路易斯酸、有机催化剂、过渡金属、酶催化剂和光催化剂等各种催化方法均已被报道。
然而,自由基催化剂的开发设计仍存在以下问题:
1、开发功能独特的催化剂和催化反应极具挑战性
尽管取得了这些令人兴奋的进展,但结构和功能上不同的手性催化剂和机理上不同的催化反应的开发是非常理想的,但实现起来却具有挑战性。开发用于对映选择性合成的功能独特的催化剂是合成化学的一个突出且具有挑战的目标。
2、有机自由基催化剂的使用受到寿命限制
有机自由基通常作为化学计量促进剂或中间体参与各种反应,但因为这些物质的寿命短和反应活性高,使用有机自由基作为催化剂仍然受到限制,这对实现有效的催化循环构成了显着的挑战。
3、使用手性自由基催化剂的不对称反应是一个艰巨的挑战
有机自由基特定的化学性质可以促进显着的分子转化,自由基物种已被报道为环化反应的有效催化剂。然而,使用手性自由基催化剂的不对称反应仍然是一个艰巨的挑战,主要困难在于缺乏合适的手性催化剂。
有鉴于此,中科大汪义丰、傅尧和张凤莲等人报道了一系列手性N-杂环卡宾(NHC)连接的硼基自由基作为催化剂,能够催化不对称自由基环异构化反应。自由基催化剂可以由容易制备的NHC-硼烷络合物产生,手性NHC组分的广泛可用性为立体化学控制提供了实质性的好处。机理研究支持包括硼基自由基加成、氢原子转移、环化和硼基自由基催化剂消除的催化循环顺序,其中手性NHC亚基决定自由基环化的对映选择性。这种催化作用可以将简单的起始材料通过不对称构建生成有价值的手性杂环产物。
技术方案:
1、提出了基于两个硼基自由基催化的环异构化反应并验证了可行性
作者提出了基于两个硼基自由基催化的环异构化反应,通过模型底物证明了催化反应是有效的。
2、探究了两种催化不对称自由基环异构化反应的底物范围
作者通过实验正式了NHC-硼基自由基通过催化循环A和B催化的对映选择性异构化反应显示出广泛的底物范围和良好至优异的对映控制水平。
3、阐明了合成应用和催化分子间反应
作者说明了这两种催化环异构化反应可用于各种通用的结构单元的构建,以及环噻啶、[2+2+2]环化等多种反应。
4、解析了不对称催化的反应机理
作者通过实验和理论计算解析了催化反应包括硼基自由基加成到炔烃、氢原子转移(HAT)、环化和硼基自由基催化剂的消除等过程,手性NHC亚基决定自由基环化的对映选择性。
技术优势:
1、报道了一种通用有效的不对称NHC-硼基自由基催化模式
本工作报告了一种通用且有效的不对称NHC-硼基自由基催化模式的发展,该模式能够实现不对称自由基环异构化反应,从而快速组装一系列对映体富集的五元和六元杂环。
2、阐明了不对称催化机理和选择性起源
作者证实了催化循环历程,表明手性NHC单元创造了一个手性微环境,可以在C-C中发挥有效的立体化学控制成键环化步骤,所获得的含有α-立体中心的杂环类似于药物化学研究中的药物或目标化合物的手性片段。
技术细节
反应设计
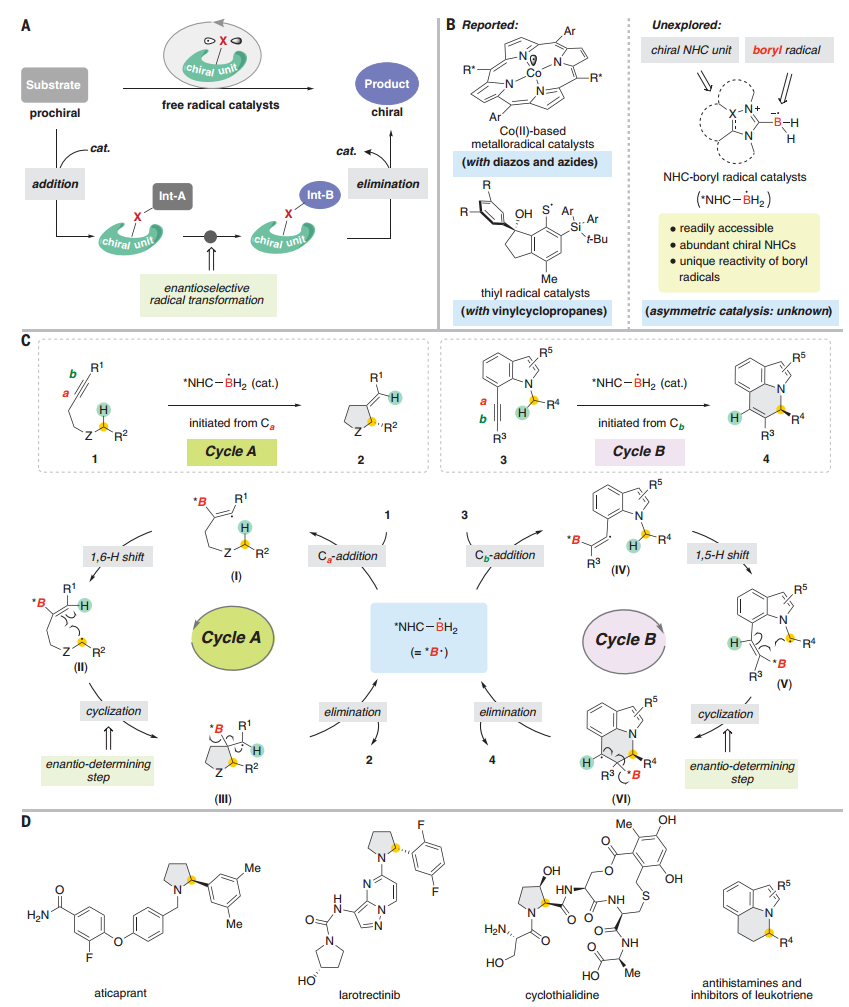
图 用于催化对映选择性反应的自由基催化剂
反应进展
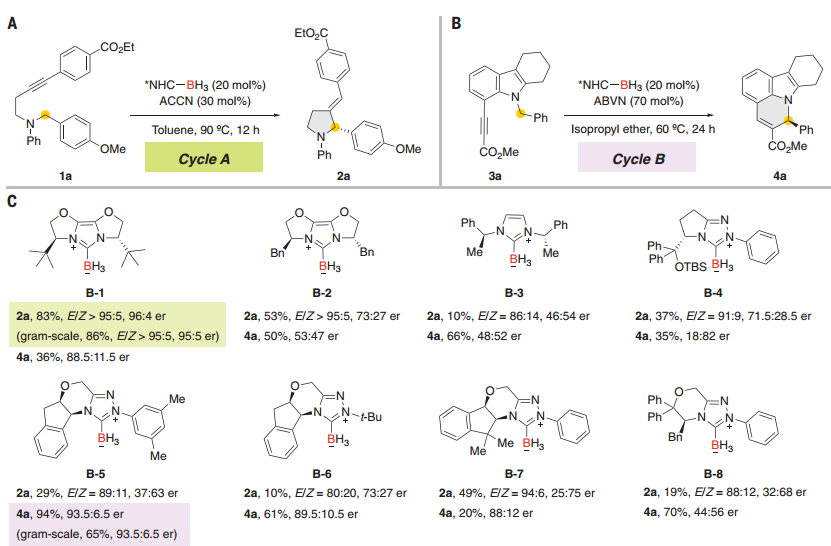
图 反应发展
两种催化不对称自由基环异构化反应的底物范围
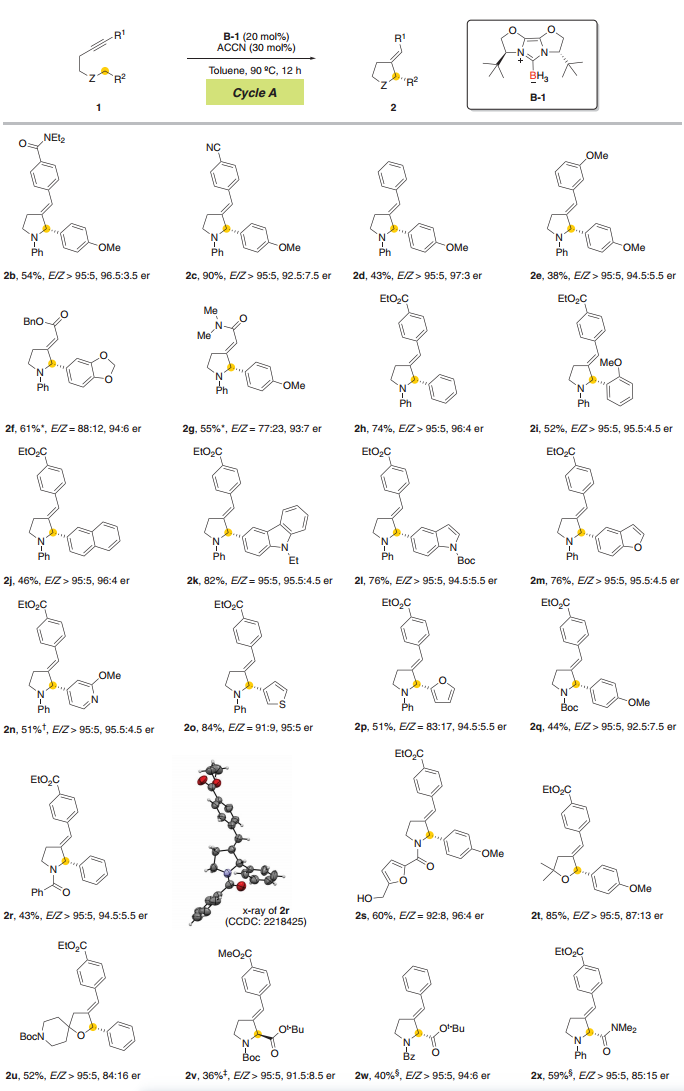
图 NHC-硼基自由基催化N-苄基高炔丙胺不对称环异构化的底物范围
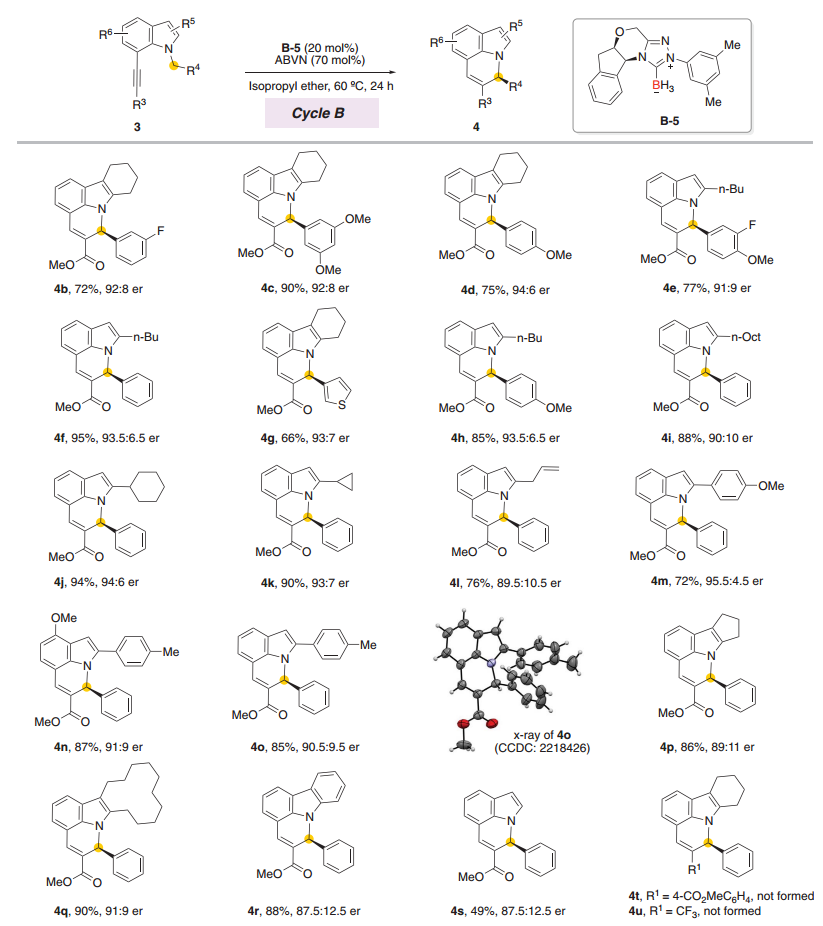
图 NHC-硼基自由基催化不对称环异构化的底物范围
合成应用和催化分子间反应
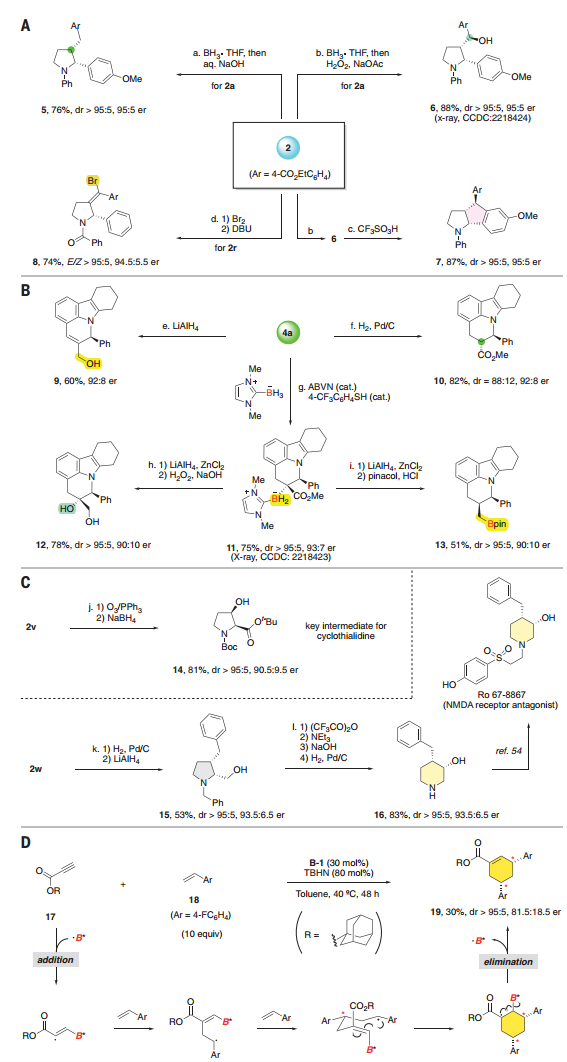
图 合成应用和催化分子间反应
机理分析
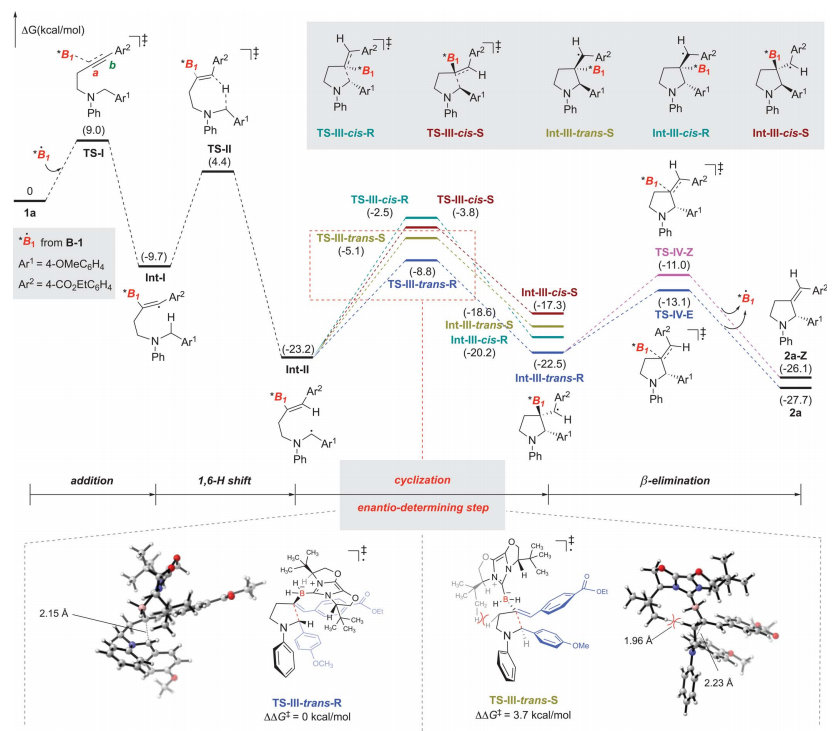
图 1a与B-1衍生的硼基自由基催化剂反应的对映选择性分析
总之,作者报告了一种通用且有效的不对称NHC-硼基自由基催化模式的发展,催化循环通过一系列硼基自由基加成到炔烃、氢原子转移(HAT)、环化和硼基自由基催化剂的消除进行,在此期间,手性NHC单元创造了一个手性微环境,可以在C-C中发挥有效的立体化学控制成键环化步骤。实验和计算研究已经阐明了反应机理和对映选择性的起源。所获得的含有α-立体中心的杂环类似于药物化学研究中的药物或目标化合物的手性片段,但从简单的起始材料通过不对称催化进行对映选择性合成仍然是一个挑战。
参考文献:
CHANG-LING WANG, et al. Boryl radical catalysis enables asymmetric radical cycloisomerization reactions. Science, 2023, 382(6674):1056-1065.
DOI: 10.1126/science.adg1322
https://www.science.org/doi/10.1126/science.adg1322











