
特别说明:本文由米测技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。在α-碳中心含有两个不同碳基取代基的非天然手性α-叔氨基酸广泛存在于生物活性分子中,这种空间刚性支架正在成为药物发现领域日益增长的研究兴趣。然而,由于立体选择性构建空间阻碍的四取代立体碳中心的挑战,手性α-叔氨基酸合成的稳健方案仍然稀缺。有鉴于此,华东理工陈宜峰、曲景平等人报道了钴催化的酮亚胺与各种未活化的烷基卤化物(包括烷基碘、烷基溴和烷基氯)的对映选择性aza-Barbier反应,实现了手性 -叔氨基酯的高对映选择性和优异的官能团耐受性的形成。在该不对称还原加成方案中,一级、二级和三级有机亲电子试剂均被耐受,这为充分利用对湿气和空气敏感的有机金属试剂的对映选择性亲核加成提供了补充方法。此外,α-酮酯、胺和卤代烷的三组分转化代表了羰基的形式不对称脱氧烷基胺化。 aza-Barbier反应是在还原剂存在下,利用烷基卤化物对不饱和碳杂原子键进行亲电加成,是醇和胺合成的一种通用合成方法。该反应形成类似手性氨基酸衍生物的挑战在于从烷基卤化物前体原位产生的自由基的对映体面的区分。本工作设想在手性配体诱导的帮助下,选择钴催化剂捕获原位形成的烷基自由基物种,以生成亲核手性烷基-Co物种。该策略可以提供区分酮亚胺的对映体面的可能性,从而完成四取代立体中心的构建。烷基自由基与钴中心的快速结合对于通过避免侧外消旋自由基加成序列来实现高对映选择性至关重要。在此,通过鉴定酮亚胺与未活化的烷基卤化物的钴催化亲电烷基化加成,描述了用于α-叔氨基酯合成的对映选择性aza-Barbier反应平台。
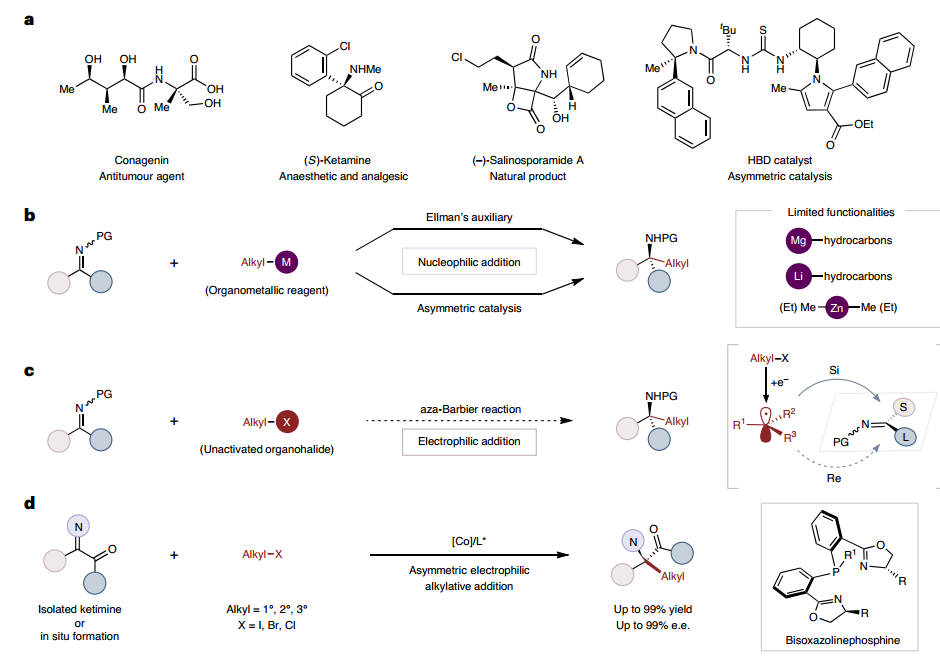
作者选择模型底物验证了所提出方案的通用性,该方案在标准条件下与各种伯烷基碘反应良好,以良好的产率和优异的对映选择性提供相应的手性 α-叔氨基酯,甚至可以进行克级反应。为了进一步证明该方案的实际合成应用,进行了各种转化。通过酮酯和苯胺缩合原位形成的酮亚胺的共催化aza-Barbier反应提供了α-氨基酯,证实了羰基的正式不对称脱氧双官能化烷基胺化。此外,作者还证实了该方案可以有效地构建在α位具有四元立构中心的含氮杂环,通过采用不同的酮亚胺底物与叔丁基(2-碘乙氧基)二甲基硅烷在简单的条件下可以选择性地获得手性氮杂环丁烷和γ-内酯,表明了该方案适用于药物化学领域。
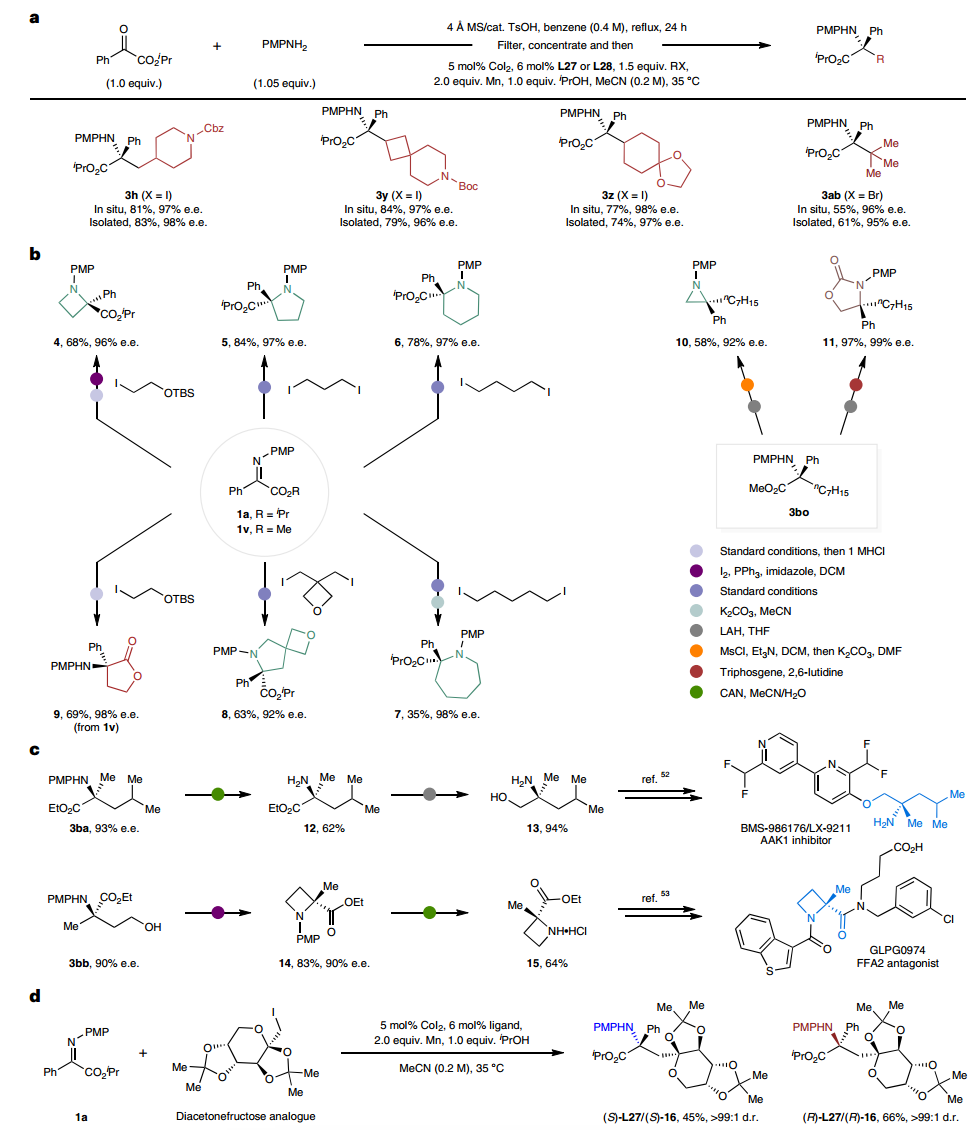
为了更深入地了解反应机理,作者进行了几项初步的机理研究,表明了单电子转移(SET)过程在反应过程中产生烷基自由基的可能性,Co(I)络合物可能是反应的引发剂。作者通过在与Co(I)络合物的化学计量反应中评估了不同量的Mn还原剂,更深入地了解反应过程中钴中心的氧化态,表明烷基-Co(III)物质可能不是反应物质。而反应过程中可能会发生Co(I)和烷基-Co(III)物质之间的气化过程,从而产生用于后续迁移插入步骤的反应性烷基-Co(II)中间体,烷基-Co(II)物质可能是催化循环中的活性Co物质。
Wu, X., Xia, H., Gao, C. et al. Modular α-tertiary amino ester synthesis through cobalt-catalysed asymmetric aza-Barbier reaction. Nat. Chem. (2023). https://doi.org/10.1038/s41557-023-01378-9















