

第一作者:Shang-Zheng Sun
通讯作者:Todd K. Hyster
通讯作者单位:普林斯顿大学
光酶催化(Photoenzymatic catalysts)具有可调控的酶催化位点,因此是具有前景的立体选择性自由基转化方法学。当使用黄素蛋白(flavoproteins)用于非天然的光酶催化反应,通常由自由基方式开启反应。羧酸和有机胺等广阔的官能团能够通过氧化反应产生自由基。但是黄素蛋白的激发态通常容易被蛋白的骨架结构淬灭,导致黄素蛋白的激发态寿命非常短暂。
有鉴于此,普林斯顿大学Todd K. Hyster等报道黄素蛋白烯还原酶(flavin-dependent ′ene′-reductases)加入外源的Ru(bpy)32+辅酶,构筑的光酶催化体系在氧化还原中性的条件在氨基酸和乙烯吡啶之间进行偶联,这种光酶催化反应具有高产率和优异的立体选择性。而且,通过不同立体结构的酶,得到不同立体结构产物。
反应机理研究发现Ru(bpy)32+结合在蛋白的骨架上,这有助于自由基在酶催化位点形成。这项工作拓展了光酶催化反应的不对称催化反应类型,提供一种光酶催化产生自由基的新方法。
解决的关键问题和技术
通过酶催化的立体选择性与光催化结合,实现控制自由基中间体的立体反应选择性。将Ru(bpy)32+光敏分子引入酶,构筑新型光酶催化反应。
背景
使用酶催化探索新型反应
酶催化是一种非常独特的选择性催化方法学,酶催化用于催化生命的基本反应。通过多种多样的突变技术能够改变多肽骨架结构,因此通常酶催化通常对多肽骨架进行优化。但是,与蛋白结合的辅酶通常用于在催化反应中构成化学键。
黄素蛋白辅酶
当探索自然酶催化非自然反应的催化反应,辅酶的催化反应能力是驱动研究的主要动力。人们知道黄素蛋白是多功能的辅酶,不同氧化态的黄素蛋白能够表现不同的反应机理。在过去的6年间,人们发现黄素氢醌(FMNhq, flavin hydroquinone)和黄素半醌(FMNsq,flavin semiquinone)在基态和激发态都能够引发单电子自由基还原反应。
天然酶催化自由基反应的局限
由于较高的电极电势的还原比较困难,因此通常酶催化剂无法兼容比较高的还原电极电势。此外,由于自由基是受到酶可控制电荷转移,因此电荷转移是局域性的,而且酶在催化含有自由基的反应中通常避免生成反应性的自由基物种,因为反应活性自由基物种溶剂损坏蛋白的结构。
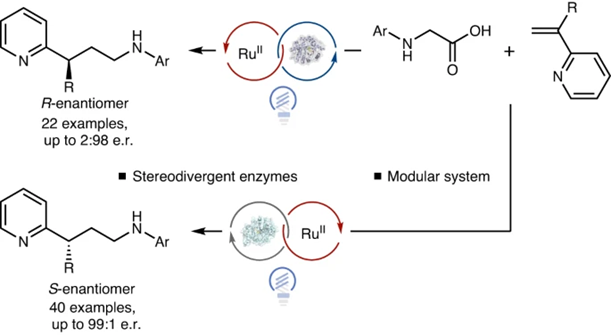
图1.光酶协同催化体系机制
设计光催化-酶催化体系

图2.反应体系设计
我们发展了在蛋白酶催化位点进行控制生成氧化自由基的方法。通过引入Ru(bpy)32+作为辅酶,氨基酸底物发生脱羧反应后,与烯烃吡啶进行烷基化反应,能够得到92 %的产率和高达99:1的立体选择性。
要点1. 反应条件优化
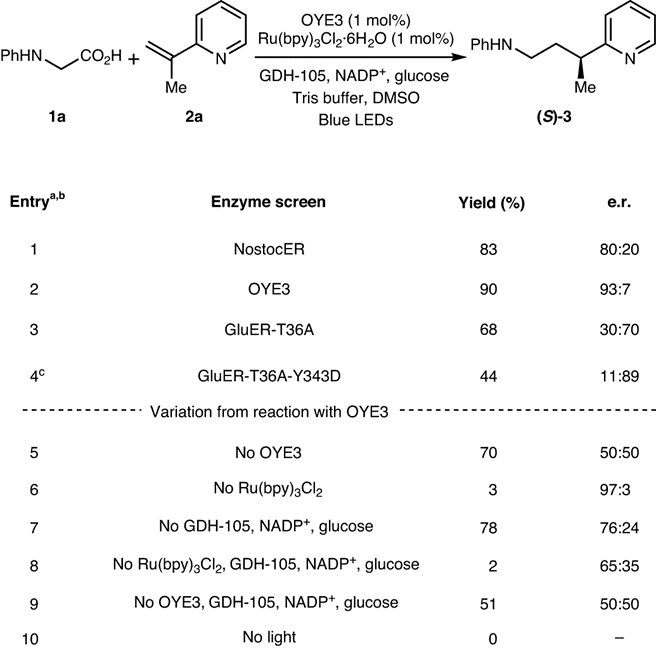
图3.反应优化
以N-苯基甘氨酸(1a)和烯烃吡啶(2a)作为反应物在氧化还原中性环境进行脱羧偶联。在之前的工作中,作者发现ERED与Ru(bpy)3Cl2结合能够将烯烃吡啶不对称还原。因此当将该体系用于本文发展的反应,发现目标产物的产率达到83 %,而且立体选择性达到80:20。因此,测试了多种同源ERED,发现OYE3在光酶催化反应中实现90 %的产率和S构型产物93:7 er立体选择性。此外,筛选ERED过程中发现GluER-T36A能够以70:30 e.r.选择性生成R型立体结构产物。随后对其他变体进行考察,发现GluER-T36A-Y343D实现了更高的立体选择性(89:11 e.r.),同时产率为44 %。
要点2. 机理研究

图4.机理研究
作者通过实验和理论计算研究体系能够实现立体选择性的机理。首先假设ERED通过质子耦合电子转移方式将底物分子氧化。但是实验结果发现并非如此,因为蛋白结构的存在并没有导致氧化脱羧反应步骤的速率加快。而且我们发现蛋白是否存在未对脱羧反应的速率产生影响,说明蛋白没有加快羧酸氧化反应的速率,并且通过Stern-Volmer淬灭实验验证蛋白结构未曾提高脱羧氧化反应的速率。
随后作者通过实验判断C-C自由基偶联反应是否在溶液中发生。通过DFT理论计算,发现自由基二聚反应释放的C-C能量为35.4 kcal mol-1,然而产物中C-C键的能量为80 kcal mol-1,这说明脱羧产生的自由基不能在溶液中稳定存。
作者还考察自由基在蛋白的活性位点生成的可能性。通过荧光淬灭反应进行验证,时间分辨荧光淬灭实验结果显示OYE3耦合的Ru(bpy)32+淬灭过程为静态淬灭机理,酶和Ru(bpy)32+之间具有非常强的耦合作用,从而说明自由基是在蛋白附近形成的。
基于以上验证实验,提出可信度较高的反应机理。首先光激发Ru(bpy)32+将ERED从FMNox还原为FMNhq。随后N-苯基甘氨酸和烯烃吡啶结合在蛋白的催化活性位点。Ru(bpy)32+的激发态将氨基酸的羧酸氧化生成α-氨基自由基,同时[Ru(bpy)32+]*还原为Ru(bpy)31+。生成的α-氨基自由基与烯烃吡啶偶联生成苄基自由基。当使用含有环丙烷官能团的烯烃吡啶反应生成环丙烷开环的产物,说明生成C-C化学键的过程是自由基机理。当使用α-三氟甲基苯乙烯进行反应,发现脱氟产物产量仅有1 %,说明通过氢原子转移方式实现自由基终止反应。
要点3. 底物拓展
作者考察该反应的兼容情况。吡啶官能团的邻位、间位、对位含有取代基的烯烃吡啶能够以较好的产率和立体选择性进行反应(3, 7-17)。除了2-吡啶,该体系也兼容嘧啶(18)、吡嗪(19, 20)、噻唑(25, 26)、3-吡啶(21)、4-吡啶(22),而且产率和立体选择性较好。
但是OYE3只对α-位点兼容体积较小的官能团,对于体积较大的杂环或者烷基,产物的立体选择性都有所降低。

图5.底物拓展
参考文献及原文链接
Shang-Zheng Sun, Bryce T. Nicholls, David Bain, Tianzhang Qiao, Claire G. Page, Andrew J. Musser & Todd K. Hyster, Enantioselective decarboxylative alkylation using synergistic photoenzymatic catalysis, Nat Catal(2023)
DOI: 10.1038/s41929-023-01065-5
https://www.nature.com/articles/s41929-023-01065-5











