2017年,莱斯大学James M. Tour和Ciceron Ayala-Orozco等人在Nature上报道了使用Feringa型单向旋转分子马达,该马达带有转子和定子,可以被紫外线(UV)或可见光激活,打开细胞膜中的孔隙,导致快速坏死死亡。与单向运动的分子相比,没有钻孔作用的分子在类似洗衣机的运动中翻转或表现出随机旋转,在穿过细胞膜方面效率低下。膜扰动后迅速出现膜起泡和坏死。改变马达的结构在空间上减缓了跨膜的运输,而将肽添加到分子马达中允许将分子靶向特定细胞。这项研究为分子马达在生物工程中的应用提供了新的机会。

虽然紫外线和可见光只能穿透人体组织(皮肤、肌肉和脂肪)数百 μm至 1 mm,但650-900 纳米的近红外 (NIR) 窗口(也称为光学治疗窗口)非常适合在体内应用中,由于血红蛋白和水的光吸收极小,加上对人体组织的大量渗透,达到约 10 cm。先前已利用 Feringa 型马达的双光子近红外激活来诱导快速细胞坏死,但该技术需要大量激光产生的光子通量,因此穿透深度很浅,约 0.5 mm,覆盖面积仅限于较小规模的领域,对于广泛的临床转化来说不切实际。在这种方法中,需要两个 710 nm 的光子同时撞击分子,并通过虚态结合成 355 nm 的能量,这是一个低概率且效率低的过程,然后激活 Feringa 型电机的旋转。尽管人们付出了巨大的努力来将分子马达的旋转频率调整到更高的波长,但可以在近红外频率下旋转的分子马达尚未见报道。
鉴于此,莱斯大学James M. Tour和Ciceron Ayala-Orozco等人在Nature Chemistry上报道了利用单光子近红外光诱导的一种对细胞的分子机械作用。研究人员发现,当研究人员激活细胞膜相关分子的振动模式时,它会导致整个分子在亚皮秒时间尺度上一致振动,从而诱导细胞快速死亡。细胞相关分子手提钻 (molecular jackhammers, MJH) 表现出这种协调一致的全分子振动驱动作用 (VDA),其机械作用不同于基于 Feringa 和 Dube 设计的紫外-可见光激活单向旋转分子钻。

在典型的光子分子吸收中,分子的单个键或一小部分振动或许多键以不协调的方式振动。然而,还有另一种激发分子的方法,其中实现了整个分子振动或集体振动,其范围更长且一致,传播到分子的整个长度或宽度。当振动模式和电子模式(有时分别称为声子和等离激元模式)耦合时,这两种模式一起导致振动耦合,或者可以称为分子等离激元-声子耦合。在合适的分子结构中分子等离子体激元初始激发后,由于电子与原子核的相互作用,集体电子振荡在飞秒时间尺度内迅速衰减。这导致电子-声子阻尼过程引起原子核同时集体振荡,即集体振动,通常在亚皮秒时间尺度内。这是通过振动弛豫内部转换过程中的非辐射衰变发生的。总之,通过吸收适当能量的光,分子的集体电子激发与分子的振动模式混合以诱导电子振动模式。振动模式类似于分子的超快呼吸模式,其中整个分子在其长度和宽度上一致振动,因为可能分别发生纵向或横向集体振动。
研究人员表明,当合适的振动模式支持的分子与细胞膜结合时,它可以以任何部分分子振动或紊乱振动都无法引起的方式和速率迅速损害细胞膜的完整性。通过光热疗法加热分子可以引起分子中的许多振动,但这些振动是不协调的,因此没有足以快速打开细胞膜的一致的纵向或横向振动。因此,光热疗法需要高功率和延长时间来减缓细胞凋亡。相反,细胞相关分子的 VDA 即使在非常低的能量下也会导致快速坏死。研究人员利用这些经典结构的 VDA 杀死细胞的速度比光热或光动力疗法快 10-50 倍,浓度比通常使用的低 10 倍,功率比通常使用的低 10-50 倍(80 mW cm−2 而非 1–4 W cm−2)。
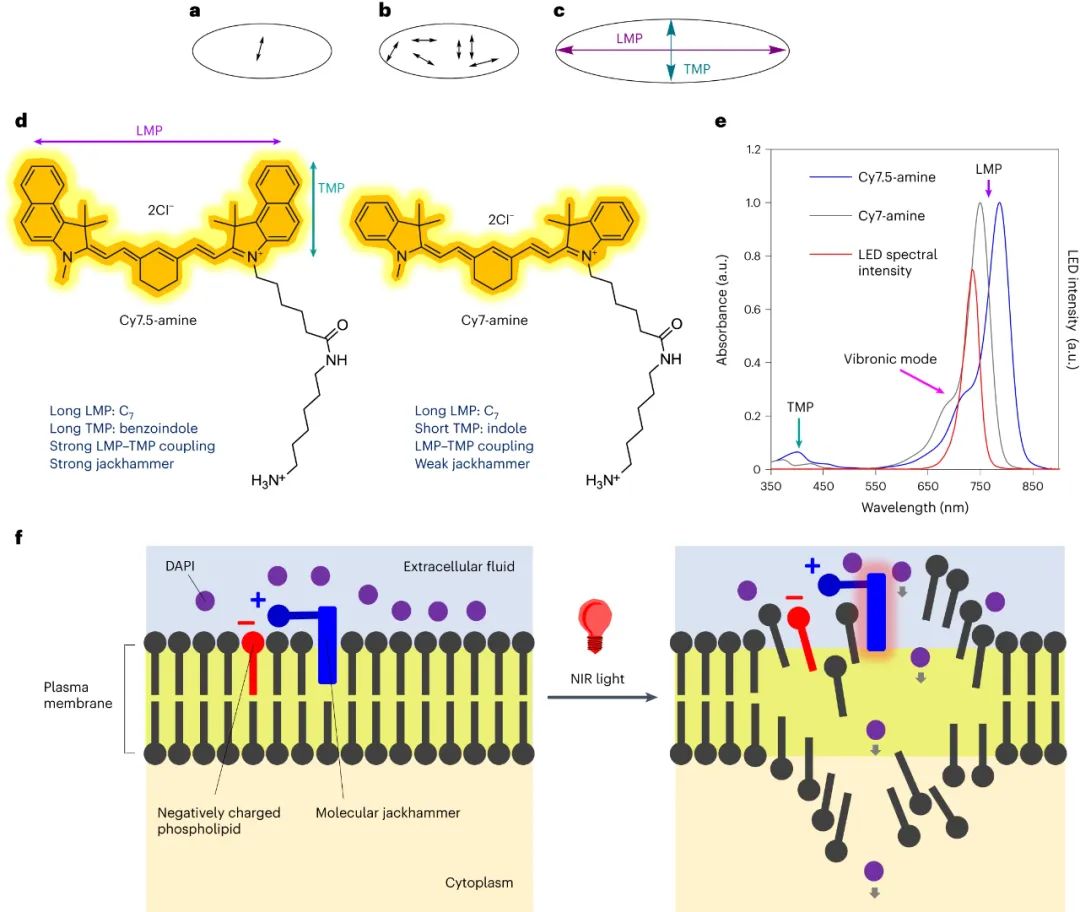
图|MJH的概念及其工作机制
氨基花青的振动激发
花青结构以奇数多烯连接基连接含氮杂环为特征,表现出独特的光物理性质。吸收光谱显示可见光近红外光谱中的主带具有较高能量的肩峰。与 Cy7-胺相比,Cy7.5-胺具有额外的芳环,导致吸收红移约 40 nm。高能肩归因于分子等离子体激元与近对称花青中主要集体振动激发的耦合。时间相关密度泛函理论 (TD-DFT) 证实了花青中的纵向和横向分子等离子体。Cy7.5-胺在 730 nm 处的吸收光谱对应于具有分子等离子体典型的电荷密度共振的强电子振动模式。TD-DFT 计算准确地描述了较长波长,但高估了较短波长的贡献。通过 TD-DFT 确定的 1,310 cm−1振动频率。这些亚皮秒级的集体整体分子振动是太赫兹时间尺度(41 THz)的振荡,即比Feringa型马达引起的兆赫兹(2–3 MHz)旋转快七个数量级。
区分机械作用与光热和光动力效应
使用波长为730 nm的近红外光LED,有选择性地激发了细胞膜结合的Cy7.5-胺中的振动模式,导致A375黑色素瘤细胞膜通透性增加。与Cy7-胺不同,730 nm光能激活Cy7.5-胺,导致细胞立即发生通透。该实验中,对含有2 × 105个细胞的细胞悬浮液进行1 μM Cy7.5-amine和730 nm LED照射10 min,导致99.6%的A375细胞通透化。Cy7-胺在相同条件下无法使细胞通透。这表明730 nm的光可以激发Cy7.5-胺的振动模式,导致细胞膜通透化和细胞坏死。Cy7-胺虽然在水中的消光系数更高,但在相同浓度下不能使细胞通透。这结果排除了光热效应的可能性,并表明光动力疗法也不太可能是原因。
还研究了食品和药物管理局批准的带有烷基磺酸盐添加剂的吲哚菁绿 (ICG)。ICG 在 730 nm 处具有振动吸收肩,并且磺酸盐不会与脂质双层中的磷脂相互作用。在测试 Cy7.5-胺的相同条件下,ICG 并未对细胞进行透化。这表明 Cy7.5-胺的有效细胞杀伤作用是胺悬垂物对快速细胞缔合和随后的 VDA 的协同作用。这可能导致能量从这些全分子激发结构转移到细胞膜,最终破坏脂质双层,使细胞膜透化。
机械破坏细胞膜的机制
通过对巨大单层囊泡(GUVs)中脂质双层的机械破坏,研究人员研究了MJH的作用机制。机制步骤包括:
(1)MJH Cy5.5-胺结合到脂质双层,
(2)激活的VDA解离与MJH紧密接触的磷脂区域,产生空位或孔洞,
(3)剩余的磷脂通过疏水尾部的相互作用重新组织,填补空位,使GUVs缩小,
(4)激活的VDA持续产生孔洞,直到GUVs在某一点破裂(约30 s)。
与ROS的光动力疗法效应不同,研究人员观察到GUVs的收缩而非脂质双层的扩张。相比之下,较弱的MJH Cy5-胺在2 µM时不能产生足够的VDA来解离GUVs。这与A375细胞的结果一致,提示MJH通过VDA产生的机械作用破坏脂质双层。
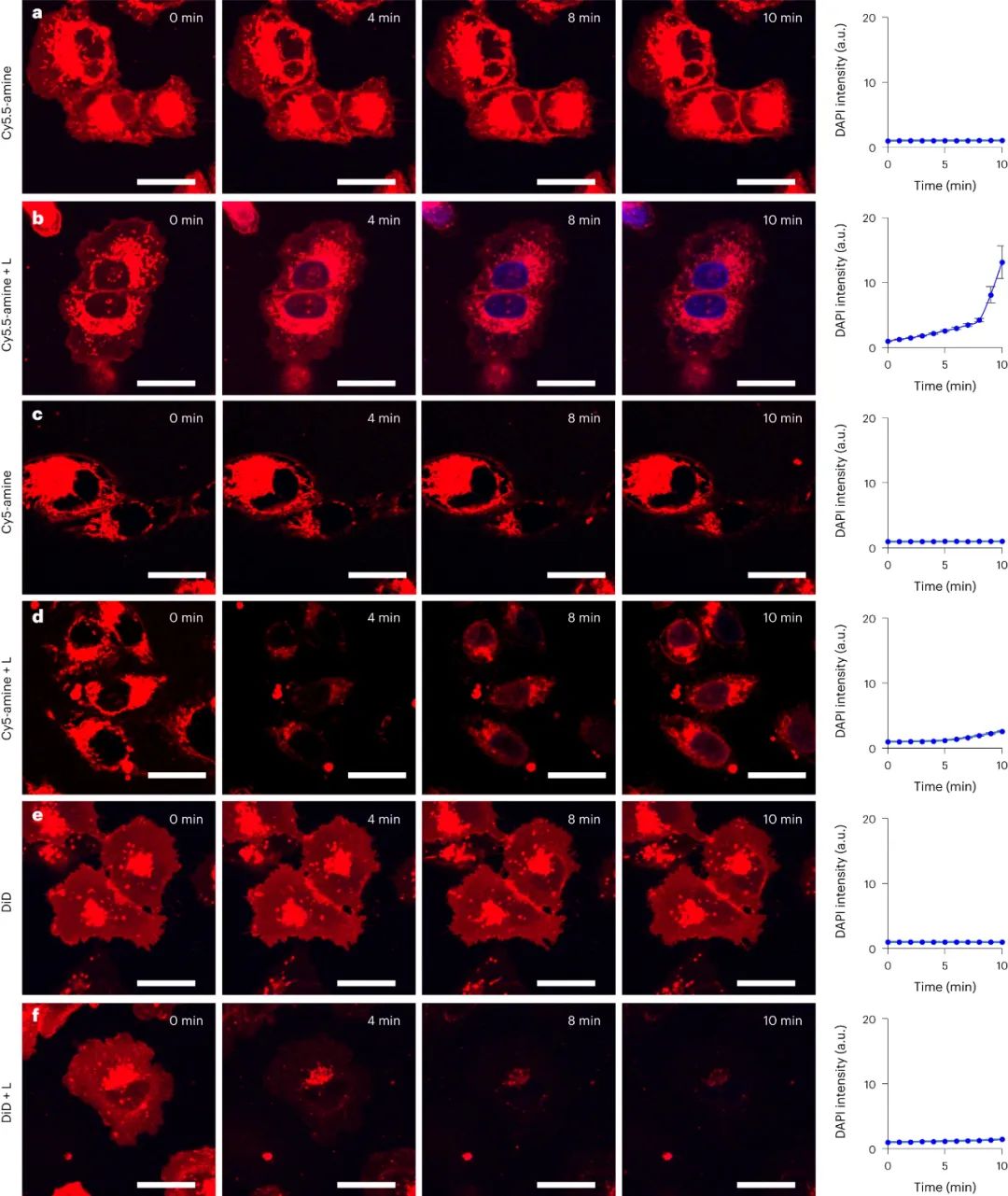
图|A375细胞随时间的细胞膜透性
MJH介导的体内抗肿瘤活性
最后,研究人员使用Cy7.5-amine治疗小鼠黑色素瘤(B16-F10和A375)显示了显著的治疗效果。在B16-F10瘤内,Cy7.5-胺结合730 nm光(150 mW cm−1,5分钟)使肿瘤温度上升约5 °C,显著减小了B16-F10瘤的大小。在A375无黑色素瘤的裸鼠模型中,采用300 mW cm−2的730 nm光照射5分钟,结合肿瘤内注射8 μg Cy7.5-amine,可在7个月时实现50%的存活率,其中20%的裸鼠单独使用Cy7.5-胺亦无肿瘤。这表明Cy7.5-胺在不激活时也能通过缓慢的细胞毒性机制(可能是凋亡)发挥治疗作用。
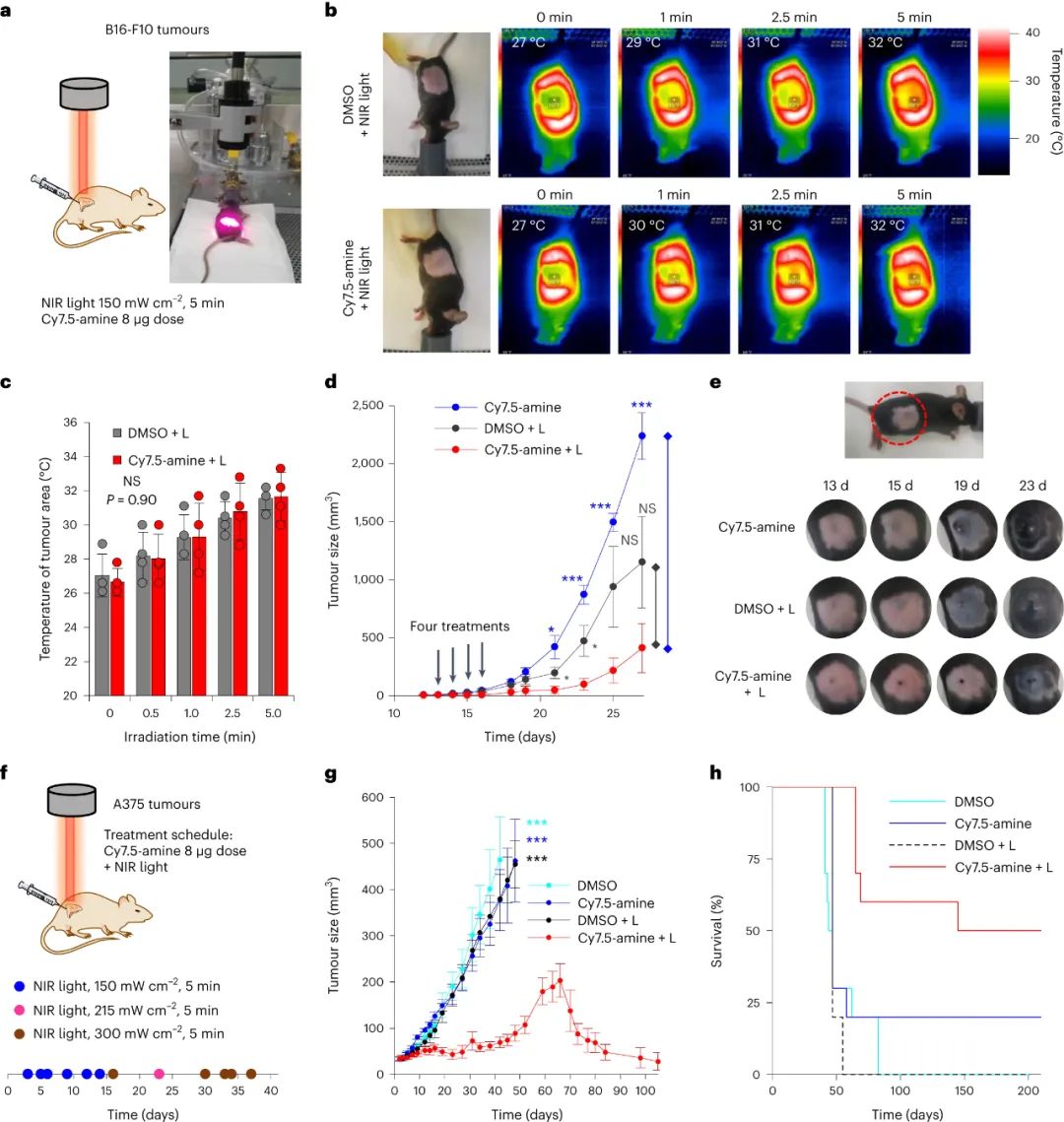
图|MJH Cy7.5-胺治疗小鼠肿瘤的疗效
小结:
低浓度 MJH 中的 VDA 是一种使用低强度NIR 光(12 J cm−2,80 mW cm−2,持续 2.5 分钟)使癌细胞膜透化并导致高效坏死细胞死亡的有效方法。Cy7.5-胺的 VDA 的半数抑制浓度(IC50) 为 250 nM,非常适合癌症治疗的快速临床转化研究。研究人员在有机小分子中发现了一种易于近红外获取的分子等离子体(振动耦合),该有机小分子具有生物相容性、在水中稳定且对细胞膜的透化具有高度活性。此外,不需要通过电化学方式向这些小分子添加或去除电子来使它们具有电子振动模式活性。因此,这项研究展示了分子尺度上独特的机械作用,可以根除细胞,也可能使用佐剂治疗细胞。该课题组现在正在鉴定和合成其他小分子,这些小分子可以增强细胞结合和 VDA 的这种特征组合。其他应用可能包括酶活性位点的选择性调节、蛋白质通道的调节或具有药理学意义的超分子生物组装体的结构和或功能的调节。
参考文献:
1. Ayala-Orozco, C., Galvez-Aranda, D., Corona, A. et al. Molecular jackhammers eradicate cancer cells by vibronic-driven action. Nat. Chem. (2023).
https://doi.org/10.1038/s41557-023-01383-y
2. García-López, V., Chen, F., Nilewski, L. et al. Molecular machines open cell membranes. Nature 548, 567–572 (2017).
https://doi.org/10.1038/nature23657











