
靶向蛋白降解技术(如PROTAC、LYTAC等)可以利用机体天然降解系统直接降解致病靶蛋白,不仅可以靶向酶,而且还可以靶向无活性位点或者不可成药的蛋白靶标,可针对多靶点进行一网打尽,给疾病治疗带来了巨大希望。然而,成药性差、有效性欠佳、代谢稳定性不良等缺陷和风险严重限制其发展。
为此,华南理工大学张云娇教授、杨显珠教授与广东省人民医院温龙平教授合作,提出了基于多功能仿生纳米受体的NanoTAC技术,并在基于NanoTAC技术靶向降解突变p53的肿瘤精准治疗方面取得新进展。相关研究内容以“模拟选择性自噬受体的纳米受体用于靶向降解突变p53蛋白(Nanoreceptors promote mutant p53 protein degradation by mimicking selective autophagy receptors)”为题于2024年1月12日在《自然·纳米技术》(Nature Nanotechnology)上发表,论文的共同第一作者是华南理工大学博士后黄晓婉、钱洁颖和广州市第一人民医院(华南理工大学附属第二医院)的曹紫洋副研究员,论文链接:https://www.nature.com/articles/s41565-023-01562-5。
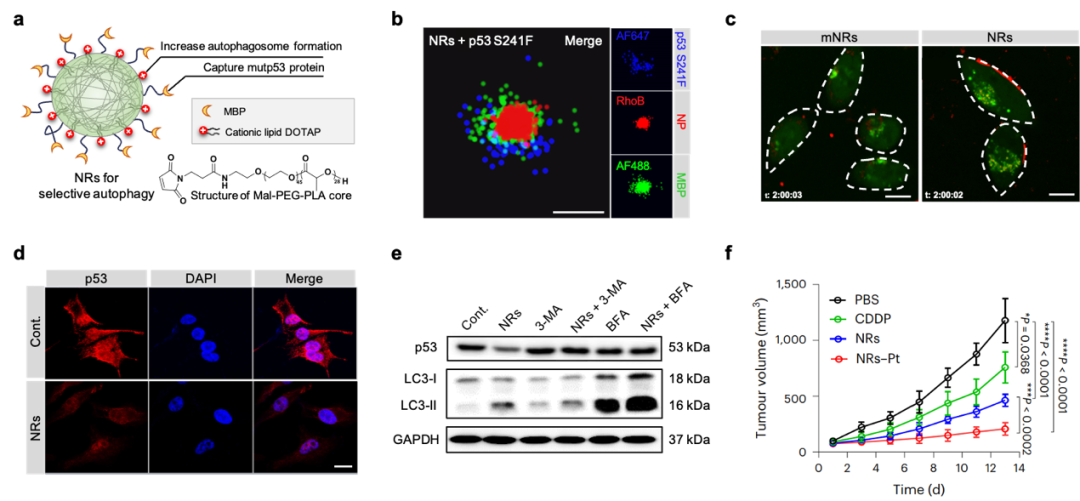
图 模拟选择性自噬受体的纳米受体靶向降解突变p53蛋白用于肿瘤精准治疗
1)通过马来酰亚胺-聚乙二醇-聚乳酸(Mal–PEG–PLA)与1,2-二醇基-3-三甲基铵-丙烷(DOTAP)通过自组装形成纳米颗粒,再共价修饰突变p53结合肽(MBP),构建仿生模拟选择性自噬受体的工程化Nanoreceptors(NRs)纳米受体颗粒。其中阳离子脂质DOTAP可诱导自噬体形成增加来提高自噬水平,并有效靶向自噬体、将NRs结合的突变p53蛋白带入自噬途径进行降解。
2)NRs对突变蛋白的结合和降解极具选择性,可以结合多种不同类型的突变p53蛋白,而不结合抑癌的野生型p53蛋白及p53家族同系物p63蛋白。这种高选择性避免了非特异性降解造成的安全性隐患,体现了NRs的广阔临床应用前景。
3)NRs降解肿瘤细胞中的突变p53后,解除了突变p53的获得性功能,包括抑制细胞增殖、迁移以及耐药等,从而诱导癌细胞的死亡。
4)NRs在ES-2(p53 S241F)卵巢癌模型和人源肿瘤异种移植PDX(p53 P72R+/+、C141Y+/+和L350P+/-)卵巢癌模型中具有优异的抗肿瘤疗效,进一步证明了NRs的潜在临床应用价值。

张云娇教授,华南理工大学博士生导师,国家优秀青年基金、广东省杰出青年、中科院优博获得者。团队一直从事调控蛋白质稳态的药物开发、工程化纳米材料在肿瘤等重大疾病诊疗、生物医用材料的药物输运等研究,在Nature Materials、Nature Communications、Account of Chemical Research、Advanced Materials、Advanced Functional Materials等国际重要学术期刊发表SCI 论文50余篇。授权中国发明专利15项、授权美国发明专利1项。主持国家自然科学基金优秀青年项目、面上项目,广东省杰出青年项目、广东省重点研发子课题及广东省卓越青年团队项目等10余项。担任Exploration杂志青年编委、Smart Mater in Med杂志客座编辑。担任中国生物物理学会纳米生物学分会青年委员、广东省精准医学应用学会分子影像分会常务委员。
课题组网站:https://www2.scut.edu.cn/nanolab/











