
人物介绍
弗朗西丝·阿诺德是一位才华横溢的美国化学家和工程师,她是加州理工学院的化学工程、生物工程著名教授,也是2018年诺贝尔化学奖得主,以她在定向进化方面的开创性工作而闻名。她的科学信念和责任感激发了无数后辈科学家,并在她的职业生涯中留下了深刻的印记。Frances H. Arnold教授。图片来源:Arnold教授课题组阿诺德教授一直将科学看作一项使命,她希望通过自己的研究为人类社会做出实质性的贡献。她不仅关注自己领域内的科研进展,还对其他领域的优秀研究给予高度评价和支持。她鼓励年轻的科学家们积极参与解决全球性挑战,相信每个人都可以为这个世界做出有意义的贡献。从左至右:Frances H. Arnold教授、George P. Smith教授和Gregory P. Winter爵士。图片来源于网络出生于宾夕法尼亚州匹兹堡市的阿诺德从小展现出强烈的独立性和好奇心。她的职业生涯始于加州理工学院,她在那里进行了深入的研究,致力于改进酶的功能,通过借鉴自然选择的原理,使其性能得到显著提升。她的成果不仅在学术界引起轰动,还为生产生物燃料、药物等提供了新的可能性。正如阿诺德(Frances Arnold)在加州理工学院的一份新闻稿中说:"我们决定让自然去做只有化学家才能做到的事情,而且做得更好。"为此,弗朗西丝·阿诺德团队和陶氏有机硅公司的Dimitris E. Katsoulis合作,研发了一种细胞色素P450酶,该研究证明了生物学可以比传统化学家更环保的方式形成这些键。使用了定向进化来创建这种新的硅碳键断裂酶。这一研究成果发表在《科学》杂志的1月26日的期刊上。接下来我们一起来了解一下这项解决世界难题的文章。
研究背景
随着现代化工技术的不断发展,人类生产出大量的挥发性硅氧烷(VMS),这些化合物在消费品行业中具有广泛的应用,从洗涤剂和消泡剂到洗发水、护发素等。然而,尽管这些化合物的功能性和实用性得到了充分肯定,但其对环境的潜在影响引发了人们的担忧。VMS被认为是不可生物降解的化学物质,其在环境中的长期存在和生物累积可能带来潜在的生态风险。在这种背景下,科学家们开始关注硅氧烷Si-C键的降解问题。由于其高热稳定性和缺乏功能性基团,传统的化学手段在处理VMS的Si-C键裂解上受到了限制,仅有少数几种方法可以实现,包括TiO2光催化、热解和大气中的羟基自由基氧化。在高等生物体内的研究表明,VMS经过代谢会产生多种产物,包括Si-C键断裂的代谢产物,这被认为是在C-H羟基化事件之后发生的。尽管如此,迄今为止尚未发现任何一种酶能够羟基化硅氧烷的C-H键,也没有发现能够促进Si-C键断裂的酶。 鉴于此, Frances H. Arnold提出科学假说。假设细菌色素P450可能具有将硅氧烷的C-H键氧化的能力,从而为Si-C键的断裂提供可能。通过对一系列细菌色素P450BM3变体进行评估,他们发现了一种具有促进硅氧烷Si-C键断裂活性的变体,命名为LSilOx1(线性硅氧烷氧化酶,第1代)。随后,通过定向进化,团队进一步提高了这种酶的Si-C键断裂活性,并拓展了其对不同硅氧烷底物的适用范围,包括线性硅氧烷和环状硅氧烷(见图2)。最终,团队发现了一种具有Si-C键断裂活性的酶,其具有潜力在温和条件下裂解硅氧烷的Si-C键,这是以往的化学催化剂无法实现的活性,并且也是酶在非自然底物上首次展现出的活性。相关论文近日以题为“Directed evolution of enzymatic silicon-carbon bond cleavage in siloxanes”发表在Science上,引起了不小的关注。
研究内容
为解决这一问题,研究人员首次合成了一种能够在生物体内形成硅碳键的方法。通过将硅和碳元素引入生物体内,科学家们成功地诱导了生物体合成硅碳键,实现了硅碳键在自然界的合成。为了验证这一合成的有效性,研究人员使用了一系列表征手段和测试方法,包括高分辨质谱分析、核磁共振技术等。通过这些实验结果,科学家们证实了硅碳键的形成,为探索新型材料和化学合成提供了全新的思路和方法。如图1所示,研究人员展示了在生物体内合成硅碳键的过程。首先,硅和碳元素被引入生物体内,随后经过一系列化学反应,生物体内的特定分子结构发生改变,形成了硅碳键。通过实验验证,研究人员成功地观察到了生物体内硅碳键的形成过程,并使用高分辨质谱分析、核磁共振技术等表征手段对其进行了验证和确认。这一发现为生物合成领域带来了新的可能性和机遇,为探索新型材料和化学合成提供了新的思路和方法。
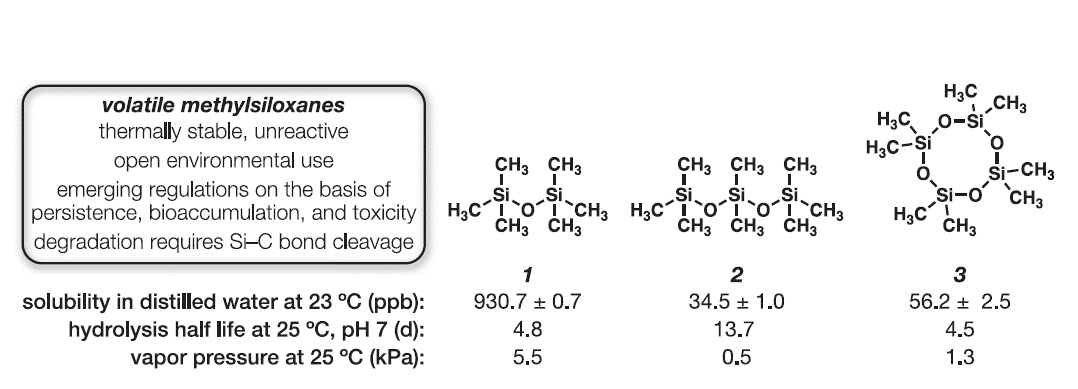
图1. 选定挥发性硅氧烷的理化性质和结构。ppb,十亿分之一;d,天。图2展示了研究人员在生物体内合成硅碳键的具体步骤和过程。分别展示了在实验中使用的不同硅氧烷衍生物,包括六甲基二硅氧烷(1)、八甲基三硅氧烷(2)和八甲基四硅氧烷(3)。通过在大肠杆菌溶液中进行的定向进化实验,研究人员获得了一系列新的酶变体,这些变体在催化硅碳键的裂解过程中展现出了不同的活性和特性。图中详细描述了在不同硅氧烷衍生物上进行的定向进化实验,以及随着进化过程中发生的酶变体的逐渐积累的氨基酸替换情况,为生物体内硅碳键裂解的机理和新型酶催化反应提供了重要的实验依据和理论基础。
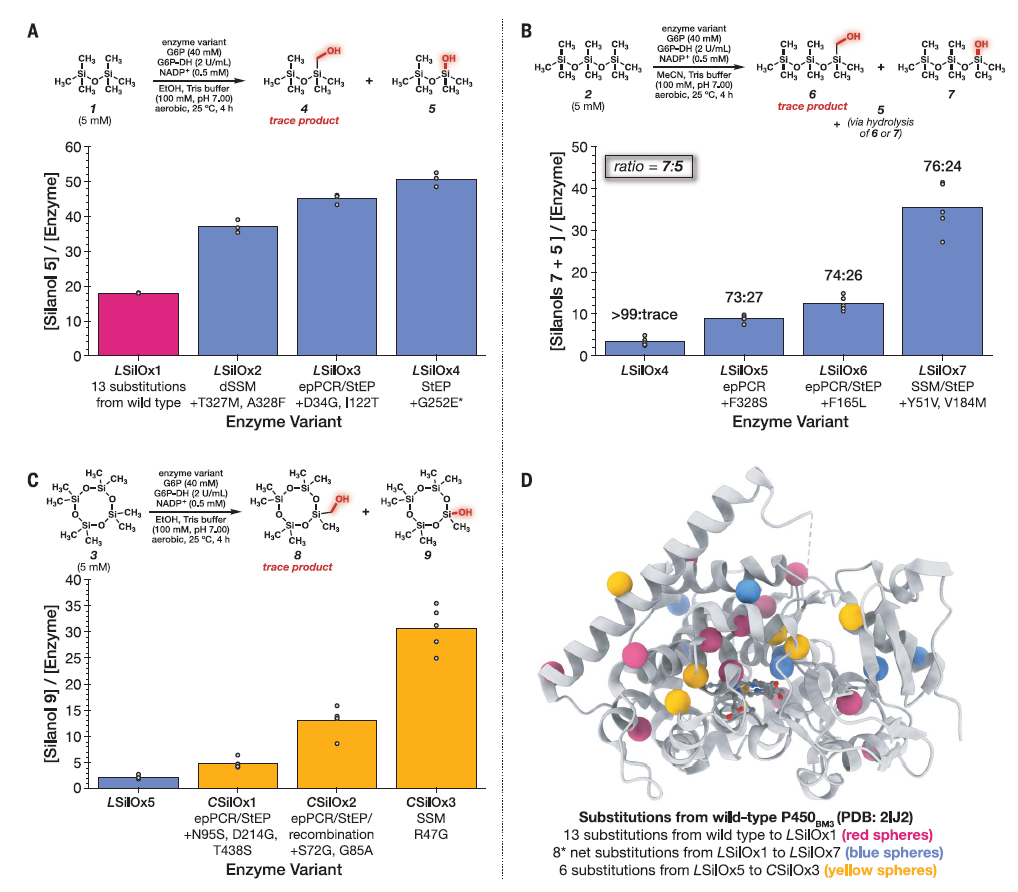
图2. 在大肠杆菌裂解液中使用六甲基二硅氧烷(1)、八甲基三硅氧烷(2)和八甲基环四硅氧烷(3)进行定向进化。图3展示了对酶催化硅碳键断裂机制进行的调查。首先,在图3A中,显示了Si-C键断裂活性与NADPH浓度之间的关系,结果表明Si-C键断裂活性依赖于NADPH的浓度。在图3B中,LSilOx4DFAD变体中FAD结构域的截断导致从羟甘醇4的Si-C键裂解活性下降了2.6倍,这进一步验证了催化氧化对Si-C键断裂的重要性。图3C通过使用ABTS甲醇试验和purpald甲醛试验进行了反应分析,结果显示甲醛作为酶反应的副产物生成。通过对照反应使用甲醇或甲醛作为底物,而不是硅氧烷1或羟甘醇4,证实了Si-C键裂解活性的产物为甲醛。最后,在图3D中,展示了以硅氧烷1或羟甘醇4作为底物的酶反应时间过程。这些结果共同揭示了硅碳键断裂的酶催化机制,为理解生物体内硅碳键降解的机理提供了重要的实验支持和指导。
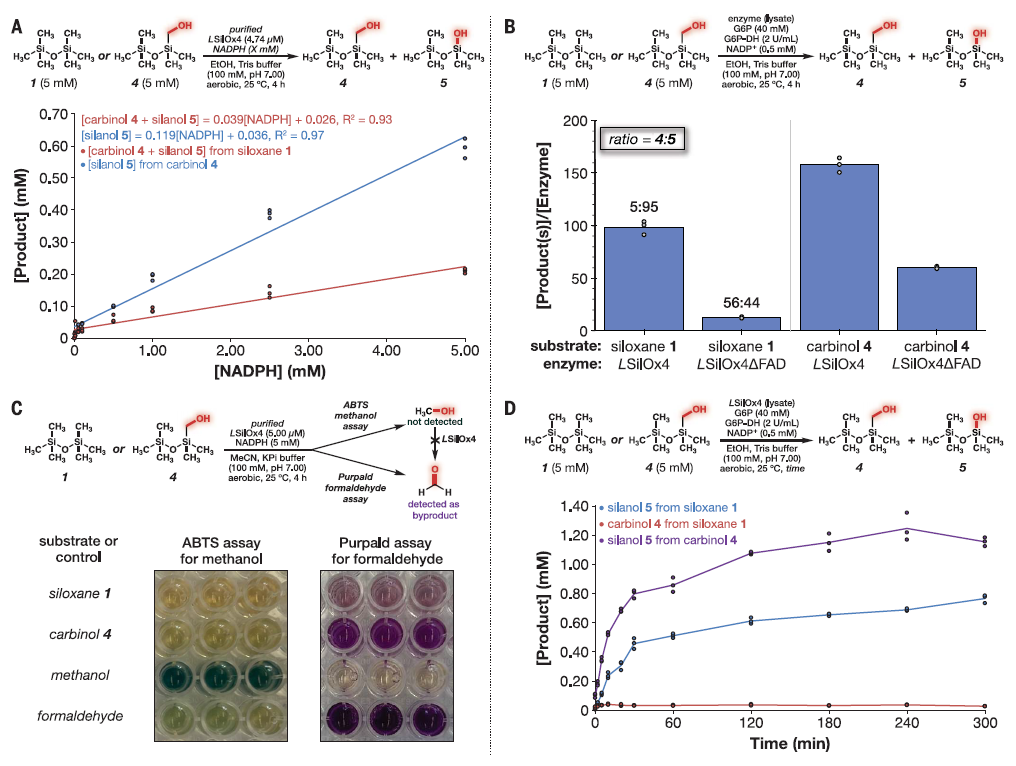
图3. 酶催化Si-C键裂解的机制研究。
图4展示了硅氧烷甲基团在生物体内经历串联双酶氧化过程,最终导致硅碳键的裂解。该图描述了在与羟甘醇4进行酶反应的过程中,通过气相色谱-质谱(GC-MS)分析检测到的微量峰,例如在5分钟反应中观察到的情况(图A)。随后,通过Swern氧化羟甘醇4,利用核磁共振(NMR)技术对甲醛硅氧烷10进行原位合成的1H NMR表征(图B)。在图C中,展示了通过用羟甘醇4作为底物进行5分钟反应后所获得的高分辨质谱数据,揭示了酶催化Si-C键裂解的可能机制。这一机制涉及了酶C-H羟基化和羟甘醇氧化,最终形成甲醛硅氧烷10。这些结果为生物体内硅碳键裂解的反应机理提供了重要线索,并为进一步的研究提供了基础和指导。
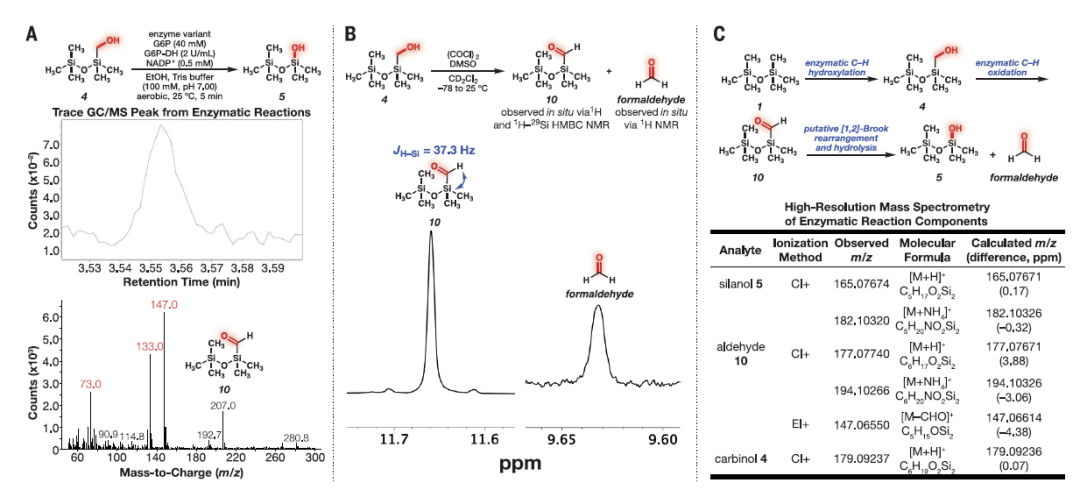
图4. 硅氧烷甲基团的串联双酶氧化导致硅碳键裂解。
展望
本文主要核心在于通过定向进化工程,成功实现了生物催化的硅碳键裂解活性,为挥发性甲基硅氧烷(VMS)的生物降解提供了新的途径。VMS是大规模生产的人工化学物质,广泛用于洗涤剂、防泡剂、护肤品等消费品中。然而,由于其不易降解的特性,引发了对其在环境中的潜在积累、长距离传播和生物富集的担忧。 通过对细菌细胞色素P450BM3的定向进化,研究人员成功改良了其对线性和环状VMS硅碳键的裂解能力。通过催化硅氧烷甲基基团的串联氧化反应,最终实现了硅碳键的裂解。这一发现为VMS的生物降解提供了新的前景,打破了以往对于这类化合物生物不可降解的观念。通过定向进化,研究人员创造性地改造了天然酶的催化性能,为处理这类具有高热稳定性和缺乏功能基团处理手柄的化合物提供了生物降解的可能性。Nicholas S. Sarai et al. ,Directed evolution of enzymatic silicon-carbon bond cleavage in siloxanes.Science383,438-443(2024).DOI:10.1126/science.adi5554.














