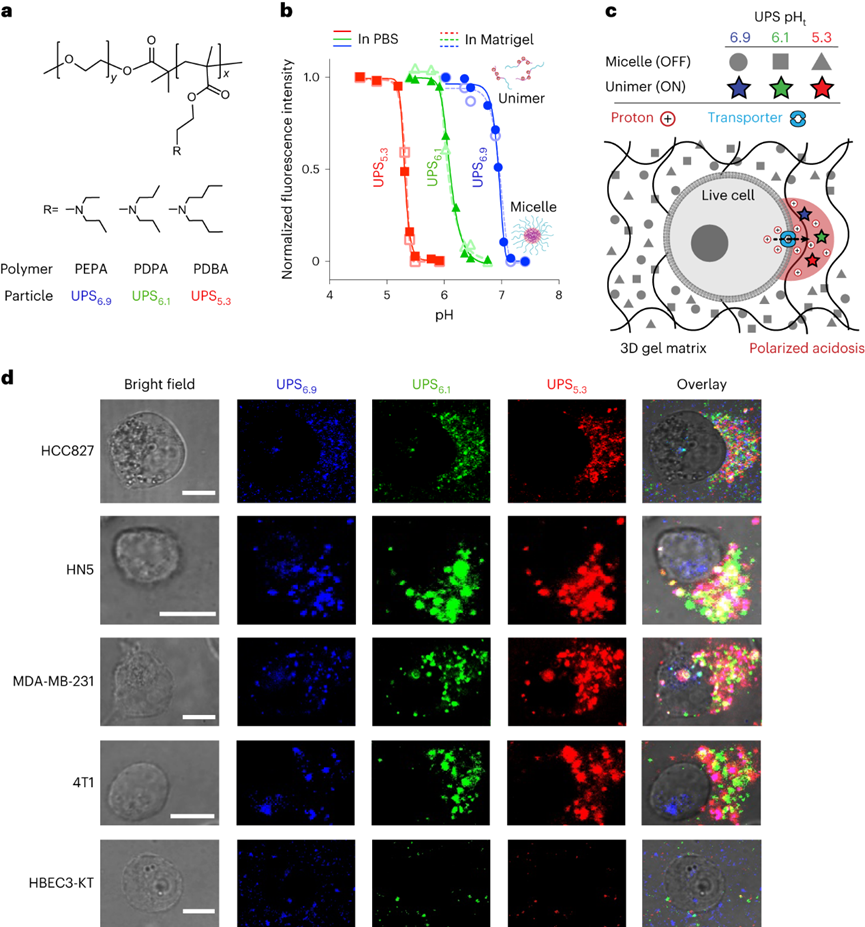
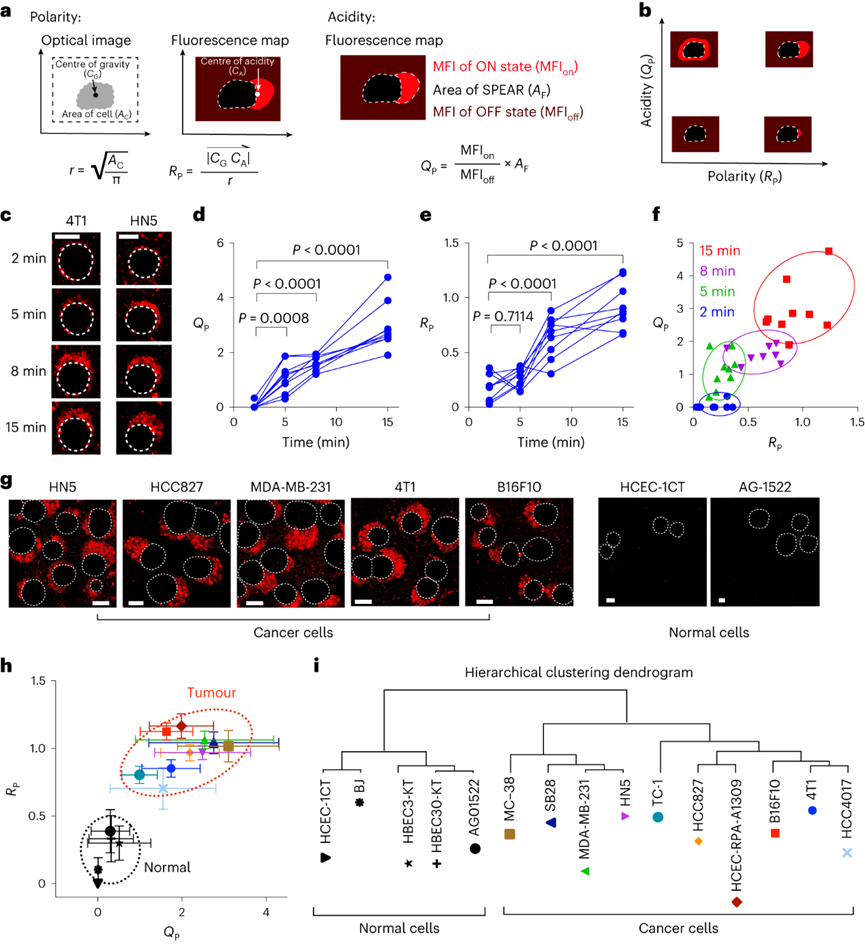
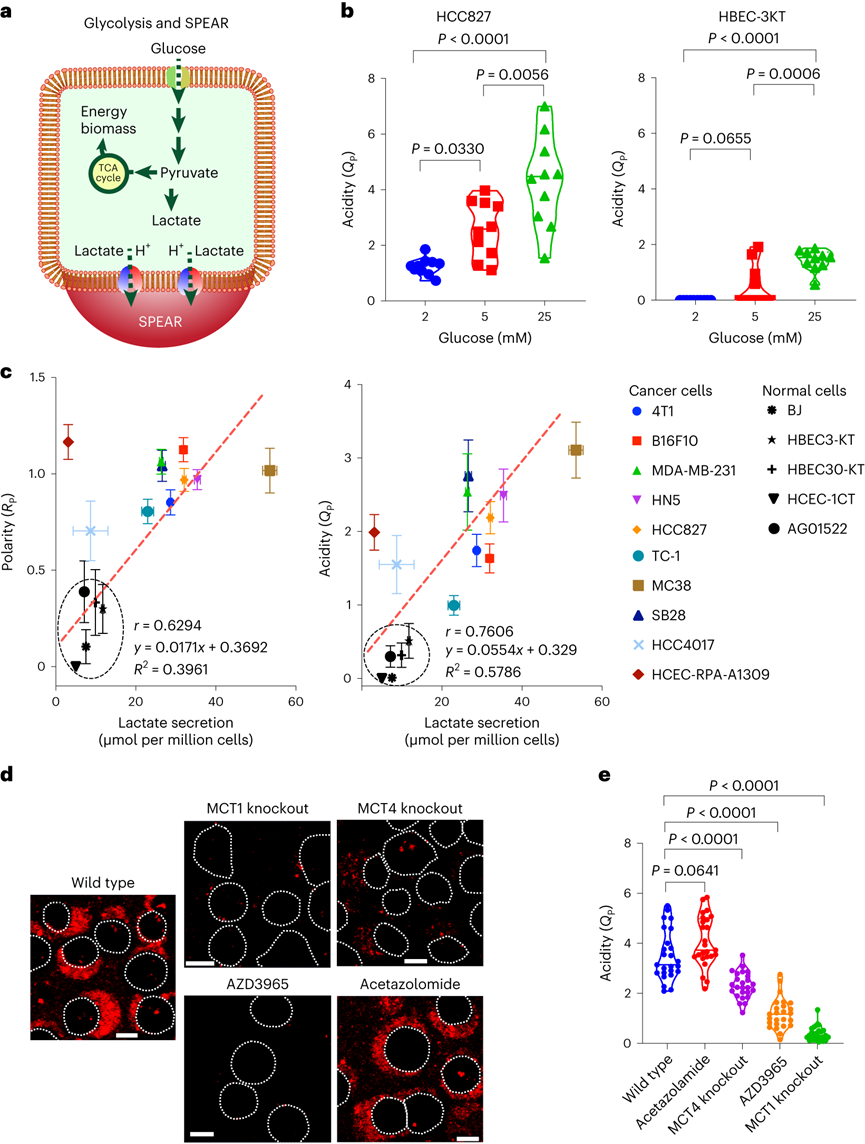
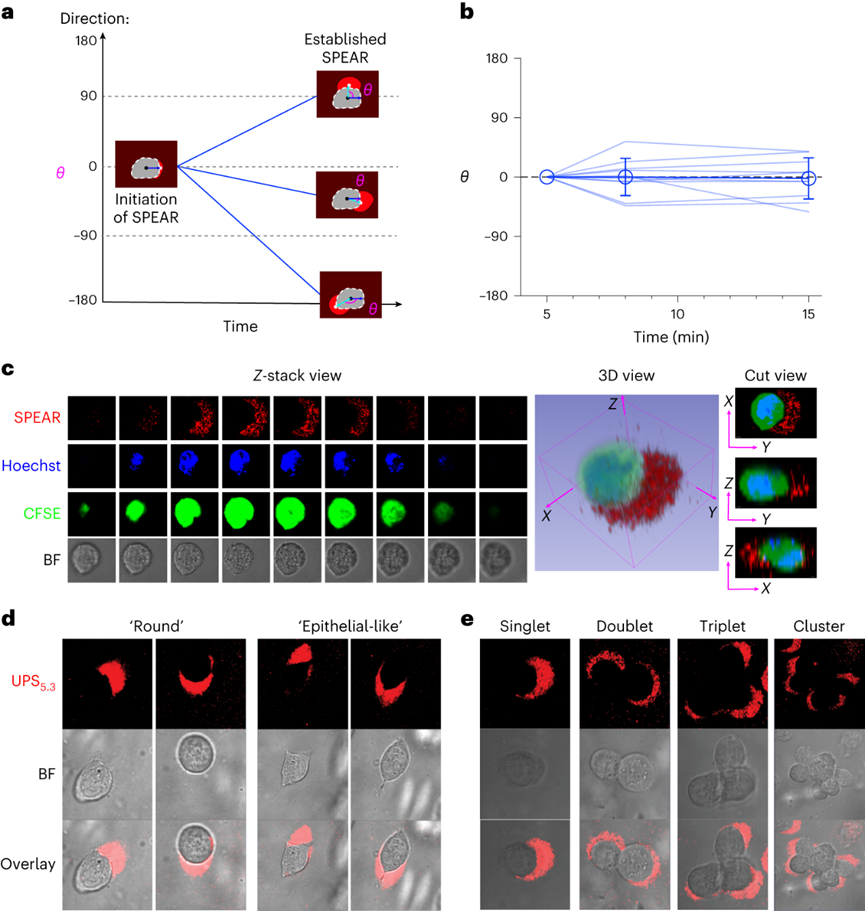
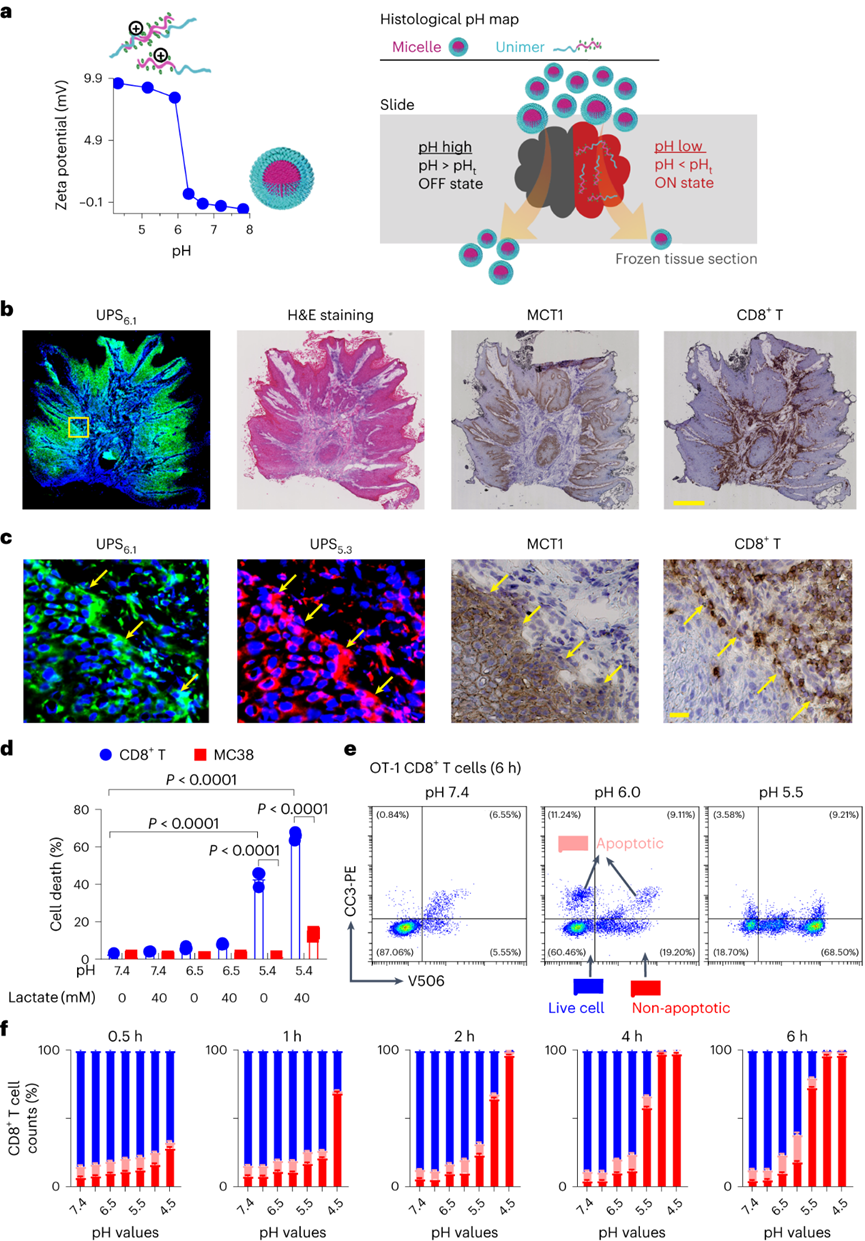
pH值是影响酶活性、细胞代谢和组织稳态的基本生理参数,全身酸碱平衡是呼吸系统和肾脏系统最严格生理调控过程之一。在实体瘤中,癌细胞的高代谢活性和不良的血管灌注是肿瘤微环境中氢离子积累的原因。肿瘤酸度激活金属蛋白酶以增加癌症转移风险,并抑制免疫细胞诱导肿瘤免疫逃避。目前对肿瘤酸性细胞外pH值(pHe)的检测多使用电极检测或小分子pH传感器(例如,3-氨丙基膦酸酯)进行磁共振波谱成像。但电极/磁共振波谱成像方法的局限是缺乏空间分辨率(~10 mm3),这可能低估了细胞或亚细胞酸化区的细胞外酸度。近日,美国德克萨斯大学西南医学中心高金明教授课题组利用其前期开发的超 pH 敏感 (UPS) 纳米探针库,研究了pH 5.3以下肿瘤酸度的细胞起源。UPS具有可调的 pH 通道和荧光激活,以亚细胞空间分辨率的二进制方式输出 pH 信号。UPS 纳米探针中的荧光团在正常生理 pH 值(7.4)下保持猝灭状态。到达肿瘤后,肿瘤酸度会激活低于其pH转换阈值的纳米探针,从而在肿瘤中进行荧光呈现。成像数据显示,来自不同癌细胞组的极化细胞外酸度具有亚细胞分辨率。通过 MCT 分泌的乳酸似乎会导致严重的肿瘤酸中毒,肿瘤微环境的酸性比以前报道的数值要强。作者团队将严重极化的细胞外酸性区域 (SPEAR) 定义为癌细胞的未识别物理靶标,有望在广泛的癌症诊断和治疗应用中进一步开发。当环境pH值降至临界阈值pH值以下时,UPS聚合物会经历从胶束状态到单聚体状态的相变。在中性pH值下,UPS聚合物保持胶束形式,由于Förster共振能量转移(FRET),导致共轭染料的荧光信号猝灭(“OFF”状态)。随着环境质子浓度的增加,UPS胶束抵抗质子化。直到环境pH值低于阈值时,UPS聚合物完全质子化,荧光完全恢复。为了在体外研究单细胞水平的细胞外酸化,作者团队在基质胶中部署了一套具有特定 pH 转换阈值的多色 UPS 纳米探针(UPS6.9、UPS6.1和UPS5.3)。由于每个纳米探针在特定的pH激活下提供二进制开/关pH读数,因此不同荧光基团的空间活化图直接报告了每个癌细胞周围亚细胞区域的酸性pH阈值。在3.5 mM葡萄糖浓度下,共聚焦成像显示,在孵育时间的30分钟内,一组不同癌细胞系的细胞外酸化现象显著。在代表性的HCC827人肺癌细胞中观察到SPEAR的形成,其中所有三个pH阈值传感器的激活都发生在同一区域中,而其他方向则无荧光。SPEAR 区域的pH<5.3,比生理pH值高两个数量级以上。对其他 HN5、MDA-MB-231和 4T1 的检查显示出相似的 SPEAR 现象,表明极化酸化是不同癌细胞类型和物种的普遍现象。永生化支气管上皮细胞(HBEC3-KT)作为正常细胞的非癌症对照没有检测到SPEAR的形成。因此,HCC827细胞表现出比HBEC3-KT细胞更高的细胞外酸化率(ECAR),UPS纳米探针也基于图像描绘了癌细胞质子输出的空间极性。在目前的成像条件下,共聚焦显微镜进行重复激光扫描时出现光漂白效应。UPS5.3-TMR的荧光信号在每次连续扫描时都逐渐降低,无论是在 OFF 还是 ON 状态下。因此必须建立一种定量方法来准确测量 SPEAR 的形成。作者团队引入质子极性比(RP)和质子数量(QP)分别测量细胞外酸化的极性和程度。RP定义为重心和酸度中心之间的距离与细胞平均半径的比值,QP作为归一化的激活纳米探针信号(SPEAR区域中的平均荧光强度(MFI)与非SPEAR区域之比)乘以 SPEAR 的面积(AF)。QP和RP的量化在60次扫描中没有显示出显著差异,强调了UPS5.3-TMR对SPEAR量化的稳定性。研究4T1 癌细胞细胞外酸化的动力学过程,尽管QP和RP在每个时间点的变异性很高,但值会随着时间的推移而增加。 QP–RP图显示了酸化随时间变化的整体对角线轨迹,表明极化酸化主导了质子输出的动力学。为了评估癌细胞与正常细胞中SPEAR现象的普遍性,构建了一个由十种癌细胞系和五种正常细胞系组成的多样化细胞系组。尽管SPEAR具有变异性,但每个检查的癌症细胞系都激活了UPS5.3探针,并在QP–RP图和分级聚类树状图中显示出与正常细胞相比的不同聚类,这表明SPEAR是癌细胞相对正常细胞而言的独特特征。癌细胞糖酵解增强是实体瘤的一个显著特性,下游代谢物中如乳酸(pKa3.8)和碳酸(pKa6.1)是有机酸的主要贡献者。在HCC827癌细胞中,低糖状态下UPS5.3活化提示酸分泌水平低,而高糖状态下QP值(大于 4 倍)和异质性显著增加。在HBEC3-KT细胞中观察到类似的趋势,尽管整体酸化水平低于HCC827癌细胞诱导的水平。在不同的细胞系中,RP和QP与乳酸分泌呈正相关,Pearson相关系数分别为0.63和0.76。但是也观察到几个异常值(如,HCEC-RPA-A1309和MC38),这表明可能存在额外的酸化机制促进SPEAR的形成。然而,癌症细胞的极化细胞外酸化特性与正常细胞明显不同,这在很大程度上是癌症细胞糖酵解活性升高的结果。为了进一步建立乳酸排泄和SPEAR形成之间的因果关系,用MCT转运蛋白的基因敲除的HCC827细胞进行实验。MCT1敲除与AZD3965化合物对MCT1的抑制均消除了纳米探针的激活。MCT4敲除降低了纳米探针的激活,尽管与MCT1敲除相比程度较低。而乙酰唑胺抑制野生型HCC827细胞中碳酸酐酶IX对纳米探针激活的影响不显著。由于MCTs是质子和乳酸阴离子的转运体,探索细胞外乳酸浓度对纳米探针激活的影响。40 mM L-乳酸钠浓度逆转了HCC827细胞中的乳酸转运,这消除了纳米探针的激活。相比之下,40 mM D-乳酸则没有消除效果,这表明L-乳酸的阻断作用来自于中断的乳酸转运,而不是缓冲作用。探索癌细胞SPEAR方向是否一致,或者这种方向是否会随着时间的推移而改变。分析SPEAR的起始与其随后的维持位置之间的角度(θ)。平均角度(θ)接近于零表明癌细胞在图像采集时间(30 分钟)内保持相同的酸分泌轨迹。具有圆形或纺锤形形态的癌细胞无论形状如何,都显示出极化的酸化模式。在分离的单个癌细胞作为单元存在的基质胶中,SPEAR的方向是随机的。然而,当在较高的细胞接种密度下细胞间接触发生时,它会显着影响 SPEAR 的方向。在这种情况下,SPEAR主要将朝向远离细胞-细胞界面和细胞簇的外围。这一结果强调了细胞通过同一区域分泌酸进入细胞外空间,避免与邻近的癌细胞接触。细胞间接触对SPEAR趋向性的调节尚不清楚,需要进一步研究。为了研究肿瘤酸度,喷洒UPS纳米探针(UPS6.1或UPS5.3)到新鲜冷冻和切片的肿瘤载玻片上,并使用荧光共聚焦显微镜对纳米探针激活进行成像。在这项研究中,在手术过程中切除头颈癌患者的肿瘤和邻近的正常组织,并立即包埋并冷冻在最佳切割温度介质中,漂浮在液氮(<10 s)中以避免厌氧糖酵解。H&E染色显示了基于组织形态学和细胞核形态学的肿瘤和基质划分。UPS活化图显示了肿瘤微环境中细胞外酸度的异质模式。在具有代表性的分化良好的鳞状细胞癌病例中,粘膜下基质的酸性低于浸润性肿瘤细胞。肿瘤-基质界面的较高放大倍率突出了基质组织周围栅栏癌细胞的极化肿瘤酸度。并非所有肿瘤区域内的癌细胞都表现出SPEAR,而基质区域中的一些非癌细胞表现出SPEAR,这可能归因于细胞-细胞接触介导的抑制,或肿瘤微环境中的异质营养/氧转运。MCT1的IHC检测显示,在基质-肿瘤界面附近的肿瘤细胞上表达更高。然而,MCT1表达在基质中大多不存在,CD8+毒性T细胞在基质区室内隔离,肿瘤组织中的CD8+ T细胞浸润最小。详细说明严重肿瘤酸度(pHe<5.3) 和 T 细胞排外,研究培养基 pH 值对T 细胞活力的影响。在pH 6.5或更高时,T细胞存活(<5%死亡),与高乳酸浓度无关。相反,在 pH 值为 5.4 时死亡(>40%)显著。在pH 5.4下添加40 mM乳酸进一步将死亡百分比提高到60%以上。相比之下,MC38结直肠癌细胞即使在pH 5.4下仍保持活力。据报道,酸性pH值可诱导CD8+ T细胞凋亡。在 pH 6.0 和 6.5 下,大约 20% 的 CD8+T 细胞在孵育 6 小时后发生凋亡,而在 pH 5.5 及以下时,非凋亡性的细胞死亡 (>60%) 在 4 小时后占主导地位。数据表明,当达到 pH 阈值(例如,低于5.5)时,CD8 T+ 细胞死亡会从凋亡途径转变为非凋亡途径。图 人类头颈部肿瘤样本中的影像学肿瘤酸中毒和T细胞排外作者团队的研究表明,即使在单细胞水平上也存在严重的肿瘤酸化,这表现为一组癌细胞的严重极化细胞外酸性区域(SPEAR)。SPEAR沿着特定的轨迹,质子输出优先发生在一个方向上,这提供了一个高度浓缩的酸度区(pH值e<5.3)比以前估计的要高出一个数量级。尽管对SPEAR进行定量发现在癌细胞中始终观察到高度浓缩的细胞周酸中毒区域,而不是正常细胞则没有。SPEAR的形成与较高的糖酵解率和乳酸分泌率相关,而 MCT 的基因敲除或抑制可消除 UPS5.3激活。极化酸化现象为设计肿瘤靶向疗法提供了新的机会,同时促进了细胞生理学的理解。由于质子输出量较少,极化导致质子浓度增加,但与均匀的酸分泌相比,也限制了治疗靶向的区域,这使工程设计能够专注于低 pH 阈值靶向。同时,需要考虑SPEAR形成的空间和时间异质性。驱动这种极化现象的机制目前尚不清楚。细胞通过涉及细胞骨架重排、细胞外和细胞内信号传导以及细胞器分布的复杂相互作用表现出极性。几种假设,包括乳酸转运蛋白的极化激活,乳酸生成中心的不均匀分布和细胞间接触控制。目前的数据显示,SPEAR异质性是一种细胞固有特性,在体外和体内都很明显。SPEAR在单个细胞中的体外观察不仅揭示了癌细胞和非癌细胞之间的区别,而且还突出了每种癌细胞系内的内部差异。除了固有的变异性外,营养和氧气、细胞间接触、通过血液灌注或淋巴引流产生的质子冲洗、通过局部乳酸穿梭消耗乳酸和其他未知变量等因素也可能导致患者肿瘤组织中 SPEAR 的形成。轻度肿瘤酸度(pHe6.5–6.8)是一种公认的免疫抑制因子,可阻碍细胞毒性淋巴细胞、细胞因子信号传导和针对癌细胞的抗体反应。细胞活化 V 结构域免疫球蛋白抑制因子 (VISTA) 在酸性 pH 值下选择性地结合和抑制 T 细胞。酸性 pH 值 (6.5) 阻碍白细胞介素2 信号传导和 CD8+ T 细胞活化。该研究发现的 SPEAR 表型表明肿瘤中存在严重的酸化,这可能会进一步加剧免疫细胞死亡。患者肿瘤组织的离体染色显示,在基质-肿瘤组织界面处形成低于 pH 5.3 的酸壁,阻断了 CD8+ T 细胞浸入。乳酸的极化分泌会产生排他区,在细胞间接触时消灭CD8+ T细胞,这为癌细胞提供了生存优势。Qiang Feng, Zachary Bennett, Anthony Grichuk, et al. Severely polarized extracellular acidity around tumour cells. Nat Biomed Eng. 2024 Mar 4.https://www.nature.com/articles/s41551-024-01178-7