
特别说明:本文由米测技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。
原创丨彤心未泯(米测 技术中心)
编辑丨风云
研究背景
杂环芳烃是生物活性分子中普遍存在的基元,与相应的芳烃相比,杂环芳烃具有良好的物理性质。特别地,与全芳香族类似物相比,半饱和稠环系统尤其表现出更高的溶解度、靶标结合亲和力和特异性,以及更低的毒性。
然而,半饱和稠环芳烃仍存在以下问题:
1、半饱和稠环芳烃的合成方法受限
半饱和环支架的合成通常是一个艰巨的过程,需要几个复杂的步骤,如定制的功能化杂环,芳香族片段的从头合成,由于当前合成方法的限制,理想的半饱和稠环芳烃结构仍然很少。
2、开发直接成环方法对于半饱和环的形成十分重要
现有的半饱和环形成方法由于前体的合成困难或官能团与过渡金属催化剂的不相容性,特别是在含有碱性氮原子的基材中,稠合半饱和体系仍然难以获得。从市售原料直接成环的方法将在获得治疗相关候选物进行生物测试的过程中提供有效的半饱和环支架。
有鉴于此,普林斯顿大学David W. C. MacMillan等人描述了一种更直观和模块化的耦合闭合方法,用于从双自由基前体构建半饱和环系统。该平台将金属光氧化还原C(sp2)–C(sp3)交叉偶联与分子内Minisci型自由基环化相结合,将丰富的杂芳基卤化物与简单的双功能原料融合,作为双自由基合成子,快速组装成各种螺环、桥联和取代的饱和环类型,这些结构通过传统方法是极难制备的。所需原料的广泛可用性允许对未充分开发的化学空间区域进行采样,试剂控制的自由基生成导致高度区域选择性和立体特异性成环,可用于药物支架的后期功能化,进而取代冗长的从头合成。
技术方案:
1、提出并验证了“偶联-环合”策略
作者使用金属光氧化还原催化进行初始成键步骤,将天然官能团的自由基生成与基于过渡金属的交叉偶联的多功能性结合起来,然后通过第二次自由基转化发生Minisci 型环化,作者证实了该策略的可行性。
2、探究了杂芳基卤化物前体的环化
作者研究了一锅自由基环化的适用范围,表明了各种杂环以及非传统自由基受体杂环转化的可行性。
3、分析了双功能自由基前体的适用范围
作者探索了双功能自由基前体,发现溴醇在成环过程中表现良好,多种1,4二醇也被证明能够在成环方案中有效偶联双功能连接体,可实现选择性成环。
4、证实了成环方案对药物前体的可行性
作者对几种结构复杂的药剂进行了成环方案,成功合成了多种药物租房呢,证实了该方法对复杂药物分子的适用性。
技术优势:
1、提出了一种半饱和环构建的全新概念框架
作者报道了一种新的概念框架,用于模块化控制饱和环在复杂的多官能团化芳香骨架上的后期安装。该策略使用了成对接近的方法,为复杂的底物多样化提供了新的途径,并允许对具有挑战性的合成序列进行精简。
2、通过“偶联-环合”策略,高区域选择性合成稠合半饱和环
作者设想了一种双自由基合成子,可以通过光氧化还原化学从高度丰富的双功能自由基前体原料中获得,通过试剂控制自由基生成实现了高度区域选择性和立体特异性成环。
技术细节
合成策略
作者假设溴醇和二醇可能作为合适的双功能自由基前体。此外,可以利用空间原理实现多元醇底物的选择性醇活化,从而潜在地释放丰富的不对称二醇作为有价值的双自由基合成子。通过这种设计,继续探讨了通过简单的溴醇和二醇作为结构复杂的半饱和靶标的区域控制合成的合适构建单元,但溴醇交叉偶联需要使用非亲核温和胺碱2,2,6,6-四甲基哌啶,二醇交叉偶联需要使用亲核性更强的碱基奎宁环,以实现快速芳基化。
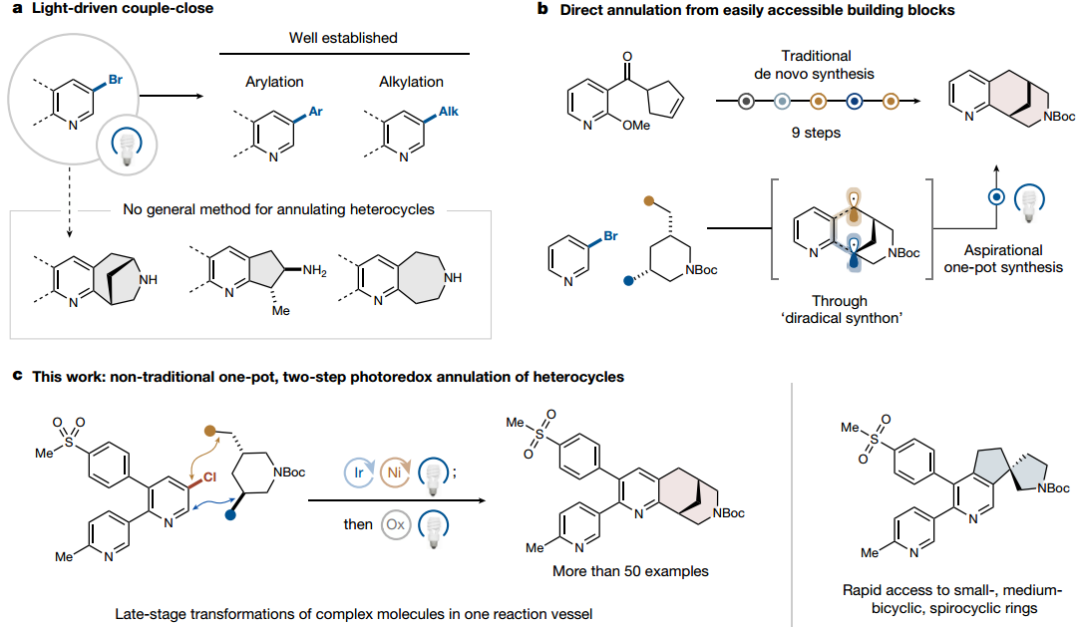
图 双功能片段直接成环
杂芳基卤化物前体的环化
在开发了一锅自由基环化的优化条件后,作者开始研究这两种反应的范围。使用N-Boc-(S)-2-amino-4-bromobutanol 2作为溴醇,N-Boc-trans-4-羟基-L-脯氨醇3作为二醇,发现了一系列结构和电子分化的杂环化合物成功成环。作者进一步研究了向各种杂环转化的可行性,在优化条件下,4位取代的溴吡啶经历2,3-环化生成5,6,7,8-四氢喹啉支架,而2-取代的吡啶仅转化为相应的5,6,7,8-四氢异喹啉。贫电子吡啶在任一转化的两个步骤中均有效形成2,3-和 3,4-环状产物,电中性和富电子吡啶也以良好的产率成环。此外,其他氮杂环化合物,如喹啉、嘧啶和吡嗪)芳香杂环也易于成环。非传统自由基受体杂环也是有效的底物,吲哚、苯并噻吩和噻唑均被证明在转化中有效。
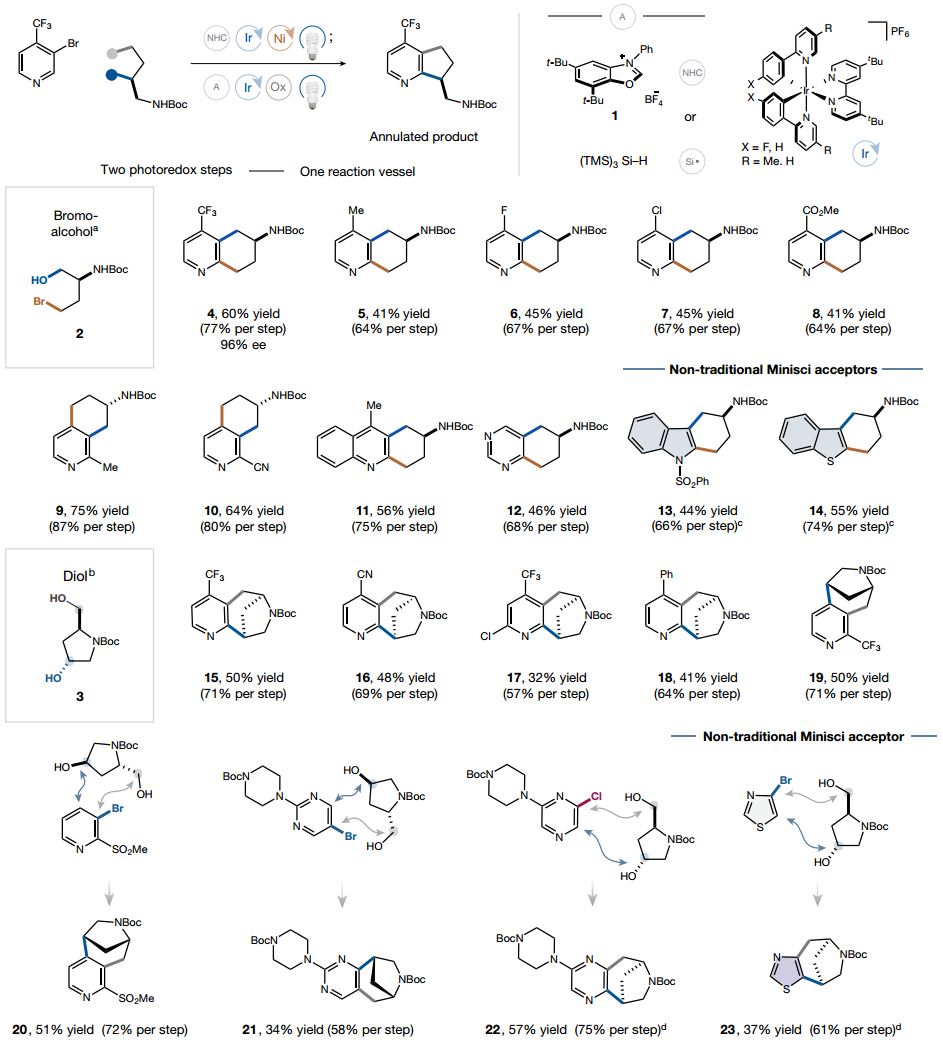
图 多种杂芳基卤化物前体的环化
双功能自由基前体
接下来作者将注意力转向双功能自由基前体,发现一系列溴醇在成环过程中表现良好。标准溴醇2的初始脱溴交叉偶联随后进行脱氧自由基环化提供了具有完全区域控制的7-氨基四氢喹啉产物。原则上,相同的序列倒转策略应适用于任何溴醇底物,可能提供从较小的一组底物中对具有不同官能团模式的几种产物的可控合成。具有不同取代模式的二醇也被发现是有效的区域选择性环化组分。多种 1,4 二醇也被证明能够在成环方案中有效偶联双功能连接体,从而能够以良好的产率构建半饱和六元环。
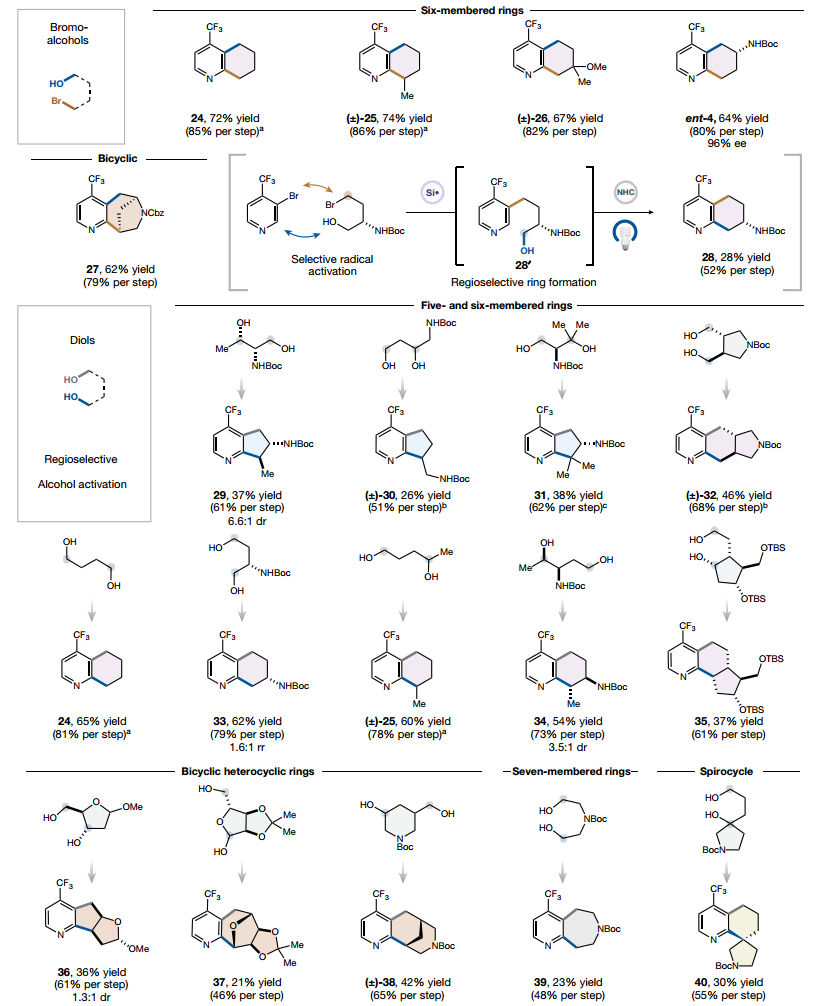
图 许多复杂的双功能连接子前体可用于此转化
药物前体
最后,作者对几种结构复杂的药剂进行了成环方案。Lumacaftor(一种用于治疗囊性纤维化的药物)和除草剂 Haloxyfop P 甲酯的半饱和类似物在一锅中以良好的产率生成。此外,噻吩 X13以良好的产率进行了自由基环化。为了进一步证明该技术的合成价值,以三步、一锅法制备了抗癌剂 Amsacrine的部分饱和融合类似物。这种新化学对复杂药物分子的适应性证明了这种转变在制药相关环境中实现后期多样化的潜力。
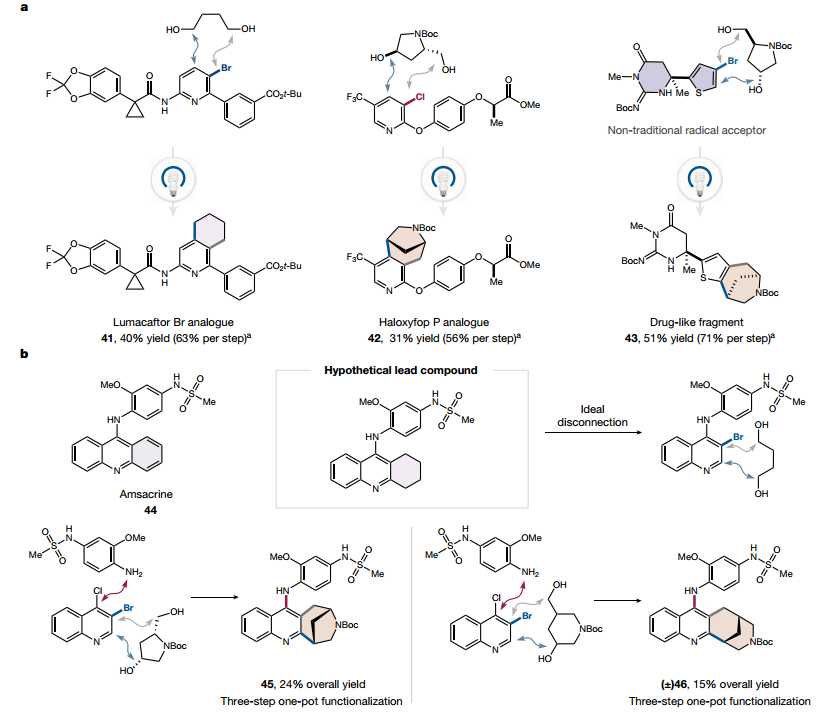
图 许多复杂的药物前体可用于这种转变
展望
总之,作者在此报告了一种采用双自由基断开方法组装具有挑战性的半饱和稠合杂环系统的收敛策略。镍催化的自由基交叉偶联,然后是杂芳基核心的自由基烷基化,允许使用商业上丰富的卤代杂环和溴代醇或二醇作为偶联配偶体,避免繁琐的合成序列,同时允许使用手性和生物衍生的起始材料。可以合成各种稠合和桥联的半饱和支架,包括许多以前合成无法接近的环系统和几种药物衍生物。
参考文献:
Long, A., Oswood, C.J., Kelly, C.B. et al. Couple-close construction of polycyclic rings from diradicals. Nature (2024).
https://doi.org/10.1038/s41586-024-07181-x











