足部溃疡是糖尿病的一种常见且具有破坏性的并发症,其特征是伤口愈合受损和形成持续的伤口。全球每年约有1860万人患上糖尿病足溃疡,这种情况发生在糖尿病患者80%截肢之前,并与死亡率增加有关。与糖尿病足溃疡相关的主要临床障碍之一是细菌定植,这归因于糖尿病伤口内氧化还原微环境的改变和免疫稳态的失调。近日,南开大学张春秋、张松等人报道了一种新形式的纳米酶,称为“脂质体酶”,旨在治疗细菌感染,并重新编程氧化还原和免疫稳态,以加速伤口愈合。
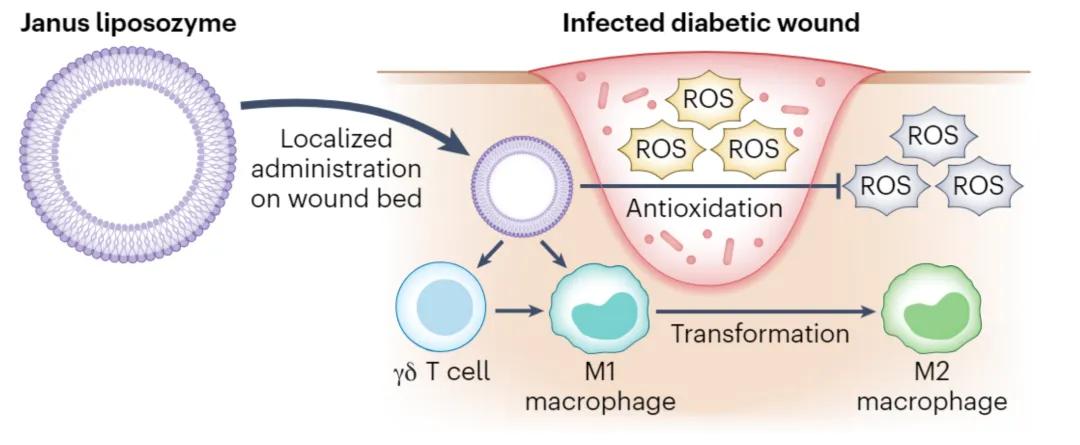
示意图
研究人员将光敏剂2-((5′-(4-(二苯基氨基)苯基)-[2,2′-双噻吩]-5-基)亚甲基)丙二腈(TDTM)装入以硒基磷脂(硒二醇基磷脂酰乙醇胺,Se DOPE)为主的脂质体中,以产生一种治疗性脂质体,称为TSeL。哺乳动物细胞和细菌细胞的膜组成不同,从而驱动治疗性脂质体的选择性内化。
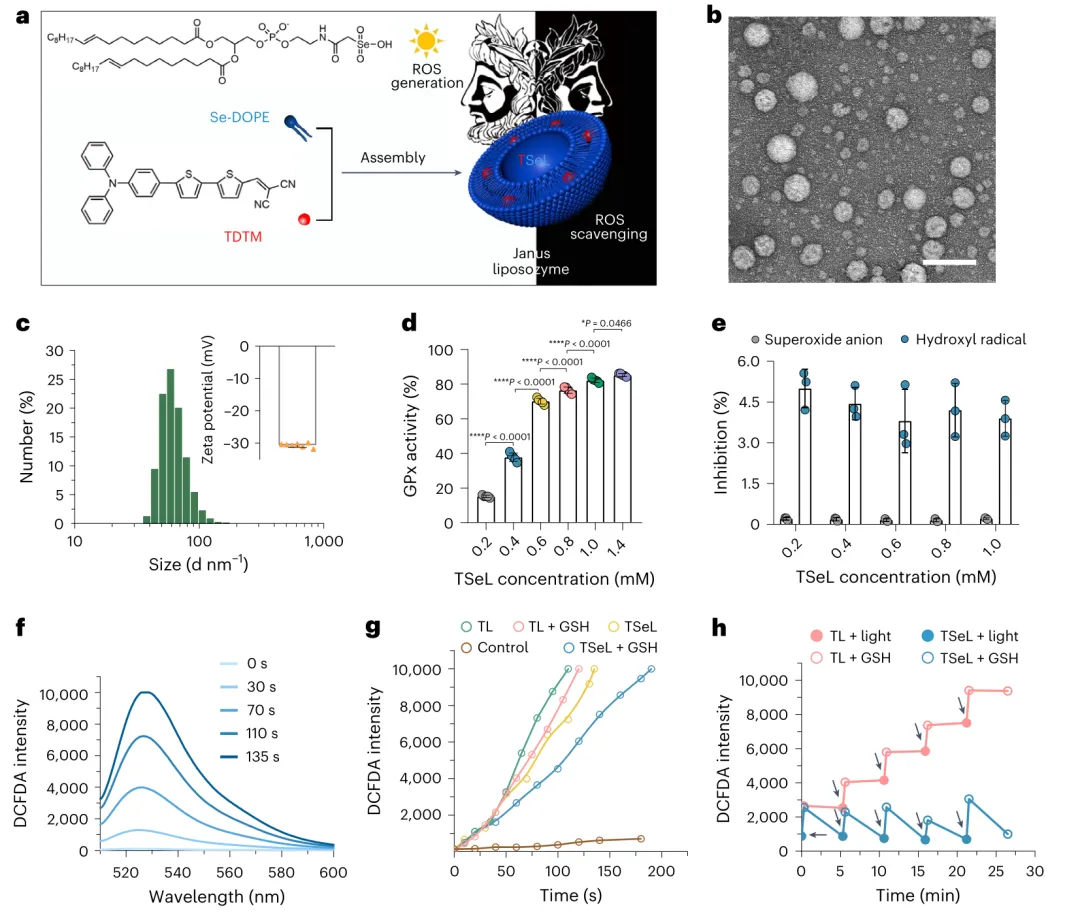
在体外,在白光照射下,TSeL表现出产生活性氧(ROS)的光动力能力,在革兰氏阳性、革兰氏阴性和多重耐药菌株的代表性模型中产生广泛的抗菌特性。硒磷脂被促进内化到TSeL中,导致过量产生的ROS被清除,这要归功于Se DOPE主导的脂质体的谷胱甘肽过氧化物酶样活性,它可以防止氧化损伤。TSeL是Janus脂质体,因为它协同结合了氧化应激机制和抗氧化机制。
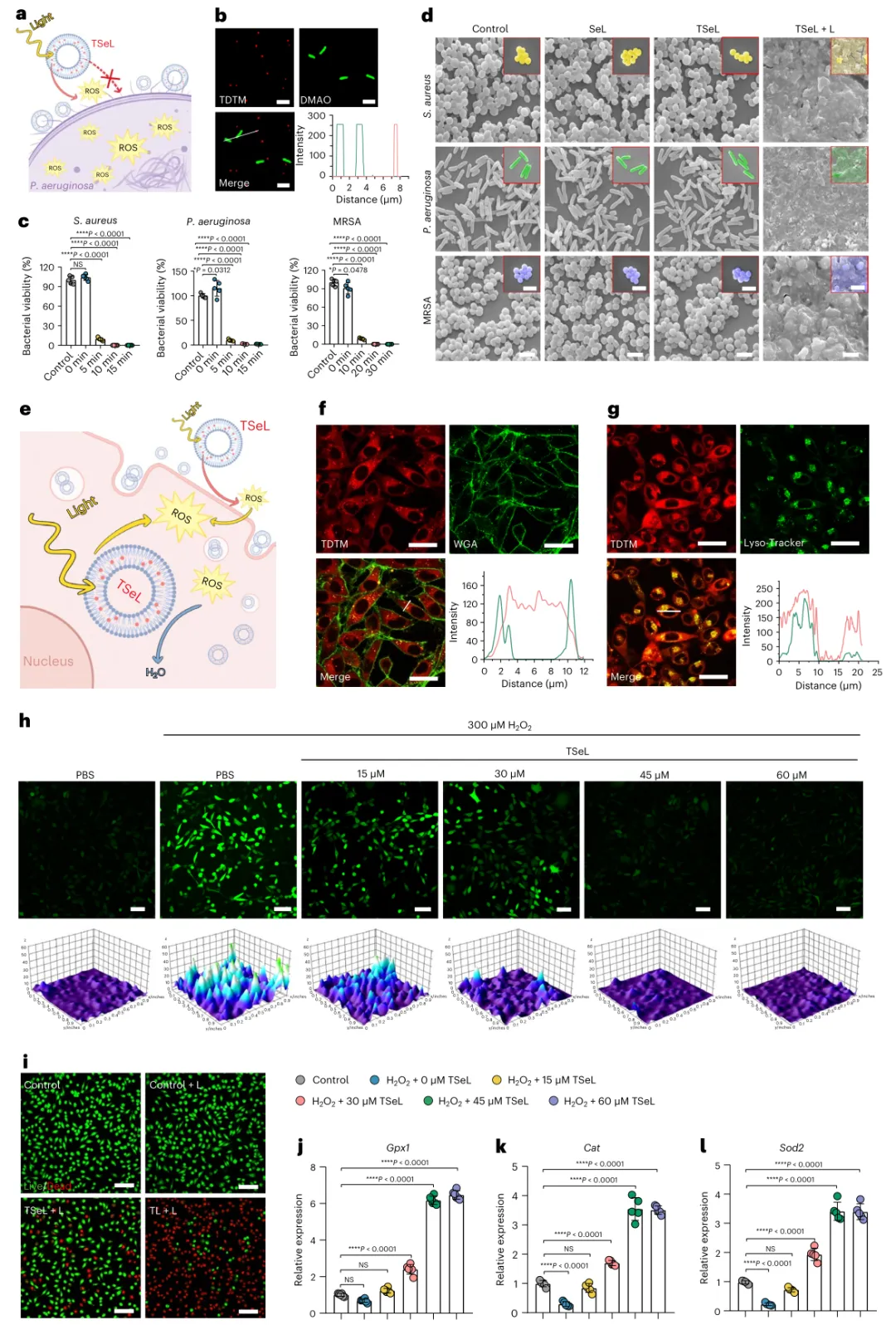
研究人员在患有耐甲氧西林金黄色葡萄球菌(MRSA)感染伤口的糖尿病小鼠体内评估TSeL,该伤口与感染的糖尿病溃疡非常相似。它们在小鼠背部造成伤口,感染耐甲氧西林金黄色葡萄球菌,并将TSeL直接注射到伤口中。与对照组相比,光控制的ROS爆发和持续的ROS清除用于治疗小鼠并产生更好的伤口闭合,如随着时间的推移肉芽组织的厚度增加和再生表皮的长度增加所示。组织良好的胶原纤维和增强的血管形成证实了治疗结果。
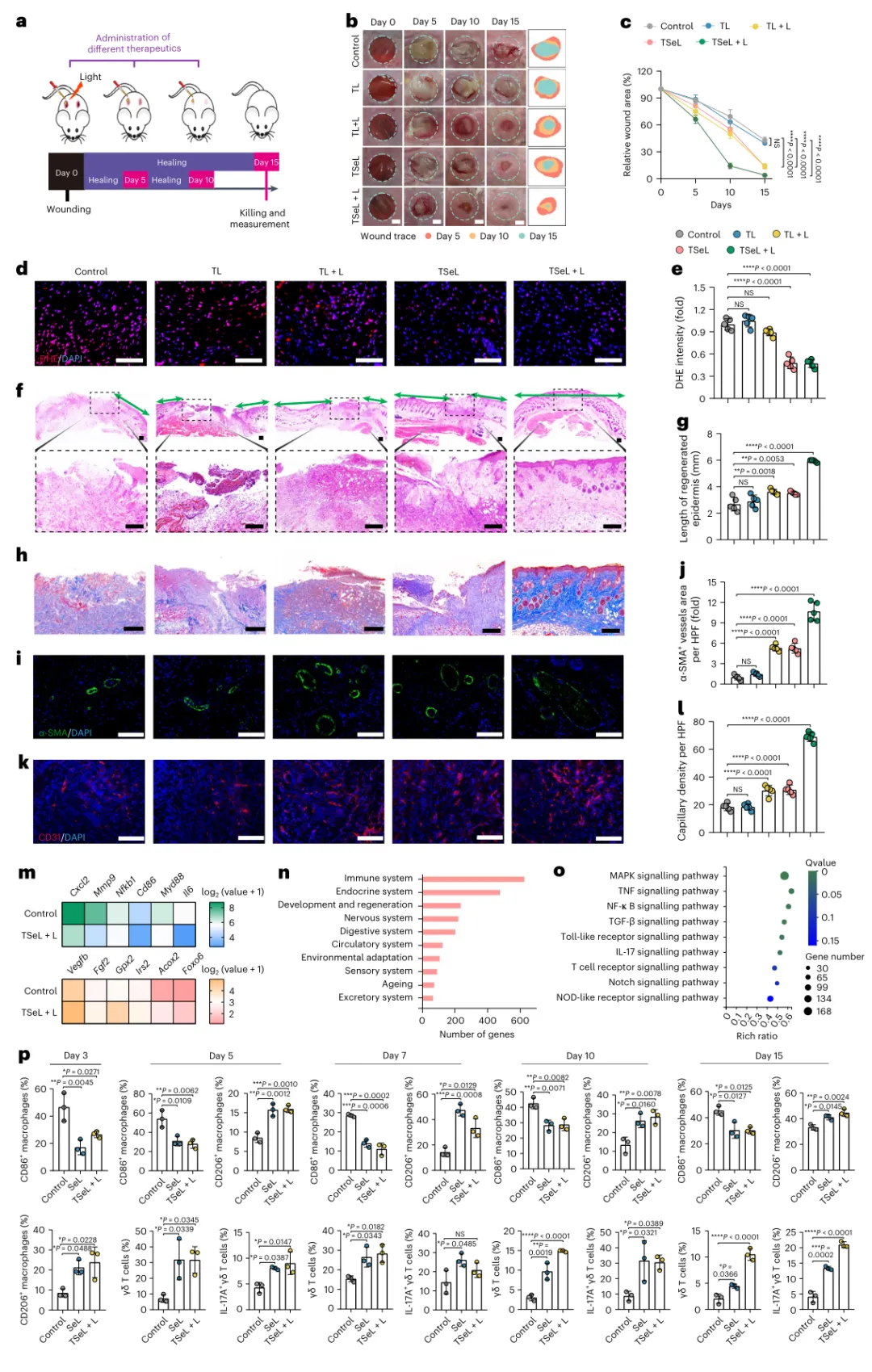
图|耐甲氧西林金黄色葡萄球菌感染STZ诱导糖尿病小鼠的体内伤口愈合效果和伤口免疫稳态分析
从机制上讲,通过在db/db小鼠(肥胖和糖尿病模型)和T细胞缺陷Rag1−/-小鼠(免疫缺陷模型)中进行全面的单细胞RNA测序,并通过皮肤渗透免疫细胞分析,研究人员确定Se DOPE主导的脂质体通过直接相互作用和γδT细胞依赖性(促炎)途径促进巨噬细胞从促炎M1样表型极化为抗炎M2样表型,从而调节免疫稳态。γδT细胞是白细胞介素IL-17的主要来源,产生IL-17的γΔT细胞对介导M1/M2样巨噬细胞转变以促进糖尿病伤口愈合至关重要。
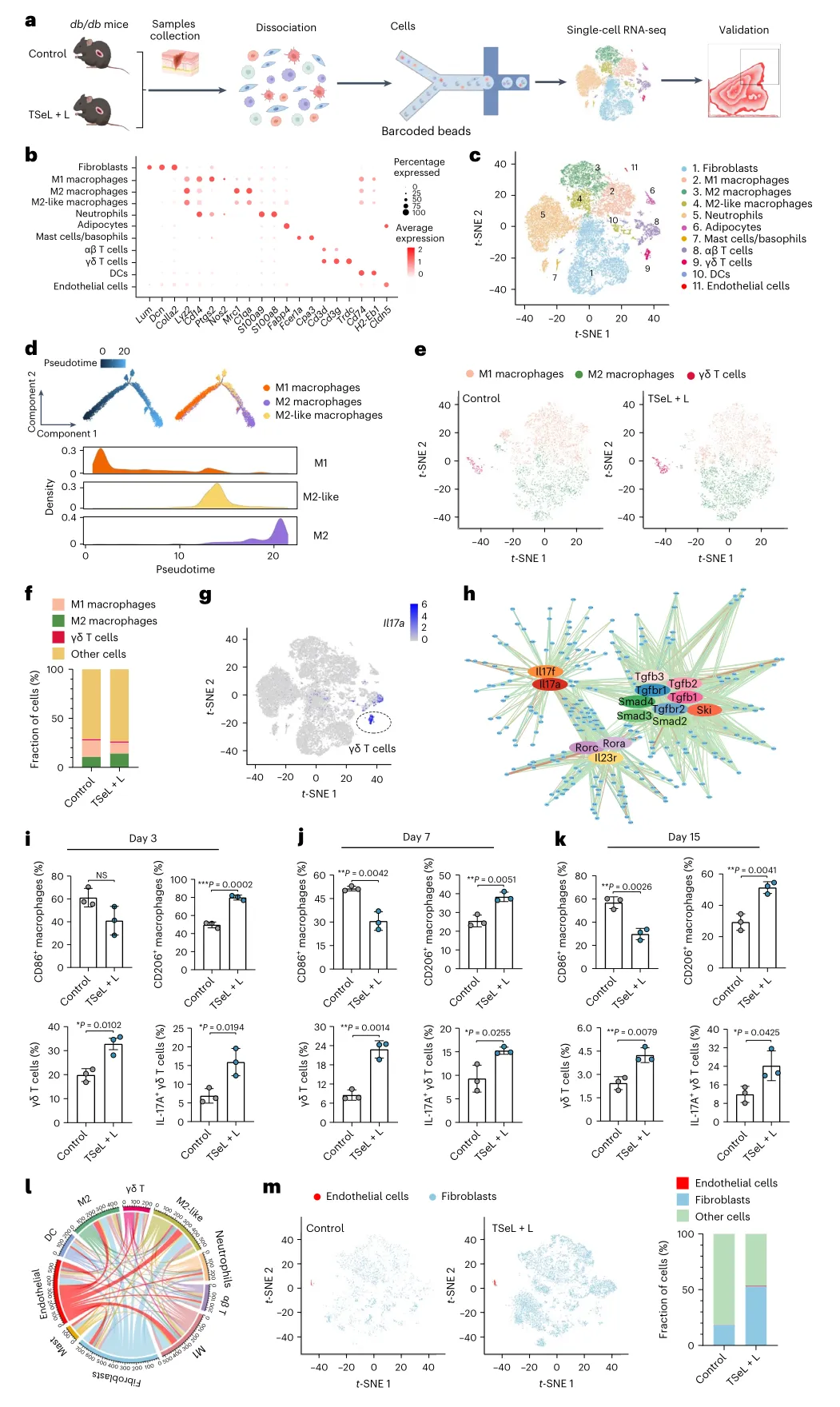
图|db/db鼠模型中的单细胞景观
最后,研究人员评估了TSeL在金黄色葡萄球菌感染的糖尿病猪模型中的疗效,以证明临床前测试的可能性。研究结果表明,在大的、感染的、全皮肤厚度的糖尿病猪伤口上使用TSeL通过减少氧化应激、刺激上皮再形成和增强血管生成,有效地促进伤口闭合。
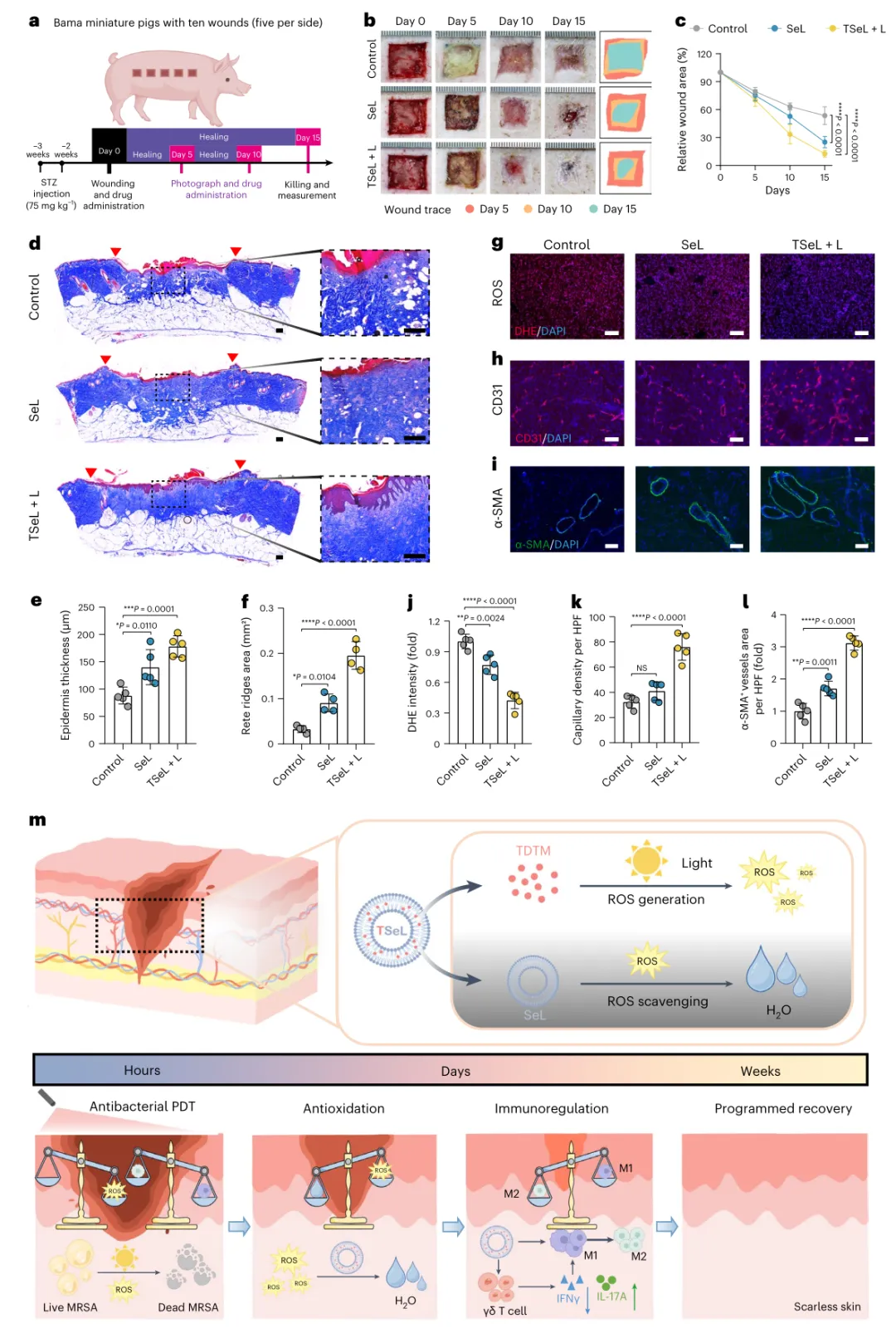
图|金黄色葡萄球菌感染糖尿病巴马小型猪的体内伤口愈合效果
这项工作无疑将导致对其脂质体的进一步研究。近年来,具有固有类酶性质的纳米酶由于能够克服与天然酶相关的缺点,包括稳定性差、成本高和具有挑战性的储存条件,引起了人们的高度兴趣。尽管如此,大多数有文献记载的纳米酶由无机纳米颗粒组成,由于急性或慢性毒性的潜在危险,阻碍了纳米酶的临床转化。研究人员提出的Janus脂质体由于其生物相容性、安全性和货物装载能力,在该领域取得了显著进展。此外,与其他纳米材料不同,该研究开发的脂质体具有强大的免疫调节作用,并在糖尿病伤口愈合过程中对T细胞,特别是γδT细胞表现出意想不到的调节作用。此外,由于其结构与天然脂质双层相似,这种脂蛋白酶可以容易地整合到各种类型的膜中,包括细胞膜、细胞器、外泌体和细菌。随着这些策略开始成熟,脂蛋白酶的潜在应用将继续增长。研究人员证明的脂质体具有显著的免疫调节能力,在治疗各种炎症相关疾病方面具有巨大潜力。Wei, T., Pan, T., Peng, X. et al. Janus liposozyme for the modulation of redox and immune homeostasis in infected diabetic wounds. Nat. Nanotechnol. (2024).https://doi.org/10.1038/s41565-024-01660-y
