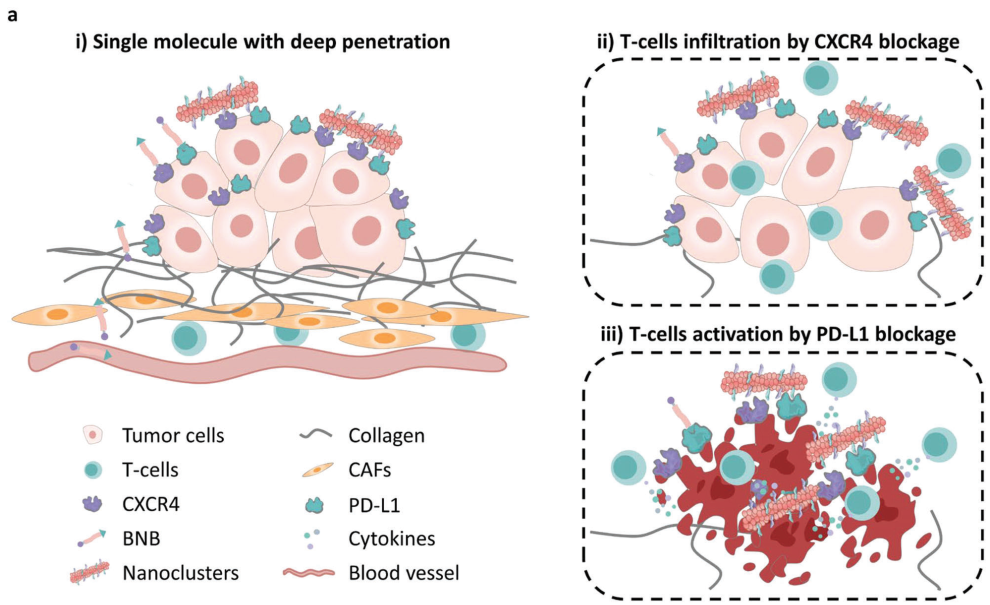
Anti-PD-L1单克隆抗体可通过激活T细胞以实现成功的肿瘤免疫治疗。然而,T细胞浸润不理想导致的细胞外基质成分的过度积累以及抗体对肿瘤的穿透性较差等问题仍会严重影响肿瘤免疫治疗的有效性。有鉴于此,国家纳米科学中心王浩研究员和哈尔滨医科大学徐万海教授开发了一种基于多肽的双特异性纳米阻断剂(BNB)策略,即在肿瘤细胞表面原位构建靶向CXCR4/PD-L1的纳米簇,从而通过阻断CXCR4促进T细胞浸润和通过占据PD-L1增强T细胞活化,以实现高效的肿瘤免疫治疗。
本文要点:
(1)研究发现,BNB策略可选择性识别并结合具有深度穿透肿瘤性能的CXCR4/PD-L1,使其在肿瘤细胞表面快速自组装成纳米簇。与传统的双特异性抗体相比,BNB具有更加独特的体内代谢行为,其在肿瘤中的消除半衰期(t1/2)为69.3小时,比其在血浆中的消除半衰期(1.4小时)长约50倍。
(2)较高的肿瘤富集和快速的全身清除等特性能够有效解决潜在的全身副作用问题。此外,过量的细胞外基质成分所产生的实体肿瘤应激也会显著降低至44%,从而促进T细胞的浸润和活化,以发挥免疫治疗效果。综上所述,该研究设计的策略有望进一步增强和拓展PD-1/PD-L1免疫疗法的临床应用效果和前景。
Xing-Jie Hu. et al. An In Vivo Self-Assembled Bispecific Nanoblocker for Enhancing Tumor Immunotherapy. Advanced Materials. 2023
DOI: 10.1002/adma.202303831
https://onlinelibrary.wiley.com/doi/10.1002/adma.202303831



















