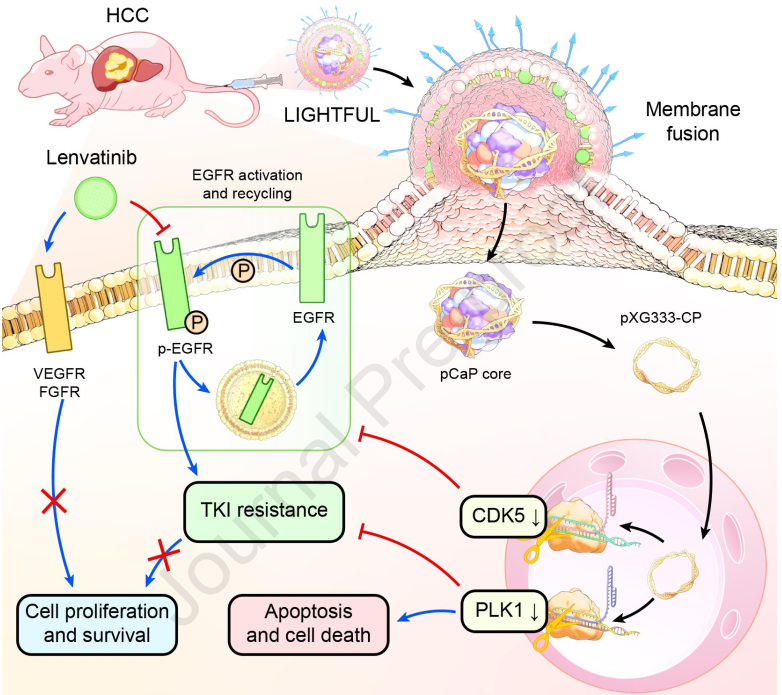
利用规律成簇的间隔短回文重复序列(CRISPR)技术靶向活化的表皮生长因子受体(EGFR)有望能够克服肝细胞癌(HCC)对酪氨酸激酶抑制剂(TKI)的耐药性。然而,利用传统脂质体将这两种不同的药物进行联合使用时,由于溶酶体捕获会导致CRISPR/Cas9递送效率有限,因此会影响该策略的协同抗HCC效果。有鉴于此,中山大学李明强研究员开发了一种靶向肝脏的基因杂交-TKI膜融合脂质体(LIGHTFUL),该脂质体可以实现高效的CRISPR/Cas9表达,以逆转EGFR介导的耐药性,从而有效地增强基于TKI的HCC治疗。
本文要点:
(1)LIGHTFUL被半乳糖修饰的膜融合脂质层所包裹,其在靶向到达肝脏部位后会与HCC肿瘤细胞发生融合,以直接高效地将内部靶向CDK5/PLK1的CRISPR/Cas9质粒(pXG333-CPs)转运到HCC细胞质中,然后在细胞核中实现高效表达。研究发现,膜融合介导的pXG333-CP递送可显著下调CDK5和PLK1,进而使EGFR失活,以提高共递送的TKI(乐伐替尼)的抗HCC效果。
(2)实验结果表明,该共递送策略能够优化CRISPR/Cas9和TKI联合治疗的协同作用,其在体外的联合指数为0.35,并且可在小鼠体内显著抑制皮下和原位HCC肿瘤(对TKI不敏感)的生长。综上所述,该研究构建的LIGHTFUL是一种独特的共递送平台,其能够将基因和化学药物相结合,以增强协同治疗。
Ke Yi. et al. A LIGHTFUL Nanomedicine Overcomes EGFR-Mediated Drug Resistance for Enhanced Tyrosine-Kinase-Inhibitor-Based Hepatocellular Carcinoma Therapy. Biomaterials. 2023
https://www.sciencedirect.com/science/article/pii/S0142961223003575



















